g-C3N4@C-TiO2纳米颗粒增强可见光驱动的体外光动力灭活HL60细胞的试验研究
方 杰,王 健,张启云,李淼淼,肖睦沧,艾保全,熊建文
(华南师范大学物理与电信工程学院,广州 510006)
白血病是一类造血系统的恶性肿瘤疾病。白血病细胞能在骨髓与其他造血组织中无限增殖,细胞凋亡受阻,从而抑制人体正常的造血功能,严重危害健康。目前治疗方法主要有干细胞移植[1]、化疗[2]、分子靶向治疗[3]等,但是这些方法或多或少存在着问题。例如,胚胎干细胞移植会引起免疫排斥反应,化疗会影响正常细胞的生理功能。而光动力疗法(photodynamic therapy,PDT)是一种选择性的、非侵入性的治疗方法,可用于治疗非肿瘤性疾病以及各种类型和部位的癌症。良好的治疗效果以及PDT与其他治疗方案并行应用的可能性使其在许多医学领域得到了广泛的应用。光敏剂(photosensitizer,PS)作为反应桥梁和能量载体显著影响PDT效果,因而对光敏剂的研发、修饰成为目前研究的热点问题。
二氧化钛(TiO2)作为一种光催化剂,因化学性质稳定、毒性低、光催化活性较高等优点使其应用于光动力治疗中成为可能[4]。但其较宽的带隙宽度和较高的电子-空穴复合率极大地限制了它的光催化效率。为了改善上述缺点,国内外学者已经采取了许多策略,如贵金属沉积[5]、半导体复合[6]、金属和非金属掺杂[7-8]、异质结结构[9]等。石墨化碳氮化物(g-C3N4)以其良好的化学稳定性、适当的带隙和易改性的电子结构在光催化领域得到了广泛的关注。然而,g-C3N4也有一些缺点,如电荷分离不充分、电荷迁移率差,导致其光催化活性较低[10]。通过将锐钛矿型TiO2与g-C3N4相结合,研究人员已经制备出了一种比原始锐钛矿型TiO2或g-C3N4对应物具有更高光催化活性的复合材料[11-18]。然而,到目前为止,利用g-C3N4作为锐钛矿型TiO2表面的壳层设计核-壳型异质结光敏剂的研究还很有限。
本研究以四氯化钛和尿素为前驱体,采用一步水热还原法制备了含有一定氧空位和表面活性位点的纳米碳改性的C-TiO2, 然后通过易操作的化学气相沉积法构建了g-C3N4表面修饰的g-C3N4@C-TiO2。通过探究C-TiO2与g-C3N4不同掺杂比例下构建的g-C3N4@C-TiO2纳米颗粒对HL60细胞的体外光动力灭活效果,验证了g-C3N4@C-TiO2纳米颗粒作为潜在光敏剂的可能性。
1 材料与方法
1.1 细胞株
由中国人民解放军军事医学科学院提供的人早幼粒白血病细胞(HL60细胞)。
1.2 试剂及仪器
无水乙醇(CH3CH2OH)、四氯化钛(TiCl4)、乙二醇[(CH2OH)2]、氨水(NH3·H2O)、葡萄糖(C6H12O6)、尿素(CH4N2O)、甲醇(CH3OH)均购自于天津致远化学试剂有限公司,台盼蓝试剂(美国Invitrogen),CCK-8试剂(日本Dojindo),RPMI-1640培养基(杭州四季青),活性氧检测试剂(北京普利莱)。
磁力加热搅拌器(江苏科析),SK2510LHC超声仪(上海科导),WFY-28型荧光分光光度计(天津拓普),UV-2600紫外可见分光光度计(日本Shimadzu),场发射透射电子显微镜(美国FEI),X射线粉末衍射仪(德国Bruker),PDT辐照室(自行设计),微量振荡器(姜堰新康),酶标仪(美国Bio-Rad),CountessTM型自动细胞计数仪(美国Invitrogen),HH·CPTW二氧化碳培养箱(上海一恒),SW-CJ型洁净工作台(苏州安泰),细胞计数板,96孔板。
1.3 试验方法
1.3.1 g-C3N4@C-TiO2纳米颗粒的制备方法
C-TiO2的制备:取3 mL四氯化钛溶于70 mL乙二醇中,得到A溶液;将A溶液置于冰水浴中,缓慢滴加2 mL氨水,边搅拌边滴加,常温下磁力搅拌1 h,确保完全水解;随后,逐滴加入0.01 g/mL的葡萄糖溶液5 mL,搅拌1 h,得到B溶液;将B溶液加入水热合成反应釜中,150℃水热处理10 h,经离心、洗涤后,将沉淀物在80℃下干燥12 h,最后将干燥的粉末以5℃/min的升温速率加热至450℃,煅烧3 h,得到初次结晶的C-TiO2。
g-C3N4@C-TiO2的制备:将尿素与蒸馏水按质量比3∶4混合形成的尿素水溶液加入坩埚中,然后称取0.3 g初次结晶的C-TiO2置于干净玻璃片上,并使玻璃片恰好卡在坩埚内2/3处,随后放入马弗炉中,以15℃/min的升温速率升温至400℃,煅烧1 h;再次以15℃/min的升温速率升温至500℃,煅烧2 h;取出玻璃片上的C-TiO2与坩埚底部的g-C3N4,按1∶1的质量比放入50 mL甲醇中搅拌至无液相,然后120℃干燥12 h,得到m(g-C3N4)∶m(C-TiO2)为1∶1的纳米颗粒g-C3N4@C-TiO2,标记为gCT-1。重复此试验方法,制备m(g-C3N4)∶m(C-TiO2)分别为1∶2、2∶1的g-C3N4@C-TiO2纳米颗粒,对应标记为gCT-0.5、gCT-2。
1.3.2 g-C3N4@C-TiO2纳米颗粒的表征方法
通过X射线衍射仪对样品中由各种元素组成的具有确定结构的化合物进行定性和半定量分析;荧光分光光度计对样品的激发、发射光谱范围及强度等进行分析;场发射透射电子显微镜对样品进行成像分析,检测样品的尺寸、核-壳结构及样品的分散性;紫外-可见分光光度计对样品的组成、含量和结构进行测定;能谱仪对样品所含元素的种类与含量进行分析。
1.3.3 HL60细胞的培养与计数
将HL60细胞接种于胎牛血清含量为10%的RPMI-1640培养基中,再把整个培养基置于5%CO2、37℃二氧化碳恒温培养箱中培养。培养一段时间后更换细胞培养液并将细胞均匀打散,用移液枪将此细胞液与台盼蓝按照1∶1的体积比混合,将混合液取至细胞计数板上,而后将细胞计数板插入CountessTM型自动细胞计数仪中进行计数,取处于对数生长期的细胞进行试验。
1.3.4 g-C3N4@C-TiO2纳米颗粒对HL60细胞的暗毒性试验与PDT试验
根据试验目的,事先规划好96孔细胞培养板,试验分为遮光板与光照板,每块板分别设置对照组、试验组和空白组。为了减少误差,同一参数设置3个重复孔。取对数生长期的HL60细胞接种到96孔板中,对照组和试验组中每孔均接种100μL细胞浓度为2×105个/mL的细胞液。接着在对照组中各加入100μL血清含量为10%的RPMI-1640培养液,试验组中分别加入100μL终值质量浓度为20、40、80、160、320 μg/mL的TiO2、C-TiO2、gCT-0.5、gCT-1及gCT-2溶液。将96孔板放到微量振荡器中震荡2 min,用无水乙醇擦拭消毒后置于培养箱中培养。培养12 h后,将光照板置于PDT辐照室(波长为410 nm、光功率为5 mW/cm2)中光照1 h,接着继续培养12 h;遮光板则避光处理连续培养24 h。每孔加入20μL CCK-8试剂[19],混合均匀后置于培养箱中继续培养2 h,使用酶标仪测吸光度(optical density,OD)值。
利用公式(1)计算细胞的相对存活率:
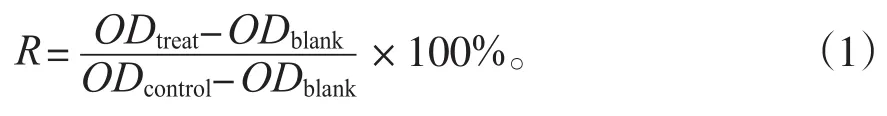
式中:R为细胞的相对存活率;ODtreat为试验组的吸光度值;ODblank为空白组的吸光度值;ODcontrol为对照组的吸光度值。
利用公式(2)计算PDT灭活效率:

式中:Pe为光动力灭活效率;ODirradiation为光照组的吸光度值;ODwithout-irradiation为遮光组的吸光度值。
1.3.5 细胞内活性氧检测
采用荧光探针标记技术检测细胞内活性氧水平[20]。取对数生长期的细胞接种于6孔板中(考虑到该试验每孔需要接种的细胞液量大,特选用6孔板),每孔均接种3 mL细胞浓度为2×105个/mL的HL60细胞,分别加入终值质量浓度为80μg/mL的药物,在培养箱中共孵育12 h。将稀释后的(用磷酸盐缓冲液稀释)浓度为 10μmol/L的DCFH-DA(2,7-dichlorodi-hydrofluorescein diacetate)溶液加入6孔板中,振荡混匀后放入培养箱中孵育30 min。取出细胞液,离心、弃上清,用磷酸盐缓冲液清洗2次,随后置于PDT辐照室中光照1 h,通过荧光分光光度计测量其荧光强度。
1.3.6 数据处理与分析
通过Origin 9.1和SPSS 24.0等软件对试验数据进行分析处理,结果均用“均值±标准差”表示。
2 结果与分析
2.1 g-C3N4@C-TiO2纳米颗粒的表征
2.1.1 X射线衍射图谱分析
纯 TiO2、C-TiO2、g-C3N4@C-TiO2样品的 XRD图谱如图1所示。从图1a中可以看出,TiO2、g-C3N4@C-TiO2纳米颗粒在2θ= 25.28°、37.80°、48.05°、53.89°、55.06°、62.69°的位置处均出现了衍射峰,分别与锐钛矿型TiO2的(101)、(004)、(200)、(105)、(211)及(204)晶面相对应,说明通过水热还原法制得的纳米颗粒主要为锐钛矿型。碳与g-C3N4结合不改变TiO2的晶体结构,样品中未见明显的碳峰,说明碳掺杂在锐钛矿晶体中。图1b是样品在24°~28°衍射角的局部放大图,C-TiO2样品被迁移到一个较低的角度。这说明在锐钛矿的间隙中掺杂了一些碳,导致间隙增大。此外,g-C3N4@C-TiO2纳米复合材料的衍射角偏移到更大的角度,表明g-C3N4和C-TiO2相互作用所产生的应力可能导致了TiO2晶格在热沉积过程中的变形和收缩。

图1 纳米颗粒的X射线衍射谱Fig. 1 XRD patterns of different nanoparticles
2.1.2 荧光激发光谱及光源分析
g-C3N4@C-TiO2纳米颗粒在波长为630 nm的激发光作用下测得的激发光谱如图2a所示。图2b是g-C3N4@C-TiO2纳米颗粒在410 nm处的激发光谱局部放大图。本实验室PDT辐照室中所用的LED光源的发射光谱如图2c所示,其发射峰位于408.64 nm处,与g-C3N4@C-TiO2的吸收谱有较好的重叠,能够实现可见光对该纳米颗粒激发的试验要求。

图2 g-C3N4@C-TiO2纳米颗粒的荧光激发光谱与PDT辐照室中LED光源的发射光谱Fig. 2 Fluorescence excitation spectra of g-C3N4@C-TiO2 nanoparticles and emission spectrum of LEDs in PDT irradiation chamber
2.1.3 透射电子显微镜成像分析
在教学实验过程中,教师按计划每学期安排4次考试,对不同教学模式下的实验班、对照班学生的学习情况进行评价,并对实验班、对照班历次考试的数学成绩进行对比分析。
图3所示为g-C3N4@C-TiO2样品的透射电子显微镜(transmission electron microscope,TEM)图像。可以观察到制备的g-C3N4@C-TiO2纳米颗粒呈球状或类方形,具有一定的分散性(图3a、3b)。从高分辨透射电子显微镜(high resolution transmission electron microscope,HRTEM)图像中可以看出(图3c),薄的g-C3N4层紧紧包裹在C-TiO2纳米颗粒周围,说明g-C3N4在C-TiO2表面修饰成功,提高了光生载流子的透射率。此外,TiO2的晶格边缘出现了明显的缺陷(图3c中的蓝色圆圈表示),这主要是由于间隙碳掺杂引起的。在图3d的HRTEM图像中,TiO2晶格条纹排列整齐,其中晶格间距0.35 nm、0.23 nm分别对应锐钛矿型TiO2的(101)、(112)晶面。此外,纳米颗粒的粒径在10~20 nm之间,满足纳米颗粒进入细胞的尺寸条件(图3e)。

图3 不同纳米颗粒的透射电镜图Fig. 3 TEM images of different nanoparticles
2.1.4 紫外-可见吸收光谱分析
图4为纳米颗粒的紫外-可见吸收光谱。发现TiO2的吸收谱主要位于387.5 nm以下,可能是由于其具有较宽的带隙宽度(3.2 eV)。相较于TiO2的吸收光谱,C-TiO2和g-C3N4@C-TiO2纳米颗粒的吸收边均不同程度地红移至可见光区,其中g-C3N4@C-TiO2纳米颗粒的吸收边红移更明显。以上结果表明,复合纳米颗粒的带隙变窄对可见光的响应有所改善。
2.1.5 能谱分析
g-C3N4@C-TiO2纳米颗粒的能谱(energy dispersive spectroscopy,EDS)分析结果如图5所示,C、N、O、Ti元素峰表明g-C3N4@C-TiO2纳米颗粒的有效合成。此外,C、N、O、Ti的质量分数分别为34.25%、1.44%、25.98%、38.33%,未发现其他杂质元素。结果证明了在C-TiO2纳米颗粒表面成功包裹了一层薄的g-C3N4。

图4 g-C3N4@C-TiO2纳米颗粒的紫外-可见吸收光谱Fig. 4 Ultraviolet-visible absorption spectrometry of g-C3N4@C-TiO2 nanoparticles
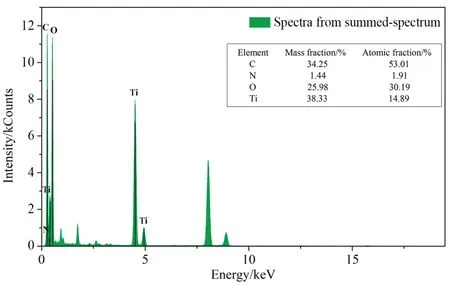
图5 g-C3N4@C-TiO2纳米颗粒的EDS能谱Fig. 5 Energy dispersive spectroscopy of g-C3N4@C-TiO2 nanoparticles
2.2 细胞试验
2.2.1 g-C3N4@C-TiO2纳米颗粒对HL60细胞的暗毒性试验

图6 暗室条件下不同掺杂比例g-C3N4@C-TiO2纳米颗粒作用下的HL60细胞相对存活率(P<0.05)Fig. 6 Relative viability of HL60 cells treated with different doping ratios of g-C3N4@C-TiO2 nanoparticles under darkroom conditions (P<0.05)
2.2.2 g-C3N4@C-TiO2纳米颗粒对HL60细胞的PDT体外灭活试验
光照下质量浓度为160μg/mL的不同药物对HL60细胞的存活率和PDT灭活效率如图7所示。由图7a可知,与无光照组相比,光照组的细胞相对存活率下降更为明显。显然,TiO2和光照的组合降低了细胞的相对存活率。当同时用C-TiO2(或g-C3N4@C-TiO2)和光照处理细胞时,HL60细胞的相对存活率降低更为明显,尤其是对于g-C3N4@C-TiO2纳米颗粒,这说明了通过在C-TiO2表面包裹g-C3N4改善了可见光照射下的光动力灭活效率。根据图7b可知,随着纳米颗粒质量浓度的增加,PDT效率逐渐提高。当药物的质量浓度超过160μg/mL时,PDT效率的升高趋势减慢。推测是因为纳米颗粒的质量浓度接近HL60细胞所能摄取的极限值。另外,当掺杂比为2:1时,g-C3N4@C-TiO2的PDT效率高于其他比例的纳米颗粒,达到(76.5±1.9)%。
2.2.3 活性氧水平分析
在光动力治疗中,当光敏剂受到特定波长的光激发时,其吸收的能量传递到周围区域的氧分子产生单线态氧,或者通过电子转移与其他底物发生光化学反应而产生自由基。这些活性氧类物质介导细胞毒性,从而导致细胞凋亡或坏死[21-23]。相关研究表明,使罗丹明、苯酚降解的是光催化过程中产生的·OH、·O2-等活性氧物质[24]。基于此,我们可以得出以下结论:光动力治疗过程中使HL60细胞灭活的是活性氧,而不是其他物质的辅助作用。
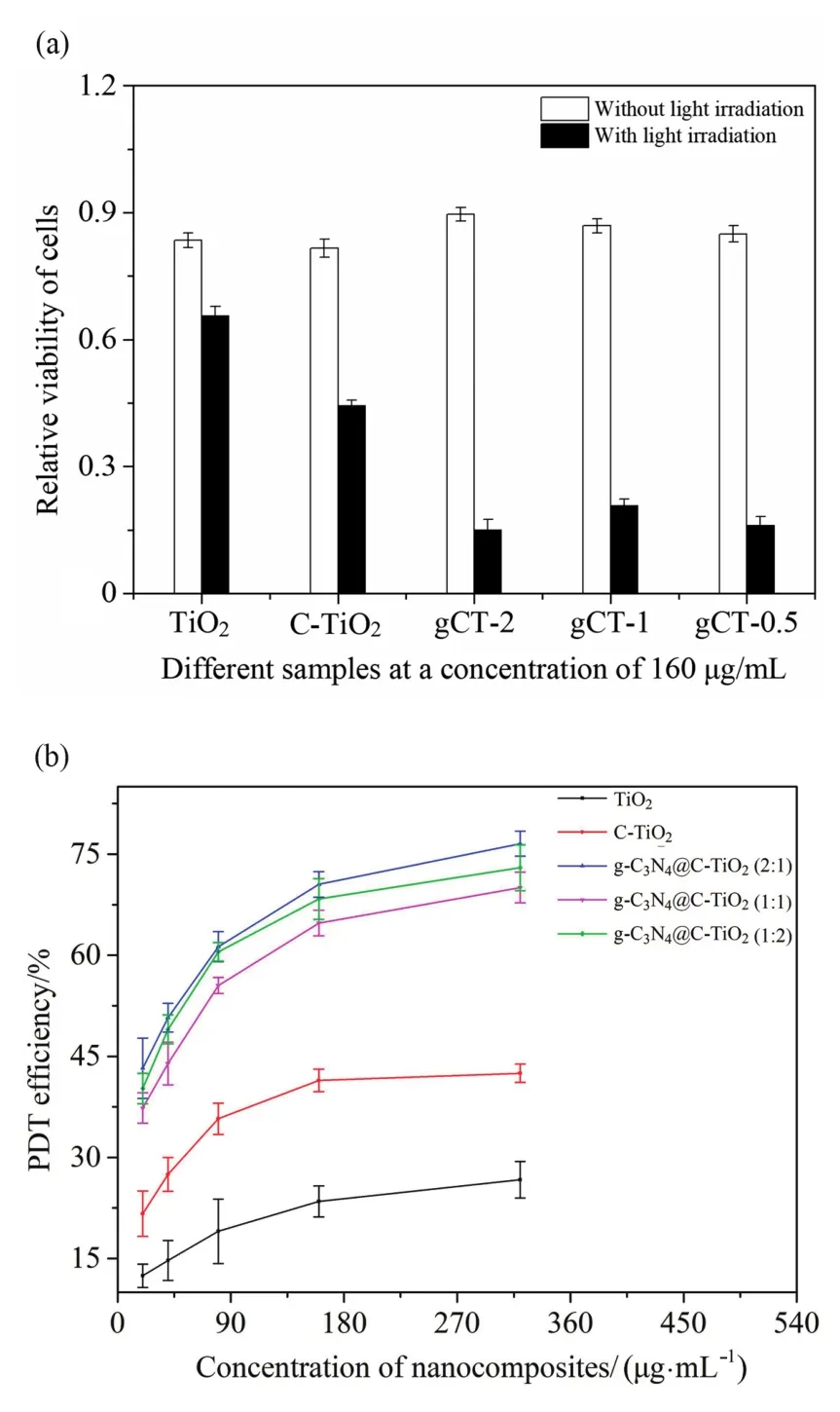
图7 光照条件下不同掺杂比例g-C3N4@C-TiO2纳米颗粒作用下的HL60细胞相对存活率及PDT效率(P<0.05)Fig. 7 Relative viability and PDT efficiency of HL60 cells treated with different doping ratios of g-C3N4@C-TiO2 nanoparticles under light irradiation (P<0.05)
该试验分析了光照后不同细胞组间活性氧的变化水平。结果如图8所示,与TiO2、C-TiO2作用的细胞组相比,gCT-0.5、gCT-1及gCT-2纳米颗粒作用细胞组的活性氧水平均有不同程度的提高,其中gCT-2的活性氧水平最高。这可能是由于TiO2容易团聚造成光照过程中照射到TiO2的面积有限,因而产生的活性氧含量较少。此外,TiO2的电子-空穴复合率高,参与氧化还原反应的光生电子和光生空穴数量少,导致细胞内活性氧含量低。然而C掺杂后形成的C-TiO2纳米颗粒的带隙宽度变窄,进一步通过g-C3N4包裹后其光催化活性和生物相容性均得到改善,同时有效降低了电子-空穴复合率,从而促进了光催化过程中的氧化还原反应,产生的活性氧含量高。这种变化与光照前后各组中细胞活性变化的趋势一致,表明光照后gCT-0.5、gCT-1及gCT-2产生的活性氧是其在PDT过程中灭活细胞的主要原因。
以上试验结果表明,g-C3N4的存在可以显著提高TiO2在PDT过程中活性氧的产量。同时,g-C3N4的含量也会影响其活性氧产生的水平。g-C3N4@C-TiO2受到特定波长的光激发时,能产生更多的活性氧,诱导细胞凋亡或坏死,从而显著提高对HL60细胞的光动力灭活效率。

图8 光照条件下不同掺杂比例g-C3N4@C-TiO2纳米颗粒作用下的HL60细胞内活性氧含量Fig. 8 Relative viability and PDT efficiency of HL60 cells treated with different doping ratios of g-C3N4@C-TiO2 nanoparticles under light irradiation
3 讨论
研究表明,对TiO2进行修饰可以显著提高TiO2光动力灭活癌细胞的效率,因为修饰后的TiO2可以降低电子-空穴复合率[25-27]。当g-C3N4@C-TiO2吸收的光能高于电子跨越带隙所需的能量值时,在g-C3N4和C-TiO2的表面会产生光生电子和空穴。一方面,与g-C3N4相比,由于C-TiO2价带上的h+氧化能力强,因此可以更好地形成·OH。从这个角度来看,空穴不能从C-TiO2的价带迁移到g-C3N4的价带,并以较高的氧化电位保留在其原始位置,故而产生·OH。另一方面,当g-C3N4与C-TiO2结合时,g-C3N4表面的费米能级比C-TiO2高,从而产生了从g-C3N4到C-TiO2的内在电场,阻止了C-TiO2价带上的h+向g-C3N4价带的移动。而由于固有电场的吸引,C-TiO2导带上的电子易迁移到g-C3N4的价带上,从而形成直接的Z型异质结[24]。同时,填充在TiO2和g-C3N4之间的高导电性碳能够快速诱导电子转移到g-C3N4的价带上,因此其在形成直接Z型光催化异质结中也起着重要作用。这显著提高了g-C3N4@C-TiO2纳米复合材料中光生电子和空穴的分离和转移效率。因此,将有更多的光生空穴与附着在C-TiO2上的水反应生成·OH,并且有更多的光生电子与溶解在水中的氧发生反应而生成活性氧。这些自由基和活性氧具有很高的氧化性质,可以氧化肿瘤细胞膜内外的生物大分子(如蛋白质、脂质、核酸等),破坏其正常的生理和代谢功能,最终导致肿瘤细胞凋亡或坏死[28-30]。
本文通过水热还原法制备了纳米碳改性的C-TiO2, 后采用化学气相沉积法构建了核-壳结构的g-C3N4@C-TiO2纳米颗粒,通过X射线衍射、荧光光谱、透射电子显微镜和紫外-可见吸收光谱对纳米颗粒的结构和光学性质进行了探究。g-C3N4在C-TiO2表面包裹后,其通过π-共轭及氢键与C-TiO2紧密结合。与纯TiO2相比,碳掺杂后导致TiO2的带隙变窄,吸收边红移,从而使TiO2可吸收的光波长范围拓展至可见光波段[31]。同时,制备的g-C3N4@C-TiO2粒径在10~20 nm,小于100 nm,能满足纳米颗粒进入细胞的尺寸要求[32]。暗毒性试验证明了g-C3N4@C-TiO2具有较好的生物相容性。此外,随着纳米颗粒质量浓度的升高,其对HL60细胞的PDT灭活效率也随之提高。当质量浓度为320μg/mL时,gCT-2对HL60细胞的PDT灭活效率为(76.5±1.9)%,而此时TiO2的PDT灭活效率为(26.7±2.7)%。由此可见,在相同条件下,g-C3N4@C-TiO2纳米复合材料对HL60细胞的光杀伤效率远高于TiO2纳米颗粒,进一步说明了g-C3N4量子点的引入可以显著提高TiO2的光催化灭活效果。
综合以上分析,制备的g-C3N4@C-TiO2纳米颗粒有良好的生物相容性和PDT灭活效果,具备作为潜在光敏剂治疗白血病的可能性,但其在体内PDT灭活效果还未被探究。因此,g-C3N4@C-TiO2纳米颗粒对活体内的HL60细胞是否具有杀伤效果以及对正常细胞是否有影响,将是我们下一步工作的重点。

