功能磁共振成像在早期诊断儿童自身免疫性脑炎及评估患儿预后中的应用价值
张晓蒙,苏秦,李琳琳,庄蒙丽,朝鲁门其其格
自身免疫性脑炎(autoimmune encephalitis,AE)是指免疫系统对中枢神经系统抗原产生异常免疫反应造成的炎症疾病,病程长、易复发,部分患儿可出现严重残疾甚至死亡[1]。早期进行诊断和及早干预治疗能有效改善预后,而AE临床表现与病毒性脑炎(viral encephalitis,VE)较为相似,仅凭首发症状很难鉴别[2]。抗神经元抗体检测是目前诊断AE的有效方法,但并非所有医院都能进行类似抗体检测,且抗体检测时间较长,等待检测结果过程容易造成诊断延误和出现病情变化。MRI是临床常见的辅助检测手段,目前已经广泛应用于神经系统疾病诊疗过程,但AE的常规MRI表现缺乏临床特异性[3]。功能磁共振成像(functional magnetic resonance imaging,fMRI)相对常规MRI能从组织水肿、血流灌注、代谢等多方面探索疾病发病机制和病理特点[4],可为疾病诊断提供新的途径。目前临床上关于fMRI对AE早期诊断研究较少,本研究以我院收治的50例AE患儿和80例VE患儿为研究对象,探究fMRI对AE的鉴别诊断价值和对患儿预后的评估价值,以期为临床AE诊疗提供一定参考依据。
1 材料与方法
1.1 一般资料
回顾性分析2018年1月至2019年5月在内蒙古医科大学附属医院收治的50例AE患儿和80例VE患儿,并分别作为AE组和VE组。AE患儿纳入标准,参考《中国自身免疫性脑炎诊治专家共识》[5]:(1)亚急性起病,病程<3个月,出现意识水平降低、嗜睡等精神症状;(2)新发中枢神经系统局灶性病变,MRI提示一侧或双侧颞叶内T2加权,磁共振液体衰减反转恢复序列(fluid-attenuated inversion recovery,FLIAR)异常信号;(3)脑脊液白细胞计数增加或颞叶病理放电;(4)脑脊液和血清中相关抗体阳性。VE患儿纳入标准[6]:(1)临床表现为发热、头痛、恶心等类似病毒感染引发脑实质损伤症状,脑脊液炎症并排除细菌和真菌感染,血清病毒相关抗体水平异常升高;(2)脑电图可见扩散性异常改变;(3)MRI可见多发、单发病灶,无明显占位;(4)抗病毒和激素治疗后好转。两组患儿均为10 d至7岁,排除其他病因,排除病灶位于幕下、存在中枢神经系统疾病史、MRI检查前接受过激素治疗、影像学资料不完整者。本研究经我院医学伦理委员会审核通过(批准文号:2020LCSY072),免除受试者知请同意。
1.2 影像学检查
在患儿治疗前进行影像学检测,包括MRI平扫,磁共振扩散加权成像(diffusion weighted imaging,DWI)、动脉自旋标记灌注成像(arterial spin label,ASL)和波谱分析(1H-magnetic resonance spectroscopy,1H-MRS)成像扫描,检测前均需水合氯醛灌肠镇静。采用3.0 T MRI超导型全身磁共振扫描仪(美国GE公司MR Discovery 750型)和头颈联合NV线圈8通道进行操作,所有患者在平扫后于肘静脉推注对比剂0.1 mmol/kg Gd-DTPA(德国拜耳),注射速度约5 mL/s。其中T2WI序列扫描参数:TR 2860 ms,TE 120 ms,ETL 12 ms,层厚 4 mm,间距 2 mm,矩阵 320×224,激励次数1次;T1WI序列扫描参数:TR 1500 ms,TE 24 ms,ETL 10 ms,层厚4 mm,间距2 mm,矩阵384×192,激励次数1次;FLAIR序列扫描参数:TR 8000 ms,TE 120 ms,层厚5 mm,间距 2 mm,TI 2000 ms,矩阵128×93,激励次数1次;DWI扫描参数:TR 5000 ms,TE 99 ms,层厚 5 mm,FOV 240 mm×240 mm,矩阵128×128,b=0.800 s/mm2,激励次数1次;ASL扫描参数:TR 3500 ms,TE 99.1 ms,层厚 6 mm,间距 1 mm,FOV 240 mm×240 mm,矩阵 416×224,FA为 90°,PLD为 1.5 s,激励次数2次;1H-MRS扫描参数:2D-CSI PERSS:TR 150 ms,TE 144 ms,层厚10 mm,FOV 20 cm×18.5 cm,VOI 100 mm×100 mm,激励次数4次。
1.3 图像处理
采用GE ADW 4.7工作站中软件将获取的原始图像分别进行处理,DWI:采用Func Tool软件对原始DWI图像处理后得到表观扩散系数(apparent diffusion coefficient,ADC)图像,结合T2高信号选择病变最明显的感兴趣区(region of interest,ROI),每个感兴趣区选取相应面积ROI进行ADC测量(通过圆形定面积ROI点画的方式,ROI面积为16 mm2)。同时选择对侧正常脑区(尽量选择对称部位脑组织)相同面积区域测定ADC值,并计算相对表观扩散系数(relative apparent diffusion coefficient,rADC)值=病灶区ADC值/正常区ADC值。局部脑血流量(regional cerebral blood flow,rCBF):采用Func Tool软件对原始ASL图像处理后得到脑血流图,选取病灶最大径面测定病灶区(作为ROI)和对侧正常脑区测定rCBF,其中ROI面积与ADC图像一致,每例患者测量3次并取平均值,计算相对局部脑血流量(relative regional cerebral blood flow,rrCBF)=病灶区rCBF值/正常区rCBF值。1H-MRS:结合T2高信号选择ROI(每例患者测量3次并取平均值),其中ROI面积与ADC图像一致,尽可能避开出血、钙化和坏死区域,观察3.2 ppm附近胆碱(choline,Cho)、2.01 ppm附近N-乙酰天冬氨酸(N-Acetyl-L-aspartic acid,NAA)、3.03 ppm 附近肌酸(creatine,Cr)等各标记物及CHo/NAA、Cho/Cr、NAA/Cr波峰下面积,计算标记物面积的相对比值。ROI由我院2名5年以上经验的影像科医师各自勾画,并测量3次取均值,然后以2名医师所测的结果平均值作为最终结果。出院后随访1年,以改良Rankin量表(modified Rankin Scale,mRS)>3分作为预后不良,分析不同预后患儿fMRI参数差异。
1.3 统计方法
采用SPSS 22.0统计软件包统计数据,符合正态分布的计量资料以(±s)表示,计数资料以百分率(%)表示,组间比较分别采用独立样本t、χ2检验;建立ROC曲线分析fMRI各项参数对AE和AE患儿预后的诊断价值。P<0.05为差异具有统计学意义。
2 结果
2.1 两组MRI平扫、DWI检查结果
AE组,男32例,女18例,年龄(1.25±0.74)岁;VE组,男49例,女31例,年龄(1.32±0.69)岁,两组患儿一般资料比较,差异无统计学意义(P>0.05)。MRI平扫检查结果显示,20例AE患儿有12例病灶分布在颞叶、海马,5例累及额叶内侧回,岛叶及扣带回,不同程度累及脑白质或脑灰质,以脑灰质为主,病灶多发于中线大致对称,病灶区可见T1等信号或稍高信号,T2稍高或高信号。VE患儿病灶分布于皮层下、皮层、侧脑室周围白质,多累及颞叶,病灶区T1稍高或高信号、T2稍高或高信号(图1,2)。
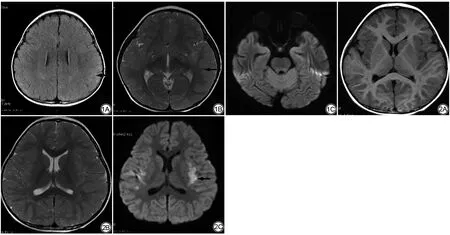
图1 男,3岁,自身免疫性脑炎(AE)患儿,病程4 d。A:双侧岛叶、颞叶、左侧扣带回片状T1WI稍高信号(箭);B:T2WI呈稍高信号,左侧颞叶显著(箭);C:DWI呈明显高信号,考虑炎性病变(箭) 图2 男,3岁,病毒性脑炎(VE)患儿,病程4 d。A:双侧颞叶、额叶、扣带回T1WI稍高信号;B:T2WI高信号,左侧颞叶为主;C:DWI呈明显高信号,考虑炎性病变(箭)
2.2 两组DWI参数比较
病灶区ADC值AE组较正常区高、VE组较正常区低,AE组病灶区ADC值、rADC值均高于VE组,差异具有统计学意义(P<0.05;表1)。
表1 两组扩散加权成像参数比较(×10-3mm2/s,±s)
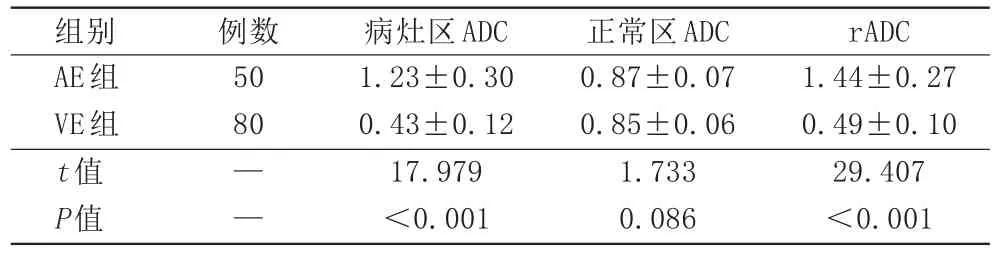
表1 两组扩散加权成像参数比较(×10-3mm2/s,±s)
注:AE:自身免疫性脑炎;VE:病毒性脑炎。ADC:表观扩散系数;rADC:相对表观扩散系数。
组别AE组VE组t值P值例数50 80——病灶区ADC 1.23±0.30 0.43±0.12 17.979<0.001正常区ADC 0.87±0.07 0.85±0.06 1.733 0.086 rADC 1.44±0.27 0.49±0.10 29.407<0.001
2.3 两组ASL参数比较
病灶区rCBF值AE组高于正常区,VE组也高于正常区,差异具有统计学意义(P<0.05),AE组病灶区rCBF、rrCBF低于VE组,差异具有统计学意义(P<0.05;表2)。
表2 两组动脉自旋标记灌注成像参数比较[mL/(100 g·min),±s]
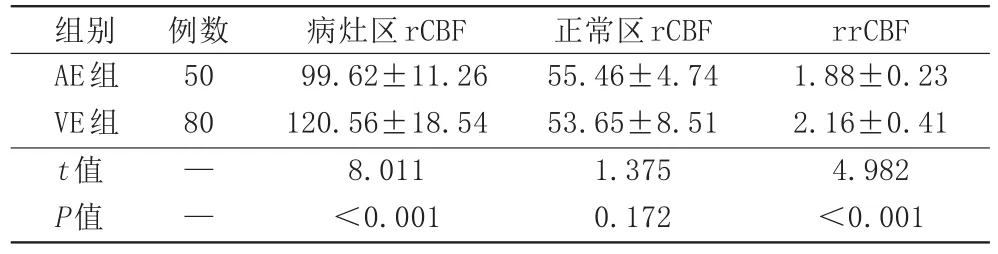
表2 两组动脉自旋标记灌注成像参数比较[mL/(100 g·min),±s]
注:AE:自身免疫性脑炎;VE:病毒性脑炎;rCBF:局部脑血流量;rrCBF:相对局部脑血流量。
组别AE组VE组t值P值例数50 80——病灶区rCBF 99.62±11.26 120.56±18.54 8.011<0.001正常区rCBF 55.46±4.74 53.65±8.51 1.375 0.172 rrCBF 1.88±0.23 2.16±0.41 4.982<0.001
2.4 两组1H-MRS参数比较
与正常区比较,AE组病灶区NAA/Cr降低、Cho/Cr、Cho/NAA无明显变化,VE组病灶区Cho/Cr升高、NAA/Cr降低、Cho/NAA升高,差异具有统计学意义(P<0.05),且AE组病灶区Cho/NAA、Cho/Cr低于VE组,NAA/Cr高于VE组,差异具有统计学意义(P<0.05;表3)。
表3 两组1H-MRS参数比较(±s)
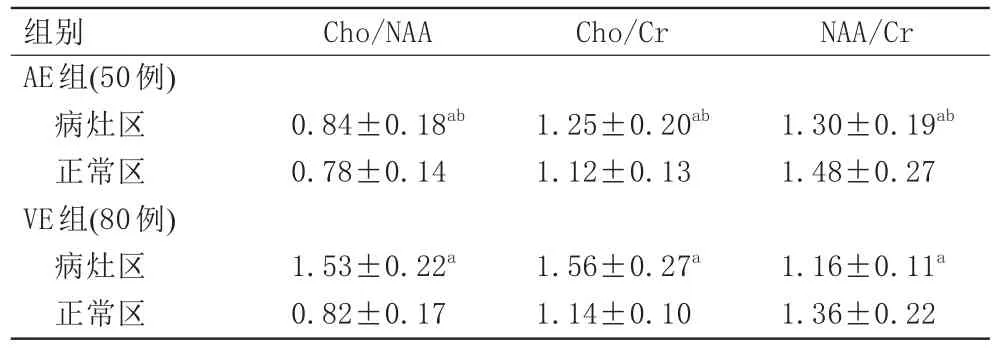
表3 两组1H-MRS参数比较(±s)
注:a:与同组正常区比较,P<0.05;b:与VE组比较,P<0.05。AE:自身免疫性脑炎;VE:病毒性脑炎;Cho:胆碱;NAA:N-乙酰天冬氨酸;Cr:肌酸。
组别AE组(50例)病灶区正常区VE组(80例)病灶区正常区Cho/NAA 0.84±0.18ab 0.78±0.14 1.53±0.22a 0.82±0.17 Cho/Cr 1.25±0.20ab 1.12±0.13 1.56±0.27a 1.14±0.10 NAA/Cr 1.30±0.19ab 1.48±0.27 1.16±0.11a 1.36±0.22
2.5 rADC、rrCBF、NAA/Cr对AE的诊断价值
rADC、rrCBF、NAA/Cr诊断AE的AUC分别为0.845、0.790、0.868,敏感度、特异度见表4和图3、4。
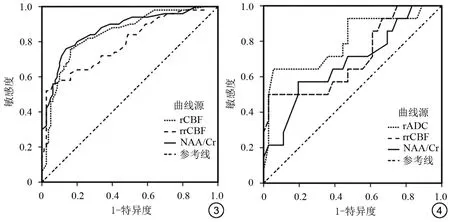
图3 局部脑血流量、相对局部脑血流量、N-乙酰天冬氨酸/肌酸诊断自身免疫性脑炎的ROC曲线图4 相对表观扩散系数、相对局部脑血流量、N-乙酰天冬氨酸/肌酸诊断自身免疫性脑炎预后不良的ROC曲线
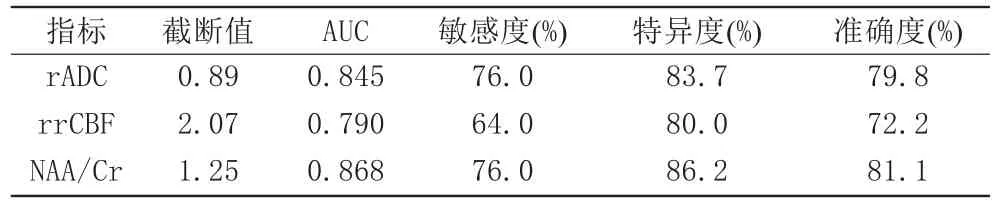
表4 rADC、rrCBF、NAA/Cr对AE的诊断价值
2.6 不同预后AE患儿病灶区fMRI参数比较
两组患儿均进行对症治疗,预后不良患儿rADC、rrCBF高于预后良好患儿,NAA/Cr低于预后良好患儿,差异具有统计学意义(P<0.05),见表5。
表5 不同预后AE患儿病灶区功能MRI参数比较(±s)
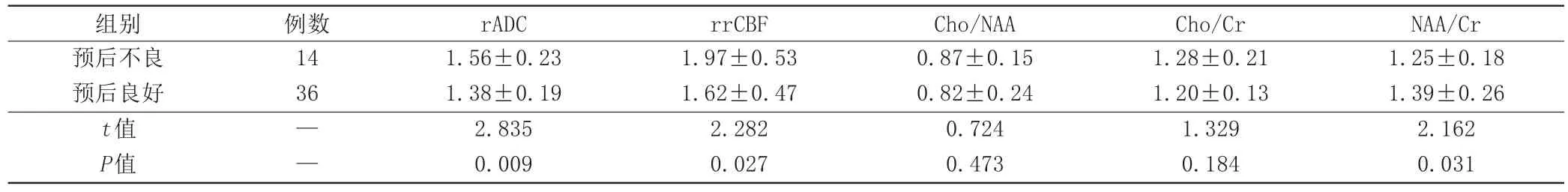
表5 不同预后AE患儿病灶区功能MRI参数比较(±s)
注:AE:自身免疫性脑炎;rCBF:局部脑血流量;rrCBF:相对局部脑血流量;Cho:胆碱;NAA:N-乙酰天冬氨酸;Cr:肌酸。
组别预后不良预后良好t值P值例数14 36——rADC 1.56±0.23 1.38±0.19 2.835 0.009 rrCBF 1.97±0.53 1.62±0.47 2.282 0.027 Cho/NAA 0.87±0.15 0.82±0.24 0.724 0.473 Cho/Cr 1.28±0.21 1.20±0.13 1.329 0.184 NAA/Cr 1.25±0.18 1.39±0.26 2.162 0.031
2.7 rADC、rrCBF、NAA/Cr对AE预后不良的诊断价值
rADC、rrCBF、NAA/Cr诊断AE预后不良的AUC分别为0.799、0.706、0.679,敏感度、特异度见表6。
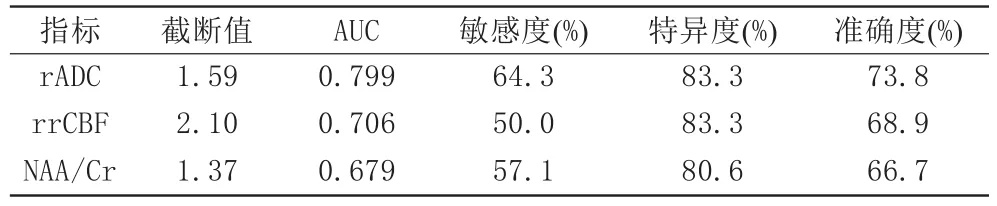
表6 rADC、rrCBF、NAA/Cr对AE预后不良的诊断价值
3 讨论
AE是患者自身抗体引发的神经元胞膜受体、突触蛋白功能障碍、炎性因子通路激活引发自身免疫疾病[7]。VE与AE在初发临床症状、实验室指标检查、影像学病灶累及部位上存在一定重叠,因此容易出现相互误诊[8-9]。两者治疗方式不同,但大多预后良好,因此在疾病初期如何有效对其进行鉴别诊断尤为重要。
3.1 常规MRI显示AE特征情况
目前临床AE诊断主要依靠临床症状、影像学检查、血清及脑脊液抗体筛查和治疗反应,但治疗反应在疾病早期无法获得,临床表现和常规MRI表现无明显特异性,抗体筛查阳性率低,因此AE早期诊断是临床工作难点。本研究中可见AE患儿的常规MRI主要表现为累及颞叶内侧边缘的脑炎性改变,同时可见弥散、多发、无明显病灶,与VE患儿无法进行有效区分,这与多项研究结果一致[10],此外,已有研究发现在单纯疱疹VE后可继发出现AE[11],两组患儿MRI显示病灶范围及信号相似是否与此有关尚不明确,因而需要寻找更为有效的鉴别诊断方法。
3.2 不同fMRI显示AE特征情况
根据2017年中华医学会神经病学分会提出的AE诊疗指南[5],仅将头颅MRI平扫和增强作为AE的神经影像学判断标准,但笔者发现头颅MRI平扫和增强在VE和AE中鉴别效果较差,而fMRI的各项参数在两者之间具有显著差异,提示fMRI可为VE诊断提供新的参考依据。相关研究显示,fMRI相对常规MRI能从组织水肿、血流灌注、代谢等多方面探索疾病发病机制和病理特点,可为疾病诊断提供新的途径[12]。DWI是唯一能在活体上监测体内水分子微观运动的MRI成像方法[13]。本研究中AE患儿病灶区ADC值多表现为正常或轻度升高,而VE患儿多见ADC值较正常区降低,AE患者ADC值升高主要与局部炎症破坏血脑屏障、组织间水分增多有关[14];而VE早期病理改变主要为细胞毒性水肿,故病变较正常组织ADC值降低[15]。但是有学者发现在AE患者中ADC值并未降低,这可能与AE患者处在亚急性期相关[16]。
与DWI相比,ASL检测的是脑组织局部血流动力学变化[17]。本研究结果证实AE和VE的病灶区rCBF均较正常区升高,但rrCBF在VE中更高。这可能与VE免疫应答以抗原-抗体复合物的体液免疫和固有免疫为主,可见吞噬细胞及炎症因子聚集、浸润,血管扩张及局部血流量增加,而VE免疫应答以更温和的体液免疫有关[18],从而使rCBF在VE患者表现为明显升高。
1H-MRS可通过观察细胞代谢物浓度变化来分析病变特点[19]。本研究结果显示AE和VE患儿均表现为NAA降低,而VE患者Cho正常或升高,主要原因是早期AE患者脑组织中均未见胶质细胞缺失或髓鞘病变,细胞坏死并不明显,因而Cho、Cr改变也可能不明显[20]。而VE患者早期病毒感染神经元多产生剧烈免疫反应,胞膜结构破坏,因而Cho由于炎症反应导致脱髓鞘病变而升高[21]。故Cho/Cr、Cho/NAA均无法为鉴别诊断提供可靠依据;有学者认为,NAA降低程度与神经元损伤程度具有一定相关性,AE早期神经元损伤较少,而VE神经元坏死病变较为严重;而Cho变化与VE和AE的病理演变特点有关,因此只参考某一个时间点变化无法反映病情和进行鉴别诊断。
3.3 不同fMRI参数与AE患儿预后关系
AE患儿预后与病灶数量、累及范围、治疗是否及时等密切相关,其中DWI和ADC值可以帮助判断疾病扩散情况。本研究结果显示,预后不良VE患儿rADC、rrCBF高于预后良好患儿,NAA/Cr值低于预后良好患儿,提示rADC、rrCBF、NAA/Cr均能在一定程度上反映预后。建立ROC曲线分析rADC、rrCBF、NAA/Cr诊断AE的AUC分别为0.845、0.790、0.868,诊断AE预后不良的AUC分别为0.799、0.706、0.679,提示rADC、rrCBF、NAA/Cr对AE及AE预后不良均具有一定的临床诊断价值。目前采用fMRI评估AE患儿预后的研究较少,有学者采用增强MRI评估AE患儿预后,其预测AE预后不良的AUC为0.624[22],低于本次fMRI的预测结果,提示采用fMRI相对于常规MRI能有效提高对AE患儿预后的诊断价值,这可能与fMRI参数能更有效反映患儿血流动力学变化和神经元损伤有关。
综上所述,DWI中的rADC值、ASL中的rrCBF值、1H-MRS中的NAA/Cr值可分别从组织间隙水肿、脑组织血流灌注、生化指标代谢方面表现AE发病特点,与常规MRI参考有助于AE的早期鉴别和预后预测,为AE的诊断和治疗提供参考。但本研究还存在不足之处,还有学者认为,rADC、rrCBF、Cho等参数变化与AE和VE病理演变特点有关,因此仅参考某时间点的数值情况无法有效反映疾病动态变化和作为预后的可靠参考。同时本次纳入样本量较低,具体情况有待扩大样本量、进行持续性研究和论证。
作者利益冲突声明:全体作者均声明无利益冲突。

