辣椒ASR基因的克隆与表达分析
蔡小桃 张颖 韦丽丽 徐小万 谢炳春 庄泽岳 吴智明






辣椒ASR基因的克隆與表达分析
蔡小桃1,张 颖1,韦丽丽1,徐小万2,谢炳春1,庄泽岳1,吴智明1*
(1仲恺农业工程学院园艺园林学院,广州 510225;2广东省农业科学院蔬菜研究所/广东省蔬菜新技术研究重点实验室,
广州 510640)
摘要:【目的】克隆辣椒ASR(ABA-stress-ripening)基因进行生物信息学分析并探究其在不同组织和非生物胁迫处理下的表达模式,为深入研究ASR基因家族在辣椒果实发育和逆境胁迫中的作用机制提供参考。【方法】以遵辣1号辣椒为材料克隆其ASR基因,对该基因家族成员进行生物信息学分析和系统进化分析,运用实时荧光定量PCR检测其在不同组织及在ABA、高温、高盐和干旱胁迫处理下的表达模式。【结果】克隆的2个辣椒ASR基因分别命名为CaASR2和CaASR3,基因全长分别为987和938 bp,最长开放阅读框(ORF)分别为333和339 bp,分别编码110和112个氨基酸,蛋白分子量分别为12.45和12.73 kD,理论等电点(pI)分别为7.47和6.50,均为亲水性蛋白。结合前人克隆的辣椒CaASR1基因分析,结果显示,CaASRs预测位于细胞核,均含有ABA/WDS特征结构域;基因结构分析结果显示,辣椒ASR基因均含有2个外显子和1个内含子,启动子区域均包含ABA响应元件ABRE。CaASR1、CaASR2和CaASR3氨基酸序列分别与番茄(Solanum lycopersicum)基因组中的ASR蛋白氨基酸序列NP_001269248.1(80.20%)、NP_001307920.1(91.30%)和NP_001234137.1(96.43%)有非常高的相似性,表明其进化的相对保守性。3个ASR基因在辣椒花中表达量最低,在根、茎、叶和种子中表达量中等,但均随着果实的发育表达量逐渐升高,特别是在转色和成熟果实中。ABA、高温、高盐和干旱胁迫处理下,基因的表达量均显著升高(P<0.05),其中以CaASR3响应最快,且上调表达量高于其他同源基因。【结论】辣椒基因组中3个ASR基因具有ASR基因家族的典型特征,并在辣椒不同组织和非生物胁迫响应中发挥重要作用。
关键词: 辣椒;ASR;果实发育;非生物胁迫;基因表达
中图分类号: S641.3 文献标志码: A 文章编号:2095-1191(2021)11-3049-10
Cloning and expression analysis of ASR genes in pepper
(Capsicum annuum L.)
CAI Xiao-tao1, ZHANG Ying1, WEI Li-li1, XU Xiao-wan2, XIE Bing-chun1,
ZHUANG Ze-yue1, WU Zhi-ming1*
(1College of Horticulture and Landscape Architecture, Zhongkai University of Agriculture and Engineering, Guangzhou
510225, China; 2Vegetable Research Institute/Guangdong Key Laboratory for New Technology Research
of Vegetables, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China)
Abstract:【Objective】ASR(ABA-stress-ripening) genes were cloned in this study. By bioinformatics analysis and expression analysis under different tissues and abiotic stress treatments, to provide a reference for further study on the mecha-nism of ASR gene family in pepper fruit development and abiotic stress. 【Method】ASR genes were cloned from Zunla-1 cultivar. A series of bioinformatics and phylogenetic analysis were carried out to evaluate the family members. The tissue specific expression patterns and the expression patterns under ABA, high temperature, high salt, and drought stress were detected by real-time fluorescence quantitative PCR. 【Result】Two ASR genes were cloned, named as CaASR2 and CaASR3. The full lengths of CaASR2 and CaASR3 were 987 and 938 bp, and the open reading frame(ORF) were 333 and 339 bp in length, which encoded 110 and 112 amino acids, respectively. Their molecular weights were 12.45 and 12.73 kD, and their theoretical isoelectric points(pI) were 7.47 and 6.50, respectively, and they were hydrophilic protein. The results showed that CaASRs were predicted to be in the nucleus and contained ABA/WDS(ABA/water deficit stress) domain. All CaASRs genes contained two exons and one intron, and the promoter region contained ABA response element ABRE. The amino acid sequences of CaASR1, CaASR2 and CaASR3 were highly similar to those of ASR protein amino acid NP_001269248.1(80.20%), NP_001307920.1(91.30%) and NP_001234137.1(96.43%) in tomato(Solanum lycopersicum), which indicated the relative conservation of evolution. The results of tissue specific expression analysis showed that they were expressed the lowest in flower, and the moderate in root, stem, leaf, and seed, gradually increased with fruit grew, and especially highly expressed in color-changing fruit and mature fruit. The expression levels were significantly increased under ABA stress, high temperature, high salt and drought(P<0.05), and CaASR3 had the fastest response, whose up regulated expression levels were higher than that of other homologous genes. 【Conclusion】Three ASR genes in pepper genome have typical characteristics of the ASR family and play important roles in different tissue and abiotic stress resistance in pepper.
Key words: pepper(Capsicum annuum L.); ASR(ABA-stress-ripening); fruit development; abiotic stress; gene expression
Foundation item: National Natural Science Foundation of China(32072598); The Characteristic Innovation Project of Colleges and Universities in Guangdong(2018KTSCX099)
0 引言
【研究意义】辣椒(Capsicum annuum L.)富含维生素C和辣椒素,营养价值极高,品种资源丰富,栽培适应性广,在保证我国蔬菜周年均衡供应、农民增收与脱贫致富中发挥了重要作用。2018年我国辣椒播种面积已达213.3万ha,年产值约2500亿元,是我国栽培面积最大和经济效益最高的蔬菜作物之一(邹学校等,2020)。由于栽培范围广,加上近年来气候的剧烈变化,高温、干旱及土壤盐渍化等逆境严重影响了辣椒栽培生产,带来巨大损失。ASR(Abscisic acid-,stress- and ripening-induced)蛋白是一类植物特有的亲水性蛋白,在植物的生长、发育与逆境胁迫响应中发挥重要作用(González and Iusem,2014)。克隆并深入研究ASR基因的特征、进化和表达模式,对辣椒丰产和抗逆性改良具有重要意义。【前人研究进展】ASR基因家族是从种子植物进化而来,首次在番茄果实中被鉴定(Iusem et al.,1993),随后在单子叶和双子叶植物均有发现ASR蛋白,海岸生长的盐生植物海蓬子(Salicornia brachiata)也鉴定出含ASR基因(Jha et al.,2012),这些同源基因主要受水分亏缺、盐胁迫、激素脱落酸(ABA)、低温和光强的调控。在不同物种中,ASR基因的数量不同,如水稻(Oryza sativa)ASR基因家族有6个已知成员(Philippe et al.,2010),番茄(Solanum lycopersicum)有5个成员(Frankel et al.,2006),葡萄(Vitis vinifera)仅1个已知成员(Çakir et al.,2003),玉米(Zea mays)则多达9个成员(Virlouvet et al.,2011);而在十字花科植物如拟南芥(Arabidopsis thaliana)中缺失(Carrari et al.,2004)。研究发现,ASR蛋白大多包含2个高度保守的区域:N端富含6~7个组氨酸残基区域,C端约70个氨基酸残基和核定位信号肽区域,核定位信号NLS已被证明无功能(Ricardi et al.,2012),亚细胞定位研究证实大多数植物ASR蛋白主要存在于细胞核和细胞质中。ASR蛋白的另一个显著特征是包含1个特有的保守ABA/WDS(ABA/water-deficit stress)氨基酸结构域,其以基因家族的形式存在。大多数植物ASR基因很短,编码低分子量蛋白,通常作为糖、脱落酸和胁迫信号通路的共同成分,并参与果实发育和糖代谢等植物生命活动的许多过程,但ASR基因的生理作用和调控机制尚未明确(程维舜等,2013)。ASR蛋白还作为转录因子影响植物代谢,如水稻中OsASR5蛋白调节保护细胞免受Al诱导的应激反应(Arenhart et al.,2013)。Huang等(2020)发现CaASR1(Capana04g001289)作为一个正调控因子能与CabZIP63相互作用,加强辣椒对青枯病的抗性。对番茄ASR基因进行的表观遗传试验证明,水分胁迫会引起表观遗传标记的变化(González et al.,2011)。【本研究切入点】研究辣椒ASR基因家族的生物学功能,对于阐述辣椒果实成熟和对不利环境的耐受性机制具有重要意义。辣椒中有关ASR基因的研究鲜见报道,因此本课题组前期基于测序的辣椒基因组信息,通过同源性比对方法,从遵辣1号辣椒基因组中鉴定到3个ASR基因成员(基因ID分别为Capana04g001287、Capana04g001288和Capana04g00 1289),并初步分析了其在果实发育中的表达(张圣旭,2016)。【拟解决的关键问题】利用生物信息學手段全面分析ASR基因家族的特征,检测其在不同组织及在ABA处理和多种非生物胁迫下的表达模式,为后续研究ASR基因家族在辣椒生长发育及响应非生物胁迫中的功能机制提供理论依据。
1 材料与方法
1. 1 试验材料
辣椒自交系ZY35和遵辣1号品种分别由广东省农业科学院蔬菜研究所和遵义市农业科学研究院辣椒研究所提供。植物RNA提取试剂盒购自北京华越洋生物科技有限公司;2×Hieff Robust PCR Master Mix,Hifair Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR反转录试剂盒,2×Hieff Canace Gold PCR Master Mix高保真酶预混液,以及Hieff clone zero TOPO-Blunt Cloning Kit等试剂盒购自上海翊圣生物科技有限公司;大肠杆菌DH5α感受态细胞购自上海唯地生物技术有限公司;胶回收试剂盒E.Z.N.A. Gel Extraction Kit和质粒提取试剂盒E.Z.N.A. Plasmid DNA Mini KitⅠprotocal-spin protocol购自美国Omega Bio-Tek公司;荧光定量试剂盒SYBR Premix Ex TaqTM购自日本TaKaRa公司;其他生化试剂均为国产分析纯。主要仪器设备:5810 R高速冷冻离心机(Eppendorf,德国);PCR仪(Bio-Rad,美国);4100凝胶成像仪(上海天能科技有限公司);荧光定量PCR仪CFX ConnectTM Real-Time System(Bio-Rad,美国)。
1. 2 样品采集及胁迫处理
辣椒自交系ZY35于2020年8月进行播种,9月露地定植于广东省农业科学院白云试验基地,盛果期从5个单株上采取根、茎、叶、花、幼果、转色期果实、成熟果和种子等组织,每个组织样品分成3份,用于荧光定量分析。于2021年1月将遵辣1号种子浸泡过夜,在28 ℃恒温培养箱内催芽,种子发芽后播种于塑料营养钵,在塑料大棚内养护,待长至6片真叶时(约40 d),选取生长势良好、长势基本一致的幼苗进行胁迫处理。试验设盐胁迫(200 mmol/L NaCl)、干旱胁迫(400 mmol/L甘露醇)、高温胁迫(42 ℃)和ABA胁迫(30 μmol/L ABA)4个处理,以正常栽培下清水浇灌处理作为对照(CK)。每组处理10棵幼苗,每个处理设3次重复。处理0、3、6、12和24 h后取辣椒第3~4片叶用于非生物胁迫后续基因定量分析。辣椒组织样品经液氮速冻后立即放入-80 ℃超低温冰箱保存备用。
1. 3 基因克隆与测序
自交系ZY35辣椒果实总DNA的提取参照CTAB法(王关林和方宏筠,2014)。参照试剂盒说明书提取不同组织和逆境处理下叶片的总RNA,经1%琼脂糖凝胶电泳检测其质量后利用试剂盒进行反转录,合成的cDNA保存在-20 ℃冰箱备用。根据遵辣1号基因组网站(https://www.solgenomics.net/)下载已有的辣椒ASR基因(登录号Capana04g001287和Capana04g001288)序列信息(Qin et al.,2014),利用Primer Premier 5.0设计合成基因全长扩增的上、下游引物(表1),分别以自交系ZY35辣椒果实的DNA和cDNA为模板进行PCR扩增。PCR反应体系:模板2.0 μL,上、下游引物各2.5 μL,Gold Mix 25.0 μL;ddH2O补至50.0 μL。扩增程序:98 ℃预变性3 min;98 ℃变性10 s,68 ℃退火30 s,进行33个循环;72 ℃延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测,确定条带大小正确,进行胶回收。根据试剂盒操作说明,将纯化产物连接到pESI-Blunt载体并转化大肠杆菌DH5α感受态细胞,挑取单克隆在LB液体培养基中培养,进行菌液PCR鉴定,挑选阳性克隆送至生工生物工程(上海)股份有限公司测序。测序结果使用DNAMAN 6.0进行比对。
1. 4 基因表达分析
利用实时荧光定量PCR对基因进行表达分析,以Actin为内参,引物见表1。反应体系:TB Green Premix Ex Taq(Tli RNaseH Plus)10.0 μL,模板cDNA 2.0 μL,上、下游引物各0.5 μL,ddH2O补至20.0 μL。扩增程序:95 ℃ 30 s;95 ℃ 5 s,55 ℃ 30 s,进行40个循环;从65 ℃到95 ℃每0.5 ℃依次读板,绘制溶解曲线。每个样品在在同一板中重复3次,作为技术重复。
1. 5 辣椒ASR基因家族生物信息学分析
利用ExPASy(https://www.expasy.org/protparam)在線分析工具ProtParam统计辣椒ASR家族蛋白的分子量、理论等电点(pI)、稳定性及亲/疏水性等理化性质。利用NCBI数据库CDD(Conserved domain database,https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白质保守结构域。利用GSDS网站(http://gsds.cbi.pku.edu.cn/)绘制基因结构图,在BUSCA(busca.biocomp.unibo.it)在线网站进行亚细胞定位预测。运用PRABI和SWISS-MODEL预测ASR蛋白的二、三级结构。提取辣椒ASR基因家族成员起始密码子上游2000 bp基因组序列,利用Plant CARE(http://bioinformatics.psb.ugent.be/web-tools/plantcare)网站在线分析启动子区域顺式作用元件,之后在GSDS网站进行启动子顺式作用元件可视化。
为分析辣椒ASR蛋白与不同物种间的亲缘关系及系统进化关系,从NCBI数据库中获取水稻、玉米、番茄和葡萄的ASR家族蛋白质序列。利用MEGA-X软件进行系统进化分析,采取邻接法(Neighbor joining,NJ)构建系统发育进化树,校验参数Bootstrap method设置为1000。应用在线网站MEME(http://meme-suite.org)预测分析所有蛋白序列的结构域,搜寻motif值为7,结构域宽度设定最小为10、最大为100,其他设定为默认参数。最后通过TBtools V1.09854(Chen et al.,2020)进行可视化拼接。
1. 6 统计分析
采集的数据采用2-ΔΔCt法计算基因的相对表达量(Livak and Schmittgen,2002)。使用SPSS 23.0对数据进行显著性分析,采用Origin 2019制图。
2 结果与分析
2. 1 辣椒ASR基因的克隆与测序
根据辣椒ASR基因的CDS序列和基因组序列,设计定量PCR特异引物。分别以cDNA和DNA为模板,对目标基因进行PCR扩增,获得包含辣椒ASR基因完整开放阅读框(ORF)的全长基因(图1)。将扩增的片段克隆后测序,将测序序列与辣椒数据库中ORF参考序列进行比对,结果表明,该基因的ORF序列和全长序列与数据库中的序列完全一致。将登录号为Capana04g001287的基因命名为CaASR2,Capana04g 001288命名为CaASR3。CaASR2基因全长为987 bp,最大ORF长333 bp,CaASR3全长938 bp,ORF长339 bp。
2. 2 ASR编码蛋白的序列特征
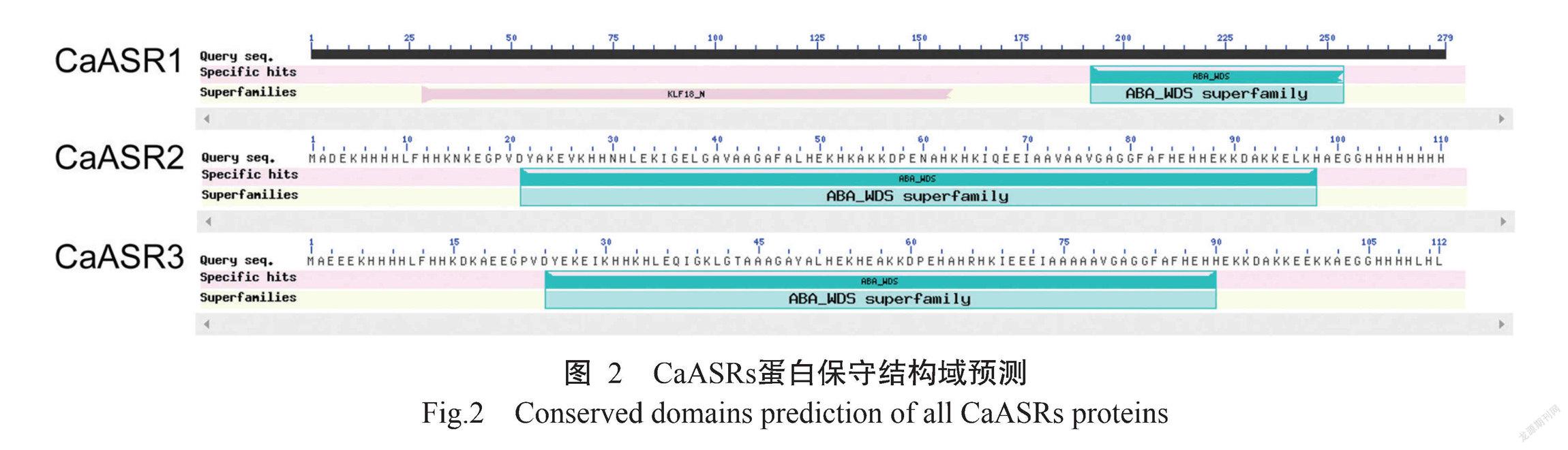
通过ExPASy工具进行理化性质分析,结果(表2)显示,CaASR1、CaASR2和CaASR3分别编码279、110和112个氨基酸,分子量分别为30.49、12.45和12.73 kD,pI分别为5.17、7.47和6.5,亲水性平均系数均为负值,均为亲水性蛋白。亚细胞定位预测结果显示辣椒3个ASR蛋白均位于细胞核内。利用NCBI数据库中的保守结构域预测工具CDD MbACO2蛋白保守结构域,结果(图2)发现其含保守结构域PLN02299,故推测MbA-CO2属于ACO家族成员。多重比对结果(图3)显示,辣椒ASR基因C端均含有保守ABA/WDS结构域。
蛋白质一级结构分析结果显示,CaASR1蛋白占比在前5位的氨基酸依次为Gly(G)、Glu(E)、Thr(T)、Lys(K)和Ala(A),分别占15.8%、14.3%、12.5%、11.1%和7.2%。CaASR2蛋白占比在前5位的氨基酸依次为His(H)、Lys(K)、Ala(A)、Glu(E)和Gly(G),分别占22.7%、15.5%、15.5%、12.7%和8.2%。CaASR3蛋白占比在前5位的氨基酸依次为His(H)、Glu(E)、Ala(A)、Lys(K)和Gly(G),分别占19.6%、17.0%、16.1%、15.2%和8.0%。二级结构预测分析结果(图4)表明,CaASR1蛋白包含:67个α-螺旋,占24.01%;20个延伸链,占7.17%;12个β-转角,占4.30%;180个无规则卷曲,占64.52%。CaASR2蛋白包含:64个α-螺旋,占58.18%;8个延伸链,占7.27%;10个β-转角,占9.09%;28个无规则卷曲,占25.45%。CaASR3蛋白包含:65个α-螺旋,占56.25%;10个延伸链,占8.93%;8个β-转角,占7.14%;31个无规则卷曲,占27.68%。利用SWISS-MODEL對ASR蛋白进行同源建模,获得其三级结构模型如图5。
2. 3 辣椒ASR基因结构与启动子顺式作用元件预测
利用GSDS网络对ASR基因成员的结构进行分析,发现辣椒中的3个ASR基因均含有2个外显子和1个内含子(图6-A)。对辣椒ASR基因家族启动子区域的顺式作用元件进行预测,结果发现,3个辣椒ASR基因除包含真核生物共有的顺式调控元件(TATA框和CAAT框)外,还包括一些与胁迫响应相关的顺式调控元件,即ABA响应元件ABRE及厌氧诱导(ARE)、低温(LTR)、干旱诱导相关MYB结合位点(MBS)等元件(图6-B),这些顺式作用元件决定了该基因对逆境胁迫的响应机制。
2. 4 辣椒ASR蛋白质进化和保守基序分析
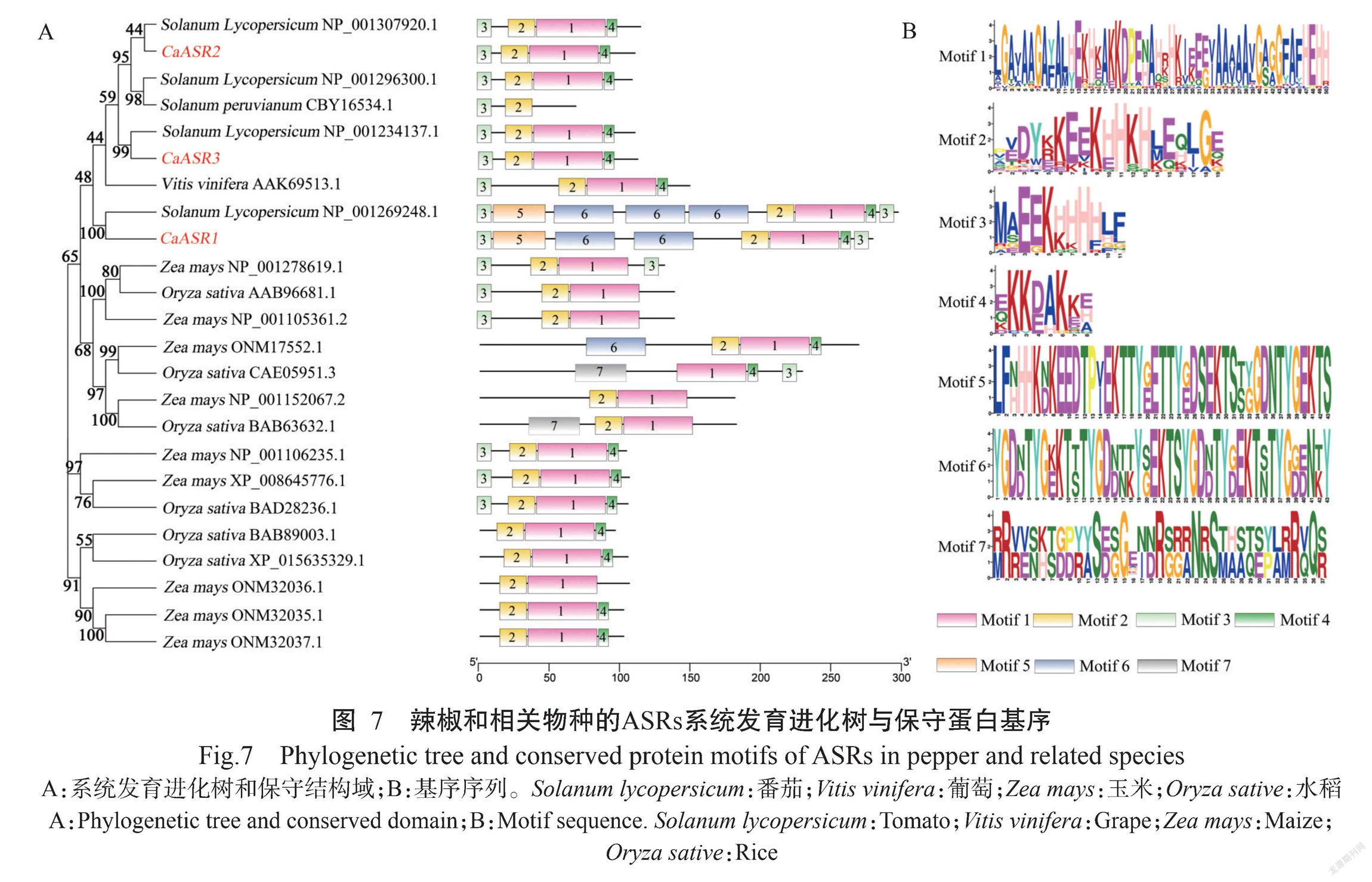
为了解辣椒ASR基因家族的进化关系,通过NCBI数据库下载玉米、水稻、番茄和葡萄ASR家族蛋白序列,通过MEGA-X软件构建辣椒与玉米、水稻、番茄和葡萄ASR家族蛋白的系统进化树(图7-A)。结果显示,24个ASR蛋白序列相似,与辣椒CaASRs基因遗传背景相近的是番茄和葡萄2个物种,亲缘关系较远的是水稻和玉米。同时CaASR2和CaASR3的亲缘关系较近。CaASR1、CaASR2和CaASR3氨基酸序列分别与番茄基因组中的ASR蛋白氨基酸序列NP_001269248.1(80.20%)、NP_001307920.1(91.3%)和NP_001234137.1(96.43%)有非常高的相似性。保守基序统计分析,共识别到7个motif(保守基序),并依次命名为motif1~motif7(图7-B)。其中motif1~ motif4最为保守,在所有辣椒ASR基因中均存在。CaASR2和CaASR3功能序列的数量和位点基本一致,具有高度保守性,推测其功能单位基本相似。进一步分析发现,3个基因均含有motif1~motif4,CaASR1还含有motif5和motif6。表明同一进化簇成员间具有相似的保守结构域组成,而不同簇具有各自特异的保守结构域,可能与其具体的生物学功能相关。
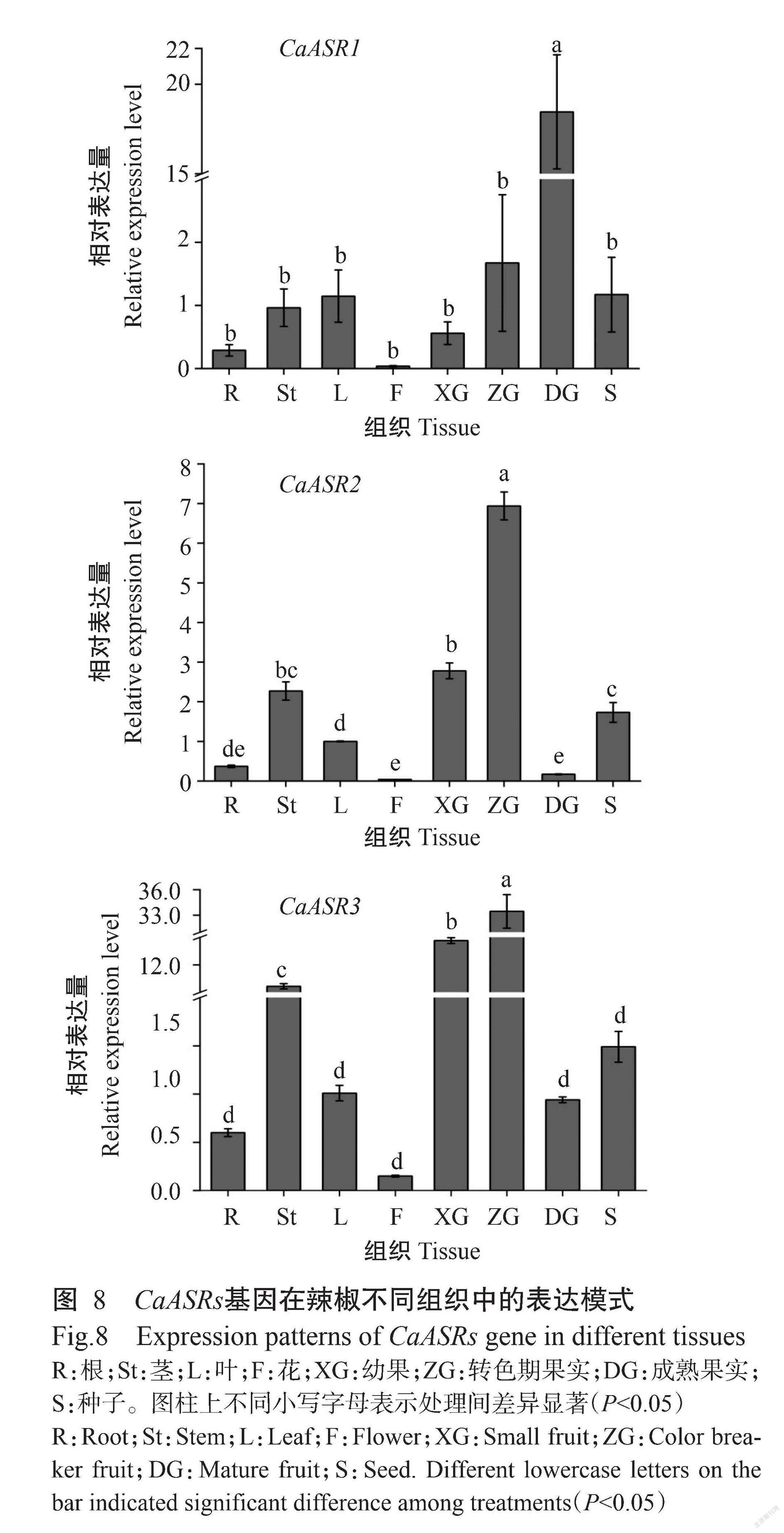
2. 5 CaASRs基因的组织特异性表达分析
为充分了解CaASR基因在辣椒不同组织中的表达模式,分别以自交系ZY35辣椒的根、茎、叶、花、幼果、转色期果实、成熟果实和种子的cDNA为模板,对CaASRs基因表达量进行实时荧光定量PCR分析,结果(图8)显示,3个ASR基因呈现相对一致的组织特异性表达,即在辣椒花中表达量最低,其次是在根中表达量相对较低,在茎、叶和种子中表达量中等,在果实中最高。CaASR1随果实发育表达量逐渐升高,在成熟果实中表达量比幼果增加30倍。CaASR2和CaASR3均在转色期果实中表达量最高,在成熟果实中的表达量反而显著降低(P<0.05,下同)。说明CaASR2和CaASR3在果实发育早期被诱导表达,CaASR1在果实成熟后期表现高表达量。综上所述,推测ASR基因可能参与辣椒的生长发育过程,特别是在辣椒果实发育和成熟过程中可能发挥重要作用。
2. 6 CaASRs基因在非生物胁迫下的表达分析
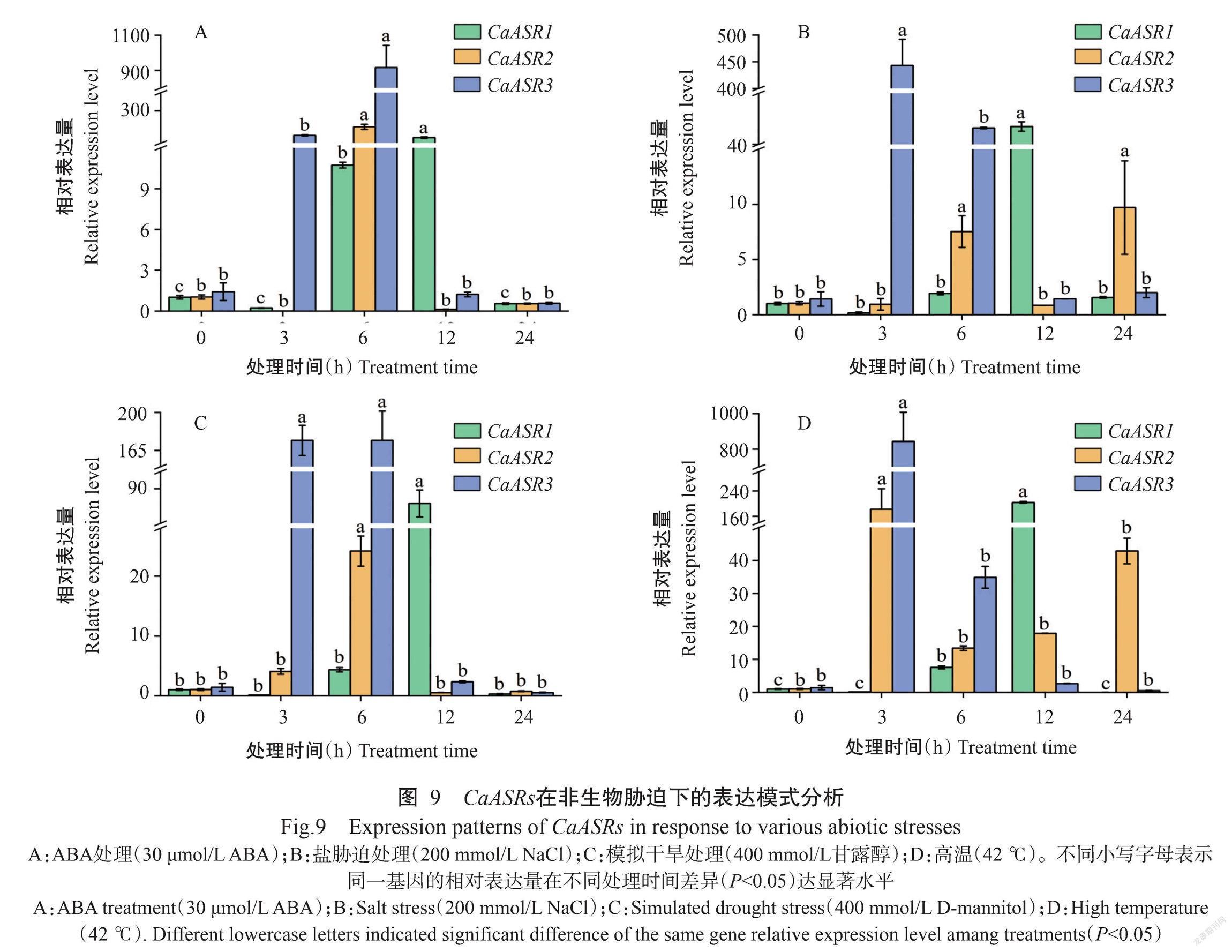
对辣椒ASR基因在42 ℃高温、甘露醇诱导的干旱胁迫、ABA喷施和NaCl胁迫处理下叶片中表达量进行分析,结果(图9)表明,辣椒在4组非生物胁迫下,3个ASR基因均表达量上调,表达模式存在差异,其中,CaASR3的表达量相对于其他2个基因上调更多。CaASR1在处理后表达水平先上调,随后恢复至对照水平,表达量均在12 h时显著高于其他时间段,在4组不同处理中呈现相对一致的表达模式;CaASR2在ABA和干旱处理下,表达量在6 h时显著高于其他时间段,在盐胁迫和高温处理下,24 h时仍具有相对较高的表达量。CaASR3基因在处理3 h后就开始表达量上调,响应快于其他同源基因;12 h后已经下降,恢复至对照水平,在4组处理中表达量趋势也呈现相对一致。推测CaASRs在辣椒抵御盐胁迫、干旱胁迫及氧化胁迫中可能发挥正向调控功能。
3 讨论
ASR基因作为一个小的基因家族,最早从成熟的番茄果实中分离,其在果实的发育与成熟、非生物胁迫和ABA应答中发挥了重要作用,在马铃薯(Dóczi et al.,2005)、草莓(Chen et al.,2011)、番茄(Ricardi et al.,2014)、玉米(Li et al.,2018)和水稻(Park et al.,2020)等多种作物中均有报道。辣椒基因组中包含3个ASR基因,均含1个内含子和2个外显子的典型结构和保守的ABA/WDS氨基酸结构域,基因结构简单且相似,并呈串联重复分布于辣椒第4号染色体上。进化分析结果表明,辣椒ASR基因与番茄基因组中的ASR蛋白氨基酸序列同源性最近。3个ASR蛋白预测均位于细胞核内,蛋白质理化性质相似,结构简单,该结果与Golan等(2014)研究所得的ASR序列特征相似,辣椒中该基因家族具有ASR蛋白的主要特征。
ASR基因在植物中存在组织特异性表达,不同成员可能在不同的器官、环境条件和表达模式中差异表达(Wang et al.,2016;Li et al.,2020)。组织特异性表达分析结果表明,CaASRs基因在茎、叶和种子中表达量高,在根中表达量相对较低,在花中表达量最低,该基因家族3个成员在正常生理条件下具有广泛的表达模式。ASR基因在不同组织中的表达呈现出不同的表达模式,暗示了ASR基因家族功能的复杂性。然而CaASR1随果实发育表达量逐渐升高,在成熟果实中表达量达最高值;CaASR2和CaASR3均在转色期果实中表达量最高,高于其他组织。Çakir等(2003)通过酵母单杂交试验表明,葡萄ASR蛋白与己糖转运基因的启动子结合,作为参与糖代谢的转录因子发挥作用。Chen等(2011)发现草莓果实中增加内源ABA含量,FaASR在转录和翻译水平的表达增加,可能对草莓果实成熟有一定的促进作用。辣椒是非呼吸跃变型果实,已有研究证明ABA含量随糖分积累和果实成熟逐渐积累,导致果实成熟过程中ASR基因大量表达。ASR基因在辣椒果实特异高表达,推测其在辣椒果实发育与成熟过程中可能发挥重要作用。
关于ASR基因在逆境胁迫中的研究较多。最早从番茄中分离的ASR基因显示,该基因的表达受脱水处理、ABA、茉莉酸甲酯和水杨酸的诱导,导致植物体对水和渗透胁迫有更高的耐受性。在烟草中过量表达番茄ASR1增强了烟草对高盐胁迫的耐受性(Fischer et al.,2011)。水稻ASR1(OsAsr1)基因受盐、甘露醇和ABA诱导,OsAsr1转入酵母中能增强酵母對NaCl、双氧水、硫酸、水杨酸和热等胁迫的耐受性(Kim et al.,2009)。香蕉MaASR1在拟南芥中表达后使植株变小、叶片变小且变厚、抗旱性增强,同时能增强拟南芥对ABA信号的敏感性(苗红霞等,2014)。在拟南芥中过表达玉米ZmASR3基因能显著提高植株抗渗透胁迫能力,增加ABA含量(Liang et al.,2019)。通过分析CaASRs在ABA、干旱、高盐和高温胁迫下的表达模式,发现多种处理时,ASR基因在辣椒叶片中的表达量整体呈升高趋势,表达受非生物胁迫的共同调控,与辣椒的逆境响应密切相关。已有研究证明ABA处理可在转录和翻译水平上诱导ASR的表达,上游顺式作用元件分析和RT-qPCR结果表明ABA参与非生物胁迫下辣椒ASR基因表达的信号转导。因此,推断CaASRs基因可提高辣椒对非生物胁迫的耐受性,但有待进一步通过转CaASRs验证其功能。
4 结论
辣椒基因组中含3个ASR基因,是一个结构简单的小基因家族,进化非常保守。辣椒ASR基因的表达具有组织特异性,在果实中表达量最高。在ABA、高盐、干旱和高温等非生物逆境胁迫下,CaASRs基因被诱导表达,推测ASR基因家族在辣椒果实成熟和抗逆过程起重要作用。
参考文献:
程维舜,孙玉宏,曾红霞,杜念华,施先锋,蔡新忠. 2013. ASR蛋白与植物的抗逆性研究进展[J]. 园艺学报,40(10):2049-2057. [Cheng W S,Sun Y H,Zeng H X,Du N H,Shi X F,Cai X Z. 2013. ASR protein and plant stress to-lerance[J]. Acta Horticulturae Sinica,40(10):2049-2057.] doi:10.16420/j.issn.0513-353x.2013.10.004.
苗红霞,王园,徐碧玉,刘菊华,贾彩红,张建斌,王卓,孙佩光,金志强. 2014. 香蕉MaASR1基因的抗干旱作用[J]. 植物学报,49(5):548-559. [Miao H X,Wang Y,Xu B Y,Liu J H,Jia C H,Zhang J B,Wang Z,Sun P G,Jin Z Q. 2014. The role of banana MaASR1 in drought stress tolerance[J]. Chinese Bulletin of Botany,49(5):548-559.] doi:10.3724/SP.J.1259.2014.00548.
王关林,方宏筠. 2014. 植物基因工程[M]. 第二版. 北京:科学出版社. [Wang G L,Fang H J. 2014. Plant genetic engineering[M]. The 2nd Edition. Beijing:Science Press.]
张圣旭. 2016. ABA信号在‘遵辣1号’果实发育及成熟过程中的作用研究[D]. 广州:仲恺农业工程学院. [Zhang S X. 2016. Study on the effect of ABA signal in the fruit development and maturation process in ‘Zunla-1’[D]. Guangzhou:Zhongkai University of Agriculture and Enginee-ring.]
鄒学校,马艳青,戴雄泽,李雪峰,杨莎. 2020. 辣椒在中国的传播与产业发展[J]. 园艺学报,47(9):1715-1726. [Zou X X,Ma Y Q,Dai X Z,Li X F,Yang S. 2020. Spread and industry development of pepper in China[J]. Acta Horticulturae Sinica,47(9):1715-1726.] doi:10.16420/j.issn.0513-353x.2020-0103.
Arenhart R A,Lima J,Pedron M,Carvalho F E L,Silveira J A G,Rosa S B,Caverzan A,Andrade C M B,Schune-mann M,Margis R,Margis-Pinheiro M. 2013. Involvement of ASR genes in aluminium tolerance mechanisms in rice[J]. Plant,Cell & Environment,36(1):52-67. doi:10.1111/j.1365-3040.2012.02553.x.
Çakir B,Agasse A,Gaillard C,Saumonneau A,Delrot S,Atanassova R. 2003. A grape ASR protein involved in sugar and abscisic acid signaling[J]. Plant Cell,15(9):2165-2180. doi:10.1105/tpc.013854.
Carrari F,Fernie A R,Iusem N D. 2004. Heard it through the grapevine?ABA and sugar crosstalk:The ASR story[J]. Trends in Plant Science,9(2):57-59. doi:10.1016/j.tplants.2003.12.004.
Chen J Y,Liu D J,Jiang Y M,Zhao M L,Shan W,Kuang J F,Lu W J. 2011. Molecular characterization of a strawberry FaASR gene in relation to fruit ripening[J]. PLoS ONE,6(9):e24649. doi:10.1371/journal.pone.0024649.
Chen C,Chen H,Zhang Y,Thomas H R,Frank M H,He Y H,Xia R. 2020. TBtools:An integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant,13(8):1194-1202. doi:10.1016/j.molp.2020.06. 009.
Dóczi R,Kondrák M,Kovács G,Beczner F,Bánfalvi Z. 2005. Conservation of the drought inducible DS2 genes and divergences from their ASR paralogues in solanaceous species[J]. Plant Physiology and Biochemistry,43(3):269-276. doi:10.1016/j.plaphy.2005.02.002.
Fischer I,Camus-Kulandaivelu L,Allal F,Stephan W. 2011. Adaptation to drought in two wild tomato species:The evolution of the Asr gene family[J]. New Phytologist,190(4):1032-1044. doi:10.1111/j.1469-8137.2011.03648.x.
Frankel N,Carrari F,Hasson E,Allal F,Iusem N D. 2006. Evolutionary history of the Asr gene family[J]. Gene,378:74-83. doi:10.1016/j.gene.2006.05.010.
Golan I,Dominguez P G,Konrad Z,Shkolnik-Inbar D,Carrari F,Bar-Zvi D. 2014. Tomato ABSCISIC ACID STRESS RIPENING(ASR) gene family revisited[J]. PLoS ONE,9(10):e107117. doi:10.1371/journal.pone.0107117.
González R M,Iusem N D. 2014. Twenty years of research on Asr(ABA-stress-ripening) genes and proteins[J]. Planta,239(5):941-949. doi:10.1007/s00425-014-2039-9.
González R M,Ricardi M M,Iusem N D. 2011. Atypical epigenetic mark in an atypical location:Cytosine methylation at asymmetric(CNN) sites within the body of a non-repetitive tomato gene[J]. BMC Plant Biology,11(1):94. doi:10.1186/1471-2229-11-94.
Huang J F,Shen L,Sheng Y,Guan D Y,He S L. 2020. CaASR1 promotes salicylic acid- but represses jasmonic acid-dependent signaling to enhance the resistance of Capsicum annuum to bacterial wilt by modulating CabZIP63[J]. Journal of Experimental Botany t,71(20):6538-6554. doi:10.1093/jxb/eraa350.
Iusem N D,Bartholomew D M,Hitz W D,Scolnik P A. 1993. Tomato(Lycopersicon esculentum) transcript Induced by water deficit and ripening[J]. Plant Physiology,102(4):1353-1354. doi:10.1104/pp.102.4.1353.
Jha B,Lal S,Tiwari V,Yadav S K,Agarwal P K. 2012. The SbASR-1 gene cloned from an extreme halophyte Salicornia brachiata enhances salt tolerance in transgenic tobacco[J]. Marine Biotechnology,14(6):782-792. doi:10.1007/ s10126-012-9442-7.
Kim S J,Lee S C,Hong S K,An K,An G,Kim S R. 2009. Ectopic expression of a cold-responsive OsAsr1 cDNA gives enhanced cold tolerance in transgenic rice plants[J]. Molecules and Cells,27(4):449-458. doi:10.1007/s10059-009-0055-6.
Livak K J,Schmittgen T D. 2002. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods,25(4):402-408. doi:10.1006/meth.2001.1262.
Li H W,Guan H Y,Zhuo Q C,Wang Z S,Li S D,Si J S,Zhang B,Feng B,Kong L A,Wang F H,Wang Z,Zhang L S. 2020. Genome-wide characterization of the abscisic acid-,stress- and ripening-induced(ASR) gene family in wheat(Triticum aestivum L.)[J]. Biological Research,53(1):23. doi:10.1186/s40659-020-00291-6.
Li X Y,Li L J,Zuo S Y,Li J,Wei S. 2018. Differentially expressed ZmASR genes associated with chilling tolerance in maize(Zea mays) varieties[J]. Functional Plant Biology,45(12):1173. doi:10.1071/FP17356.
Liang Y,Jiang Y L,Du M,Li B Y,Chen L,Chen M C,Jin D M,Wu J D. 2019. ZmASR3 from the maize ASR gene family positively regulates drought tolerance in transgenic Arabidopsis[J]. International Journal of Molecular Scien-ces,20(9):2278. doi:10.3390/ijms20092278.
Park S I,Kim J J,Shin S Y,Kim Y S,Yoon H S. 2020. ASR enhances environmental stress tolerance and improves grain yield by modulating stomatal slosure in rice[J]. Frontiers in Plant Science,10:1752. doi:10.3389/fpls.2019. 01752.
Philippe R,Courtois B,McNally K L,Mournet P,El-Malki R,Le Paslier M C,Fabre D,Billot C,Brunel D,Glaszmann J,This D. 2010. Structure,allelic diversity and selection of Asr genes,candidate for drought tolerance,in Oryza sativa L. and wild relatives[J]. Theoretical and Applied Genetics,121(4):769-787. doi:10.1007/s00122-010-1348-z.
Qin C,Yu C S,Shen Y U,Fang X D,Chen L,Min J M,Cheng J W,Zhao S C,Xu M,Luo Y,Yang Y L,Wu Z M,Mao L K,Wu H Y,Ling-Hu C Y,Zhou H K,Lin H J,Gonzalez-Morales S I,Trejo-Saavedra D L,Tian H,Tang X,Zhao M J,Huang Z Y,Zhou A W,Yao X M,Cui J J,Li W Q,Chen Z,Feng Y Q,Niu Y C,Bi S M,Yang X W,Li W P,Cai H M,Luo X R,Montes-Hernandez S,Leyva-Gonzalez M A,Xiong Z Q,He X J,Bai L J,Tan S,Tang X Q,Liu D,Liu J W,Zhang S X,Chen M S,Zhang L,Zhang L,Zhang Y H,Liao W Q,Zhang Y,Wang M,Lv X D,Wen B,Liu H J,Luan H M,Zhang Y G,Yang S,Wang X D,Batley J,Li X Q,Li S C,Wang J Y,Palloix A,Bosland P,Li Y R,Krogh A,Rivera-Bustamante R F,Herrera-Estrella L,Yin Y,Yu J P,Hu K L,Zhang Z M. 2014. Whole-genome sequencing of cultivated and wild peppers provides insights into Capsicum domestication and specialization[J]. Proceedings of the National Academy of Sciences,111(14):5135-5140. doi:10.1073/ pnas.1400975111.
Ricardi M M,Guaimas F F,González R M,Burrieza H P,López-Fernández M P,Jares-Erijman E A,Estévez J M,Iusem N D. 2012. Nuclear import and dimerization of tomato ASR1,a water stress-inducible protein exclusive to plants[J]. PLoS One,7(8):e41008. doi:10.1371/journal.pone.0041008.
Ricardi M M,González R M,Zhong S,Domínguez P G,Duffy T,Turjanski P G,Salgado Salter J D,Alleva K,Carrari F,Giovannoni J J,Estévez J M,Iusem N D. 2014. Genome-wide data(ChIP-seq) enabled identification of cell wall-related and aquaporin genes as targets of tomato ASR1,a drought stress-responsive transcription factor[J]. BMC Plant Biology,14(1):29. doi:10.1186/1471-2229-14-29.
Virlouvet L,Jacquemot M,Gerentes D,Corti H,Bouton S,Gilard F,Valot B,Trouverie J,Tcherkez G,Falque M,Damerval C,Rogowsky P,Perez P,Noctor G,Zivy M,Coursol S. 2011. The ZmASR1 protein influences bran-chedchain amino acid biosynthesis and maintains kernel yield in maize under water-limited conditions[J]. Plant Physiology,157(2):917-936. doi:10.1104/pp.111.176818.
Wang L,Hu W,Feng J,Yang X,Huang Q,Xiao J,Liu Y,Yang G,He G. 2016. Identification of the ASR gene family from Brachypodium distachyon and functional characterization of BdASR1 in response to drought stress[J]. Plant Cell Reports,35(6):1221-1234. doi:10.1007/s00299-016-1954-6.
收稿日期:2021-05-06
基金項目:国家自然科学基金项目(32072598);广东省普通高校特色创新项目(2018KTSCX099)
通讯作者:吴智明(1981-),https://orcid.org/0000-0001-8988-6060,博士,教授,主要从事蔬菜生物技术与遗传育种研究工作,E-mail:wuzm2012@zhku.edu.cn
第一作者:蔡小桃(1996-),https://orcid.org/0000-0001-7165-7075,研究方向为蔬菜生物技术,E-mail:2392023499@qq.com

