谷物膳食纤维对高胆固醇饮食小鼠脂质代谢及肠道菌群的影响
付南燕 吴正平 周林华 韩晓群 杨 婧 周智兴
(宜春学院医学院,宜春 336000)
肥胖是由能量摄入和能量消耗之间的不平衡引起的,并且是脂质代谢破坏的危险因素[1]。与脂质代谢紊乱有关的代谢综合征增加了患心血管疾病和2型糖尿病的风险[2-3]。脂质代谢紊乱包括胆固醇和甘油三酯(TG)含量异常,胆固醇代谢失常通常表现为总胆固醇(TC)含量增高和高密度脂蛋白胆固醇(HDL-C)含量降低等。此外,胆固醇调节元件结合蛋白-2(SREBP-2)、3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)、X受体α(LXRα)和胆固醇7α-羟化酶(Cyp7a1)等均为胆固醇蓄积中的关键酶。代谢综合征是一个日益严重的社会问题,尽管其病因学涉及遗传和环境因素之间的复杂相互作用,但饮食被认为是重要原因[4]。因此,开发对脂质代谢破坏具有预防作用的食品材料引起了广泛的关注。目前,谷物膳食纤维(DF)已被证实影响糖尿病、血脂异常、非酒精性脂肪肝疾病和心血管疾病等[5]。研究证实,每1 kg饲粮中添加5 g DF可以缓解肝脏脂质蓄积造成的脂质代谢紊乱[6]。已提出DF对肥胖的影响机制可能与其抑制肠道内摄取胆固醇和胆汁重吸收有关[5]。此外,DF可以增加粪便中胆汁酸的排泄,并增强胆固醇到胆汁酸的转化,可能会被结肠菌群发酵,产生短链脂肪酸(SCFA),提示SCFA可抑制肝胆固醇的合成[7]。大多数膳食纤维在小肠中不被消化,而是被大肠中的微生物群代谢[8]。目前尚未见DF对小鼠生长性能、血清和粪便生化指标、胆固醇蓄积相关蛋白表达以及肠道菌群影响的报道。因此,本研究旨在评估饮食中DF对小鼠脂质代谢指标和胆固醇蓄积的作用,从而为其在动物饲养中的应用提供参考。
1 材料与方法
1.1 主要试剂
啮齿动物标准配方饲粮(Research diets D10001);45%高脂饲粮(D12451,美国Researchdiets公司);小麦膳食纤维(山西奥特福食品科技有限公司);TC、TG、HDL-C含量及天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)活性测定试剂盒(南京建成生物工程研究所);总胆汁酸(TBA)含量测定试剂盒(厦门慧嘉生物科技有限公司)。
1.2 动物饲养与DF处理
6周龄的雄性SPF级C57BL/6J小鼠30只(体重18~20 g)购自上海斯莱克公司[许可证号:SCXK(沪)2012-002],小鼠单独饲养在相对湿度(55±5)%、温度22 ℃和12 h明暗循环的环境中。所有小鼠适应环境1周,并根据体重随机分为4组,分别饲喂实验室啮齿动物标准配方饲粮(基础饲粮,对照,CO组,n=8)、基础饲粮+5 g/kg DF(CO+DF组,n=8)、高脂高胆固醇饲粮(45%高脂饲粮+1%胆固醇)(HF组,n=7)及高质高胆固醇饲粮+5 g/kg DF(HF+DF组,n=7)。试验期8周。饲养8周后收集新鲜粪便,禁食不禁水12 h后,采用含有肝素钠的真空取血管,眼球取血,冰浴静止2 h后4 ℃、3 000 r/min离心15 min取上清液,于-80 ℃保存待用。取血完毕后,颈椎脱臼处死小鼠,摘取肝脏,萃取肝脏中的脂肪进行测定[9]。
1.3 血清和肝脏样品的生化分析
分别根据试剂盒制造商的说明,使用酶标仪M680型(美国Bio-Rad)测定血清TG、TG和TC含量以及AST和ALT活性。
1.4 粪便中TC含量的测定
取经冷冻干燥的粪便1.00 g,加入5倍的磷酸盐缓冲液(PBS)(pH=7.4),制成匀浆液,静止1 h,混匀后离心取上清液,按试剂盒要求测定粪便TC含量。
1.5 蛋白质印迹
将肝脏组织样品在蛋白酶抑制剂混合物中匀浆,使用BCA蛋白质测定试剂盒(Thermo Fisher Scientific)测定蛋白质浓度。将等量的蛋白质(20 μg)加载到4%~12%的钠十二烷基的硫酸盐(SDS)聚丙烯酰胺(PAGE)凝胶上,然后转移至聚偏二氟乙烯膜(PVDF)。用SREBP-2(ab30682,1∶1 000)、HMGR(ab174830,1∶1 000)、LXRα(ab176323,1∶2 000)、Cyp7a1(ab65596,1∶1 000)、β-肌动蛋白(β-actin)(ab8226,1∶5 000)(均购自Abcam)以及与微管相关的蛋白1轻链3-Ⅰ/-Ⅱ(LC3-Ⅰ/-Ⅱ,12741,1∶1 000)(购自Cell Signaling Technology公司)抗体在4 ℃下孵育过夜,在25 ℃下与抗兔免疫球蛋白G-辣根过氧化物酶标记(IgG-HRP)二抗(ab6721,1∶2 000)或抗小鼠IgG-HRP二抗(ab6789,1∶5 000)孵育1 h。使用Pierce ECL Western blotting底物(Thermo Fisher Scientific)观察信号,使用β-actin为内参化。
1.6 SCFA定量
根据先前的研究[10],使用气相色谱(GC)法分析了粪便中的SCFA含量。GC仪器由GC系统(7890B;安捷伦科技公司)、毛细管柱DB-WAXetr(内径:30 m×0.25 mm,厚度:0.25 μm,安捷伦技术公司)和保护柱DB-WAXetr(内径:5 m×0.25 mm,厚度:0.25 μm,安捷伦科技公司)组成。
1.7 肠道菌群分析
收集粪便样品并根据说明书使用FastPIN SPIN试剂盒(MP Biomedicals)从冷冻样品中提取粪便DNA[11]。采用细菌16S rDNA V3~V4区通用引物(341F:5′-CCTAYGGGRBGCASCAG-3′;806R:5′-GGACTACNNGGGTATCTAAT-3′)通过PCR扩增。根据制造商的说明,使用Illumina Miseq测序系统(Illumina)进行测序。使用Metagenome@KIN软件对确定的16S rDNA序列进行同源性搜索,用于鉴定在门和属水平的微生物[12]。此外,从分类和确定的数量中计算出门和属水平微生物的相对丰度。
1.8 统计分析
使用SPSS 24.0统计软件对DF与各自的对照组之间的数据进行独立t检验,使用单因素方差分析和Tukey HSD事后检验进行各试验组间的分析,数据均为平均值±标准差。P<0.05为差异显著。
2 结 果
2.1 DF对小鼠生长参数的影响
由图1可知,CO组和CO+DF组体重在0~4周无显著差异(P>0.05),而CO+DF组的最终体重显著低于CO组(P<0.05),HF+DF组的第4周和最终体重均显著低于HF组(P<0.05);与CO组相比,HF组第4周和最终体重均显著升高(P<0.05)。
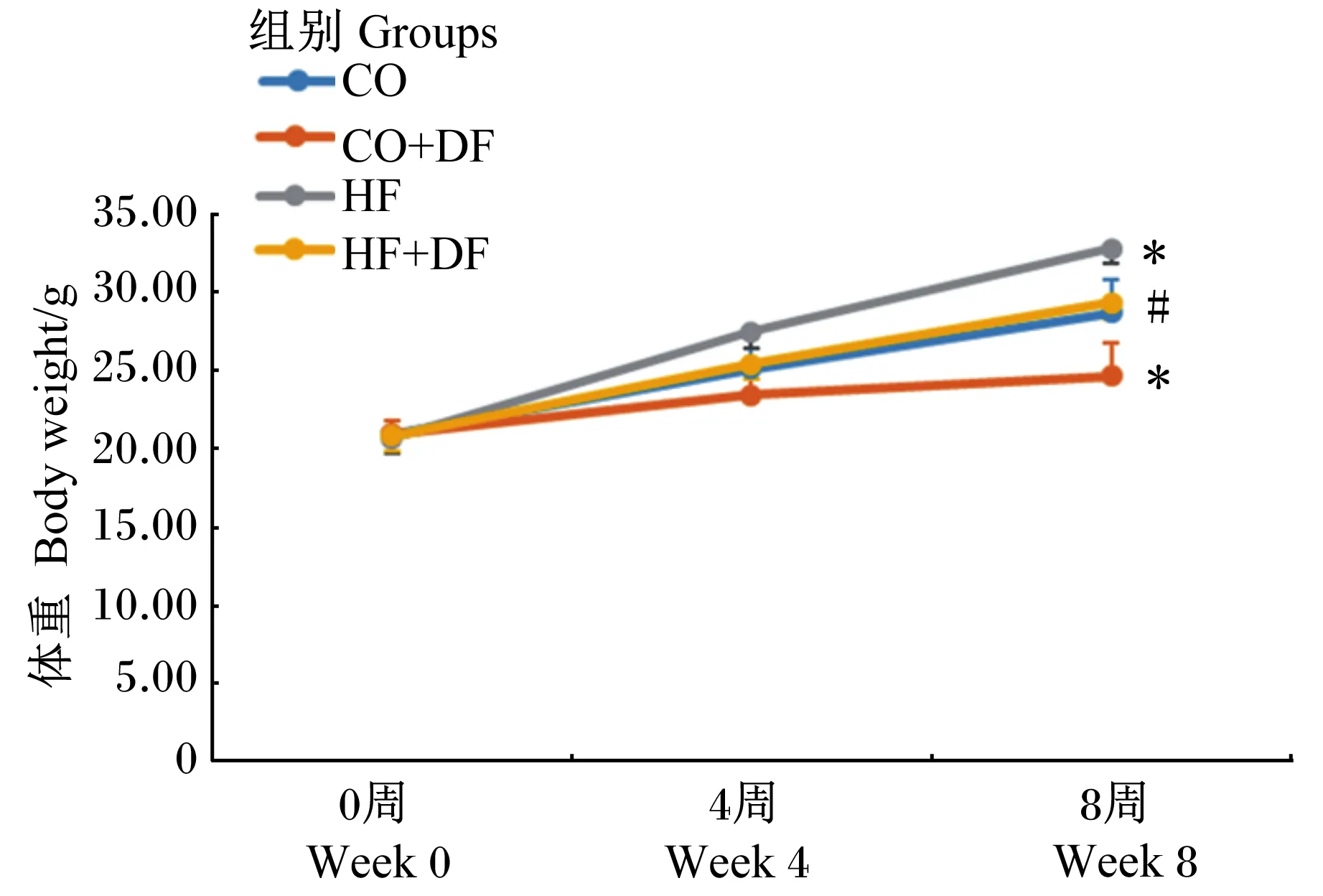
与CO组相比,*表示P<0.05,与HF组相比,#表示P<0.05。下同图。Compared with CO group, *mean P<0.05, and compared with HF group, # mean P<0.05。The same as below.
由表1可知,CO+DF组和HF+DF组摄食量与CO组和HF组相比没有显著差异(P>0.05)。与CO组相比,CO+DF组的摄食效率没有显著差异(P>0.05),但与HF组相比,HF+DF组显著降低(P<0.05)。CO组和CO+DF组之间的肝脏重量没有显著差异(P>0.05),与HF组相比,HF+DF组中的肝脏重量和脂肪重量显著减少(P<0.05),与CO组相比,HF组中的肝脏重量和脂肪重量显著增加(P<0.05)
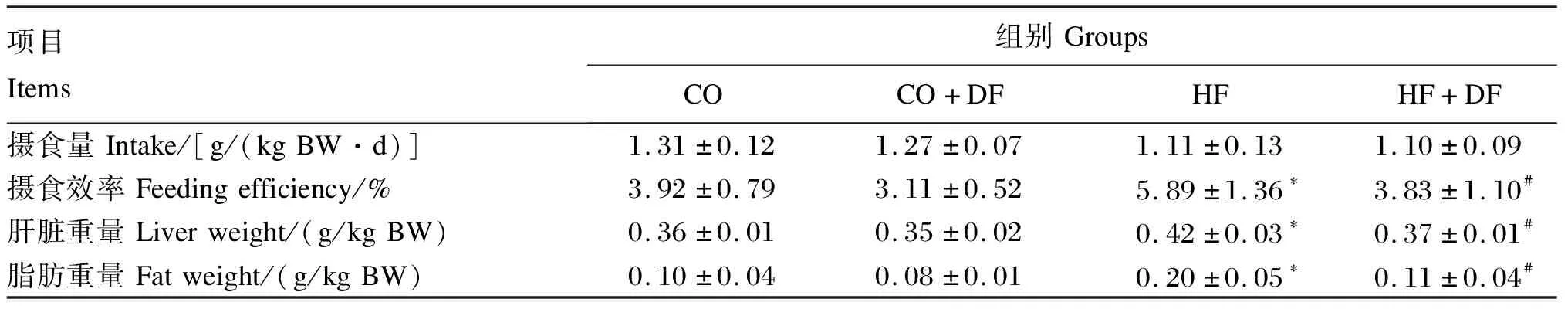
表1 DF对小鼠生长参数的影响
2.2 DF对小鼠血清、肝脏和粪便生化指标的影响
由表2可知,CO+DF组血清TC、TG含量及AST和ALT活性以及肝脏TC和TG含量显著低于CO组(P<0.05),HF+DF组显著低于HF组(P<0.05),与CO组相比,HF组显著升高(P<0.05)。HF组粪便TC含量显著高于CO组,HF+DF组显著低于HF组(P<0.05)。所有组之间的血清TBA和总蛋白含量无显著差异(P>0.05)。
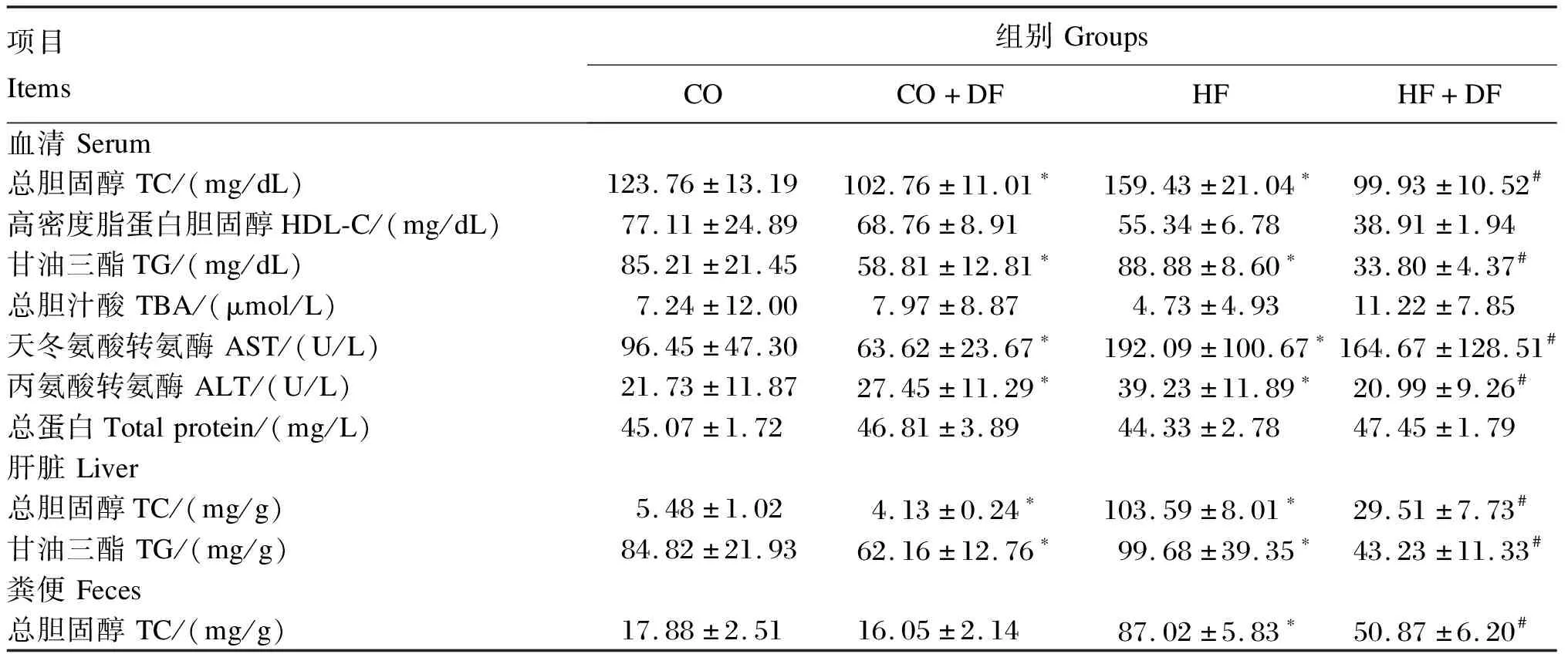
表2 DF对小鼠血清、肝脏和粪便生化指标的影响
2.3 DF对小鼠肝脏胆固醇和胆汁酸相关蛋白表达的影响
由图2可知,DF对肝脏SREBP-2、HMGR、LXRα、LC3-I和LC3-Ⅱ的蛋白表达没有显著影响(P>0.05)。CO+DF组肝脏Cyp7a1的蛋白表达水平显著低于CO组(P<0.05),但HF组和HF+DF组之间没有显著差异(P>0.05)。
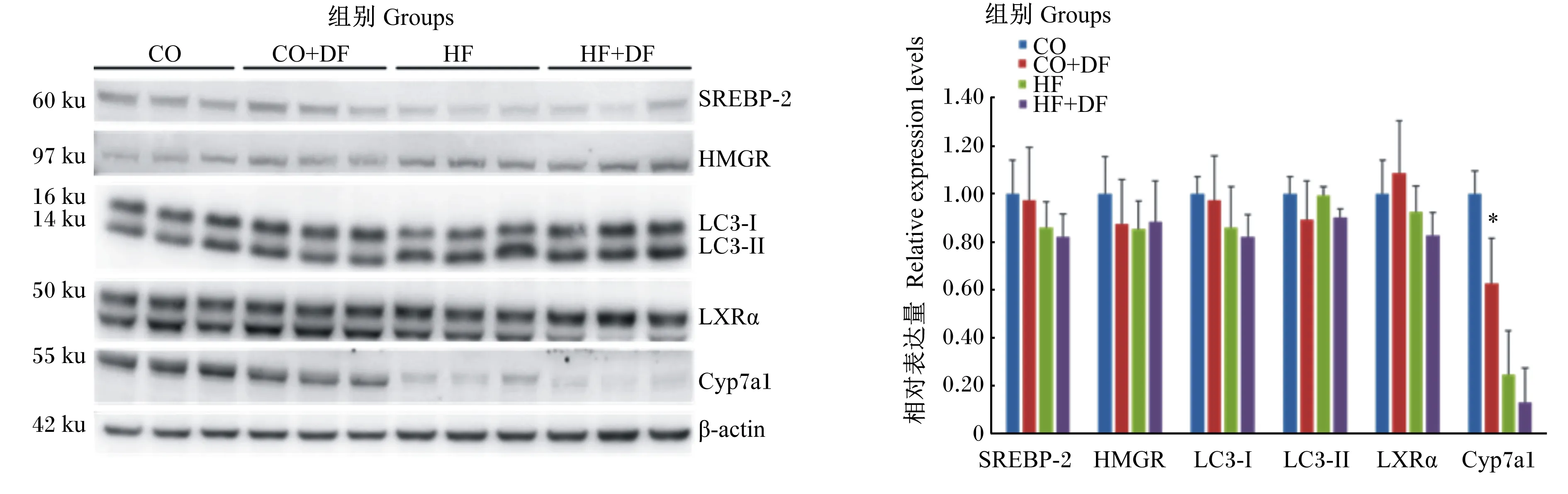
SREBP-2:胆固醇调节元件结合蛋白-2 sterol regulatory element binding protein-2;HMGR:3-羟基-3-甲基戊二酰辅酶A还原酶 3-hydroxy-3-methylglutaryl coenzyme A reductase;LXRα:肝脏X受体α liver X receptor α;LC3-Ⅰ:微管相关蛋白1轻链3-Ⅰ microtubule-associated protein 1 light chain 3-Ⅰ;LC3-Ⅱ:微管相关蛋白1轻链3-Ⅱ microtubule-associated protein 1 light chain 3-Ⅱ;Cyp7a1:胆固醇7α-羟化酶 cholesterol 7α-hydroxylase;β-actin:β-肌动蛋白。
2.4 DF对小鼠粪便中SCFA含量的影响
由表3可知,HF+DF组粪便SCFA和丙酸盐含量显著高于HF组(P<0.05)。粪便乙酸盐含量在各组之间未观察到显著差异(P>0.05)。与相应的对照组相比,CO+DF组和HF+DF组粪便丁酸盐含量显著增加(P<0.05)。

表3 DF对小鼠粪便中SCFA含量的影响
2.5 DF对小鼠肠道菌群的影响
由图3可知,在门水平上,DF减少了厚壁菌门(Firmicutes)相对丰度。CO组和CO+DF组拟杆菌门(Bacteroidetes)相对丰度没有变化,而与HF组相比,HF+DF组中Bacteroidetes相对丰度增加。与其他组相比,仅在CO+DF组中,疣微菌门(Verrucomicrobia)相对丰度有所增加。

Deferribacteres:脱铁杆菌门;Others:其他;Proteobacteria:变形菌门;Bacteroidetes:拟杆菌门;Actinobacteria:放线菌门;Verrucomicrobia:疣微菌门;Firmicutes:厚壁菌门;Anaerostipes:厌氧菌属;Roseburia:罗氏菌属;Bifidobacterium:双歧杆菌属;Coprococcus:粪球菌属;Ruminococcus:瘤胃球菌属;Anaerotruncus:厌氧棍状菌属;Desulfovibrio:脱硫弧菌属;Alloprevotella:拟普雷沃菌属;Clostridium:梭状芽孢杆菌属;Bacteroides:拟杆菌属;Eubacterium:真杆菌属;Akkermansia:阿克曼菌属;Lactococcus:乳球菌属;Lactobacillus:乳杆菌属。
在属水平上,梭状芽孢杆菌属Ⅳ(ClostridiumⅣ)相对丰度没有显著变化(P>0.05),而梭状芽孢杆菌属Ⅺ(ClostridiumⅪ)相对丰度在HF组显著升高(P<0.05)。梭状芽孢杆菌属ⅪⅤa(ClostridiumⅪⅤa)相对丰度在CO+DF组和HF+DF组中增加。此外,与其他组相比,仅HF+DF组中的阿克曼菌属(Akkermansia)相对丰度显著增加(P<0.05)。
3 讨 论
膳食纤维具有多种健康特性,包括减弱血糖反应并降低胆固醇含量,可能有助于体重控制[7]。Tucker等[13]进行了一项研究调查纤维摄入量的变化是否会影响体重,结果发现多吃膳食纤维含量高的食物可以降低体重增加的风险。同样,张薇等[6]在小鼠试验中提示DF显著降低脂代谢紊乱小鼠的体重、血脂、血糖及肝组织TG含量。本试验结果与张薇等[6]的结果相似,其还报道了小鼠在正常饮食条件下饲喂DF减少了体重增加,提示DF可能通过降低正常饮食和高胆固醇饮食喂养的小鼠脂肪组织重量来降低体重。饮食中膳食纤维防止胆固醇饲喂动物的血清TC含量升高[6],而血清ALT活性升高表明肝损伤的诱导。据报道,水溶性膳食纤维消除小鼠血清AST和ALT活性的升高[14],这些结果与本研究结果类似。在整个试验过程中监测了所有小鼠的健康状况,没有腹泻或行为异常的迹象。此外,本研究提示饮食中的DF可以降低肝脏和血清TG的含量。
已提出DF对肥胖的影响机制可能与其抑制肠道内摄取胆固醇和胆汁酸(BA)吸收有关[5]。通过调控转录因子SREBP-2的活性可能可以维持肝脏胆固醇含量,从而调节HMGR蛋白表达,SREBP-2和自噬相关蛋白LC3-Ⅱ的蛋白表达也呈负相关关系[15]。此外,LXRα是核受体,调节Cyp7a1的蛋白表达,而Cyp7a1是BA合成的限速酶。先前的研究表明,摄入燕麦膳食纤维会增加小鼠的小肠组织LXR-α的蛋白表达[16],但在本研究中DF对LXR-α的蛋白表达无显著影响,但Cyp7a1的蛋白表达显著降低,说明LXR-α还受其他因素的影响。
饮食对肠道菌群的组成、多样性和丰富度有重大影响,膳食纤维是盲肠和结肠菌群的重要能源,通过提供微生物生长的底物来改变肠道的生态环境[17]。一些肠道细菌控制宿主的能量代谢,在遗传性或饮食诱发性肥胖的动物中,Firmicutes/Bacteroides比例较高[18]。先前发现,各种膳食纤维材料在肥胖的试验动物模型中降低了这一比例[19]。与此一致,本研究中,DF减少Firmicutes相对丰度,增加Bacteroides相对丰度。此外,Bacteroides(ClostridiumⅪ和ⅪⅤa和Bacteroidetesfragilis)负责初级胆汁的脱氢,从而导致了次级BA的产生[20]。本研究中HF+DF组的ClostridiumⅪ和ⅪⅤa相对丰度是HF组的0.4倍,表明其存在可能有助于次级BA产生的肠道菌群。肠道菌群可产生SCFA并对宿主有益,SCFA在维持健康、能量代谢和预防某些疾病中起着重要的作用。由纤维产生的SCFA可能可以预防饮食引起的肥胖症并改善能量稳态,肠道中纤维的微生物发酵主要SCFA产物为乙酸盐、丙酸盐和丁酸盐,其中,丙酸盐对胆固醇的合成具有抑制作用[21]。膳食纤维摄入量低不仅会导致微生物多样性降低和SCFA产生,还不利于肠道微生物的新陈代谢。尽管DF促进了粪便中的丙酸盐的产生,但DF未能抑制胆固醇的积累和小鼠胆固醇合成中涉及的蛋白表达。因此,本研究提示丙酸盐含量的上调可能不足以降低胆固醇的合成。据报道,ClostridiumⅪ和ⅪⅤa属厚壁菌门,产生丁酸盐,并有助于维持肠道免疫稳态。在本研究中,饮食中的DF增加了ClostridiumⅪ和ⅪⅤa的相对丰度,提示它们部分促进了丁酸盐的增加。一项研究表明,摄入膳食纤维会增加动物盲肠和粪便中的丁酸盐含量。在Akkermansia中,Akkermansiamuciniphila是唯一存在的肠道细菌,它使用黏蛋白产生乙酸盐和丙酸盐[22]。有报道认为,将乙酸盐转化为丁酸盐的肠道细菌是粪便中SCFA含量升高的原因之一,由于丁酸盐可抑制炎症[23],DF可能是因SCFA含量上调而引起次级BA减少,进而改变肠道菌群组成的食品材料。
4 结 论
每千克饲粮添加5g DF,可降低饲喂含脂45%饲粮小鼠的体重和肝脏脂肪含量,降低血清TC、TG含量及AST和ALT活性以及肝脏TC和TG含量,降低胆固醇合成相关蛋白Cyp7a1的表达水平,提高总SCFA含量、肠道有益菌群和优势菌群相对丰度。

