复合益生菌固态发酵豆粕对断奶仔猪生长性能、肠道形态及肠道菌群的影响
熊云霞 张亚辉 李 平 吴绮雯 邱月琴 易宏波 肖 昊 蒋宗勇 王 丽
(广东省农业科学院动物科学研究所,农业农村部华南动物营养与饲料重点实验室,畜禽育种国家重点实验室,岭南现代农业科学与技术广东省实验室茂名分中心,广东省畜禽育种与营养研究重点实验室,广州 510640)
豆粕是仔猪饲粮中植物蛋白质的主要来源,但是豆粕中的蛋白质成分主要是大分子蛋白质,且含有许多抗营养因子,如大豆球蛋白、β-伴大豆球蛋白、胰蛋白酶抑制因子以及寡糖等[1]。断奶仔猪对豆粕中大分子蛋白质的消化能力差,且对其中的抗营养因子敏感,易造成仔猪腹泻,阻碍仔猪生长,因此需要对豆粕进行加工处理。研究发现,通过益生菌发酵处理,不仅可以降低豆粕中抗营养因子的水平,还能改善饲粮的适口性,提高其他营养成分的含量及饲粮养分的消化率[2-5]。且益生菌发酵饲料作为新型无抗饲料,具有绿色、安全、无残留等特性。但是单一菌种发酵饲料无法兼顾饲料的营养价值和适口性[6],因此,工业生产制备一般采用复合益生菌协同发酵,乳杆菌、芽孢杆菌和酵母菌为生产中的常用菌种。但菌种类别及比例、菌种添加量、发酵方法及设备、发酵饲粮的添加量、饲喂时间长短、饲喂阶段等方面在行业内还没有形成成熟一致的模式。因此,本研究选用课题组自制复合益生菌固态发酵豆粕等量替换无抗饲粮中的普通豆粕饲喂断奶仔猪,进一步探讨该发酵豆粕对断奶仔猪生长性能、肠道形态、吸收功能及肠道菌群的影响,为益生菌发酵饲粮在仔猪生产中的应用提供一定参考。
1 材料与方法
1.1 试验材料
猪源罗伊氏乳杆菌(Lactobacillusreuteri)为广东省农业科学院动物科学研究所猪营养与饲料研究室自行分离鉴定保存,植物乳杆菌CGMCC1258(LactobacillusplantarumCGMCC1258)为上海交通大学生命科学技术学院杭晓敏教授馈赠,酿酒酵母菌CNM I-1079(SaccharomycescerevisiaeCNM I-1079)购于安琪酵母有限公司,枯草芽孢杆菌(Bacillussubtilis)购于广州市微生物研究所,各菌种经过平板涂布培养目检及镜检正常后方可使用。罗伊氏乳杆菌、植物乳杆菌、酿酒酵母菌和枯草芽孢杆菌以1∶1∶1∶1的比例混合,总接种量为发酵体系质量的10%,各菌种在发酵体系的终浓度为6.05×108CFU/mL,蒸馏水添加量为40%,控制发酵温度在37~40 ℃,发酵时间为4 d,前48 h内每隔2 h向发酵桶内通入无菌空气10 s,后48 h将发酵桶密封进行厌氧发酵。发酵后,经检测发现豆粕中的三氯乙酸(TCA)可溶性蛋白含量变为原来的3.19倍,豆粕大分子蛋白质被降解了56.30%,蛋白质主要分布在26 ku以下。益生菌大量存活,平板涂布计数发现每克干物质发酵豆粕含芽孢杆菌6×105CFU、乳杆菌2×109CFU(包括植物乳杆菌和罗伊氏乳杆菌)、酵母菌5×106CFU。测定豆粕发酵后主要营养成分含量变化结果见表1。发酵及检测试验于2017年5月2日至2017年8月20日在广东省农业科学院动物科学研究所微生物中试车间进行。

表1 豆粕及发酵豆粕的营养成分含量(干物质基础)
1.2 试验设计及饲养管理
选取初始体重为(7.49±0.04)kg的21日龄“杜×长×大”三元杂交断奶仔猪72头,随机分为2组,每组6个重复,每个重复6头仔猪(公母各占1/2)。对照组(CON组)饲喂玉米-豆粕型无抗饲粮(含9%豆粕),发酵豆粕组(FSBM组)饲喂使用发酵豆粕等量替代对照组饲粮中豆粕的试验饲粮。试验期14 d。
仔猪运至试验基地后,立即进行称重分组,打耳标,饮水添加抗应激电解液,缓解断奶与运输应激,每栏配有2个乳头式饮水器和1个料槽,圈舍为高床漏缝地板,猪舍温度控制在25 ℃左右。试验饲粮为粉料,参照NRC(2012)营养需要配制,饲粮组成及营养水平见表2,饲粮中未添加任何抗生素。所有试验猪自由采食和饮水。按猪场要求进行常规的免疫与驱虫保健。饲养试验于2017年9月6日至2017年9月20日在广东省农业科学院动物科学研究所试验场进行。

表2 饲粮组成及营养水平(风干基础)
1.3 样品采集
试验结束时,每个重复选取1头最接近该组平均体重的仔猪进行屠宰,颈动脉放血处死后迅速打开腹腔,无菌结扎胃、十二指肠、空肠、回肠、盲肠,置于冰盒内备用。取近端十二指肠、中段空肠、远端回肠肠段约1.5 cm组织样品,直接置于4%多聚甲醛,室温固定过夜,用于制作肠道组织苏木精-伊红染色切片。取近端十二指肠、中段空肠、远端回肠肠段剪开,用磷酸盐缓冲液(PBS)冲洗内容物后,玻片轻轻刮取肠内壁黏膜样品分装于1.5 mL离心管中,液氮速冻,-80 ℃冷冻,用于基因表达荧光定量分析。取盲肠内容物于无菌冻存管,用于16S rRNA测序。
1.4 测定指标及方法
1.4.1 生长性能测定
在试验开始和结束时以个体为单位对所有试验猪进行空腹称重,试验过程中准确记录每个栏的采食量,记录猪只的腹泻情况,以计算平均日增重、平均日采食量、料重比和腹泻率。
平均日采食量=试验期采食量/(试验天数×仔猪头数);平均日增重=试验期增重/试验天数;料重比=平均日采食量/平均日增重;腹泻率(%)=[总腹泻头数/(仔猪头数×试验天数)]×100。
1.4.2 肠道组织形态观察
取近端十二指肠、中段空肠、远端回肠肠段约1.5 cm组织样品,直接置于4%多聚甲醛中室温固定过夜。从固定液中取出样品,经修块和组织脱水、石蜡包埋、切片、脱蜡、苏木精-伊红染色、脱水、中性树胶封片等步骤后成片,Nikon Eclipse E100-DS-U3显微镜成像系统(Nikon,日本)观察采集图像,使用Pannoramic Viewer软件(版本1.15.3.35149)进行肠道绒毛高度、隐窝深度的测量,每张片随机选取5个视野观察测量。
1.4.3 肠道黏膜组织中吸收相关基因表达测定
样品在液氮下充分研磨为粉末,用总RNA提取试剂盒(Invitrogen,Carlsbad,美国)提取组织样本总RNA,溶解于焦碳酸二乙酯(DEPC)水中,-80 ℃存储。用NanoDrop ND-1000分光光度计(Thermo Fisher Scientific,美国)评估RNA的浓度和纯度,所有样品A260/A280的值为1.8~2.0,并利用1%琼脂糖凝胶电泳检测RNA完整性。取等量(1 μg)总RNA,利用反转录试剂盒(TaKaRa,日本)反转录总RNA样品得第1链cDNA,反转录产物在-20 ℃保存备用。实时荧光定量PCR(qRT-PCR)反应(Bio-Rad CFX System)为10 μL体系:iTaq Universal SYBR Green Supermix(Bio-Rad美国)5.0 μL,上、下游引物(10 μmol/L)各0.5 μL,cDNA模板2.0 μL(10倍稀释),ddH2O 2.0 μL,每个样品3个重复孔。扩增程序设定:95.0 ℃预变性30 s,95.0 ℃变性15 s,退火30 s,72.0 ℃延伸30 s,40个循环;之后进行熔解曲线分析。使用的引物均根据GenBank中猪的基因序列,取保守区域设计引物,引物由上海生工生物工程股份有限公司合成,引物序列见表3。以β-肌动蛋白(β-actin)作为内参基因,用2-ΔΔCt法计算目的基因的mRNA相对表达量。

表3 qRT-PCR引物序列
1.4.4 盲肠菌群16S rRNA测序
本试验应用16S rRNA测序技术分析发酵豆粕对仔猪盲肠菌群结构的影响。采用溴化十六烷基三甲铵/十二烷基硫酸钠(CTAB/SDS)方法提取样本基因组DNA,Nanodrop ND-1000分光光度计(Thermo Fisher Scientific,美国)测定样品核酸浓度并用1%琼脂糖凝胶电泳检测DNA纯度,无菌水稀释样品至1 ng/μL。以稀释样品作为模板,使用带条形码(Barcode)的特异引物扩增细菌16S rRNA的V3+V4区。上游引物及其序列:341F(5′-CCTAYGGGRBGCASCAG-3′);下游引物及其序列:806R(5′-GGACTACHVGGGTWTCTAAT-3′)。PCR的反应体系(Bio-Rad T 100)为30 μL:Phusion Master Mix(2×)15 μL,引物(2 μmol/L)3 μL,模板10 μL,H2O 2 μL。反应程序:98 ℃预变性1 min;30个循环(98 ℃ 10 s;50 ℃ 30 s;72 ℃ 30 s);72 ℃ 5 min。PCR产物使用2%琼脂糖凝胶进行电泳检测。GeneJET胶回收试剂盒(Thermo Scientific)回收纯化扩增产物。Ion Plus Fragment Library Kit 48 rxns建库试剂盒(Thermo Scientific)进行文库的构建,构建好的文库经过Qubit定量和文库检测合格后,使用Thermofisher的IonS5TMXL平台进行上机测序。本试验测序由北京诺禾致源科技有限公司完成。
1.4.5 生物信息学分析
根据独特的Barcode对样品进行分配后,通过剪切Barcode和引物序列得到Raw reads。使用Cutadapt(Martin 2011)软件对Raw reads进行质量控制(V1.9.1,http://cutadapt.readthedocs.io/en/stable/)。利用基于Silva数据库(https://www.arb-silva.de/)的UCHIME算法(http://www.drive5.com/usearch/manual/uchime_algo.html)检测和删除嵌合体序列。使用Uparse软件(Uparse v7.0.1001,http://drive5.com/uparse/)将相似度≥97%的序列聚成相同的操作分类单元(OTUs)。基于Silva数据库,使用Mothur算法进行标注。利用序列最少的样本对应的序列号标准对OTUs丰度信息进行归一化处理。后续的α多样性和β多样性分析均基于此归一化数据。
使用QIIME(版本1.7.0)和R包(版本2.15.3)进行生物信息学和统计分析。α多样性指数评价物种多样性和均匀性,并采用t检验评估组间各指数差异。使用β多样性分析来评估各样品组内和组间的差异显著性。采用基于OTUs物理距离的主成分分析(PCA)、基于非加权Unifrac距离的主坐标分析(PCoA)显示样本的分布情况。线性判别分析效应(LEfSe)分析采用Mann-Whitney检验各组生物标志物物种(LDA score≥2)。
1.5 数据统计分析
数据使用SPSS 18.0统计分析软件进行处理,采用独立样本t检验,统计结果用平均值及均值标准误来表示,P<0.05为差异显著,0.05≤P≤0.10表示有显著趋势。
2 结 果
2.1 复合益生菌固态发酵豆粕对断奶仔猪生长性能的影响
如表4所示,与对照组相比,饲粮中添加复合益生菌固态发酵豆粕显著提高断奶仔猪终末体重和平均日增重(P<0.05),显著降低料重比(P<0.05)。

表4 复合益生菌固态发酵豆粕对断奶仔猪生长性能的影响
2.2 复合益生菌固态发酵豆粕对断奶仔猪肠道形态的影响
如图1所示,对照组肠道绒毛有断裂、倒伏,而发酵豆粕组肠道绒毛排列更整齐紧密。分析其绒毛高度和隐窝深度,与对照组相比,发现饲粮中添加复合益生菌固态发酵豆粕显著提高断奶仔猪空肠绒毛高度(P<0.05),且空肠绒隐比有升高趋势(P=0.07),显著升高十二指肠绒隐比(P<0.05)(表5)。
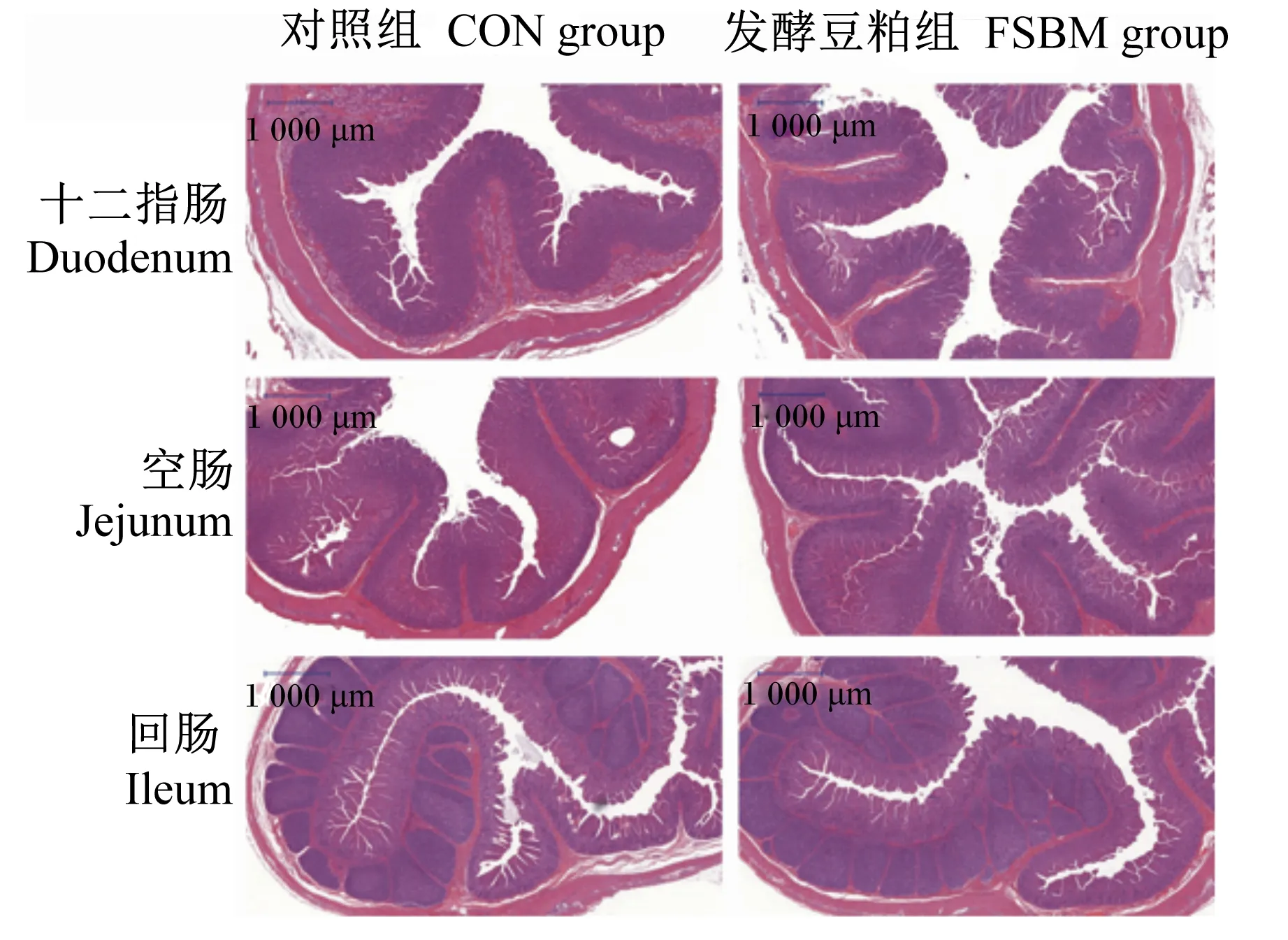
图1 断奶仔猪肠道形态
2.3 复合益生菌固态发酵豆粕对断奶仔猪肠道吸收相关基因mRNA相对表达量的影响
如图2所示,与对照组相比,饲粮中添加复合益生菌固态发酵豆粕显著提高断奶仔猪十二指肠SGLT1 mRNA相对表达量、空肠SGLT1和b0,+T以及回肠PepT1和AQP1 mRNA相对表达量(P<0.05)。

SGLT1:钠依赖性葡萄糖协同转运蛋白1 sodium-dependent glucose co-transporter 1;PepT1:小肽转运载体1 small peptide transporter 1;AQP1:水通道蛋白1 aquaporins 1; b0,+AT:碱性氨基酸转运载体 cationic amino acid transporter。
2.4 复合益生菌固态发酵豆粕对断奶仔猪盲肠菌群的影响
本试验共收集12个盲肠内容物样品,经16s rRNA测序得菌群平均有效序列数为56 320条,聚类生成1 165个OTUs。共检测到20个门、23个纲、35个目、56个科、114个属和100个种。结果表明,饲粮中添加复合益生菌固态发酵豆粕有提高断奶仔猪盲肠菌群α多样性的趋势(Shanon指数,P=0.10;Simpson指数,P=0.09;见表6)。基于OTUs物理距离的PCA分析和基于非加权unifrac距离的PCoA分析发现(图3),饲粮中添加复合益生菌固态发酵豆粕没有显著影响断奶仔猪盲肠菌群β多样性。分析菌群组成发现,在门水平上,菌群主要由拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)组成(图4-A),共占比80%以上,与对照组相比,添加复合益生菌固态发酵豆粕提高了Firmicutes的相对丰度(36.9% vs 44.2%)。在属水平上,对照组优势菌属均为未鉴定普雷沃氏菌科(unidentified_Prevotellaceae)、厌氧弧菌属(Anaerovibrio)和弯曲杆菌属(Campylobacter),占比分别为11.7%、10.0%、9.8%;复合益生菌固态发酵豆粕组优势菌属为unidentified_Prevotellaceae、拟普雷沃菌属(Alloprevotella)和Anaerovibrio,占比分别为8.0%、7.2%、6.2%。其中,Alloprevotella在对照组的占比为6.8%,而Campylobacter在发酵豆粕组中的占比为2.7%。LEfSe分析发现,饲粮中添加复合益生菌固态发酵豆粕导致梭菌目(Clostridiales)、梭菌纲(Clostridia)、毛螺旋菌科(Lachnospiraceae)、鼠杆菌科(Muribaculaceae)、翠杆菌属(Turicibacter)和黏膜乳杆菌(Lactobacillusmucosae)等的富集(图4-C)。
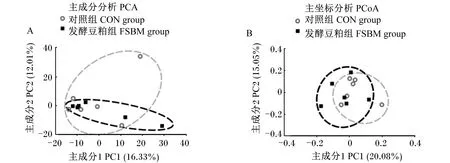
图3 复合益生菌固态发酵豆粕对断奶仔猪盲肠菌群β多样性的影响
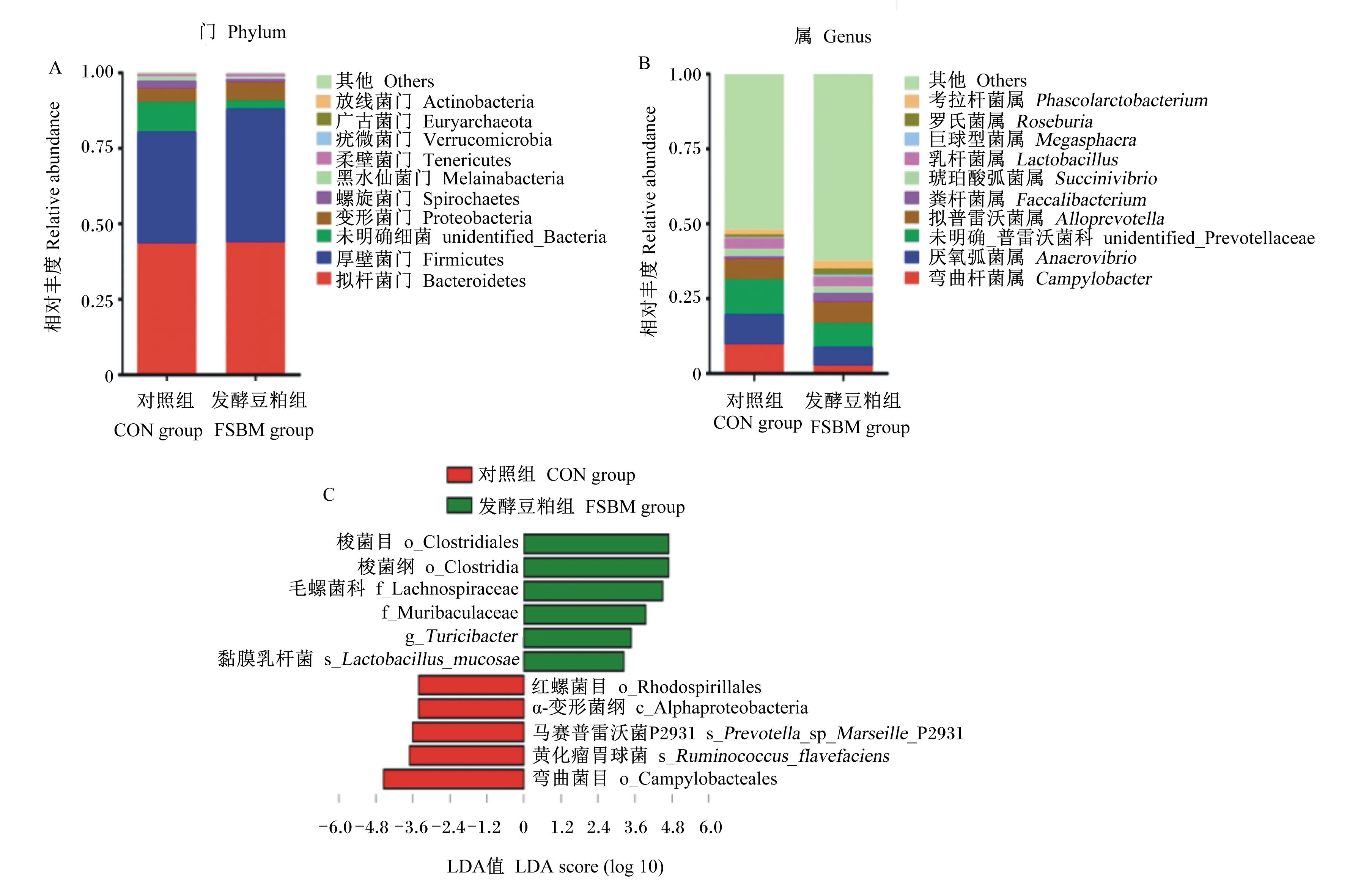
图4 复合益生菌固态发酵豆粕对断奶仔猪盲肠菌群物种的影响
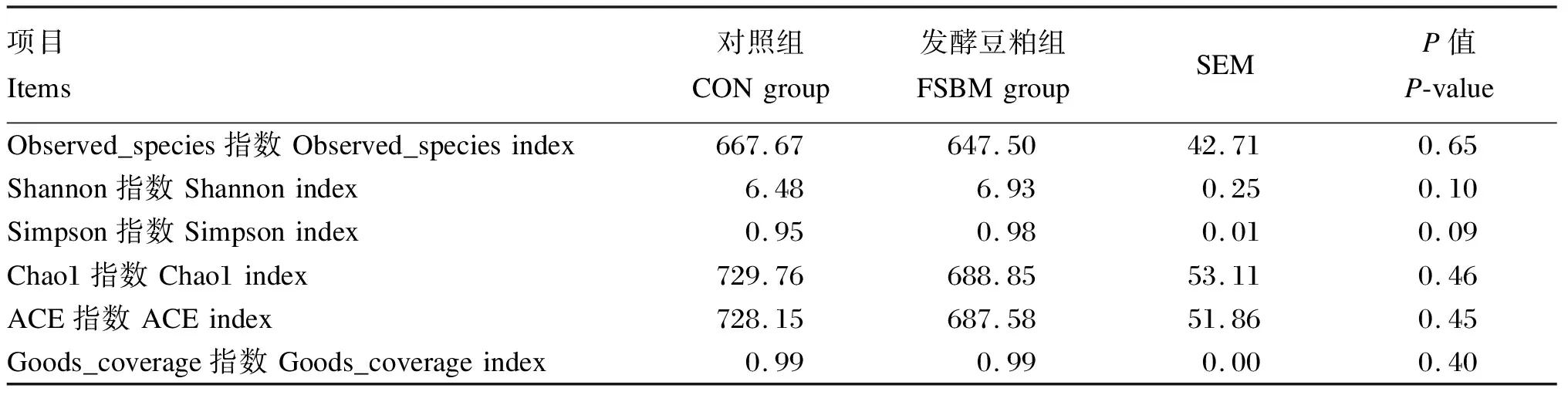
表6 复合益生菌固态发酵豆粕对断奶仔猪盲肠菌群α多样性指数的影响
3 讨 论
本课题组利用肠道益生菌做了大量的研究工作[7-8],发现饲粮直接添加植物乳杆菌、罗伊氏乳杆菌和酿酒酵母菌均能显著提高仔猪生长性能,改善肠道健康,提高动物免疫力,降低断奶仔猪腹泻[8-13]。且植物乳杆菌、罗伊氏乳杆菌、酿酒酵母菌和枯草芽孢杆菌发现具有较好的分泌蛋白酶和纤维酶活性,能够降解豆粕中的抗营养成分,提高饲粮的利用率[14-15]。因此本试验利用以上益生菌种,对豆粕进行改良两步法固态发酵,测定豆粕固态发酵前后主要营养成分含量变化,并进一步探究该发酵豆粕对断奶仔猪生长性能、肠道形态、吸收功能及肠道菌群的影响。
3.1 复合益生菌固态发酵豆粕对断奶仔猪生长性能的影响
已有大量研究报道发现,饲粮添加发酵豆粕可以提高断奶仔猪生长性能,降低料重比和腹泻率,降低病死率[3-4,16-18]。这是因为:1)在微生物发酵过程中产生的有机酸具有诱食作用,可提高动物采食量;2)微生物发酵可以降低豆粕中抗营养因子水平,并提高其他营养成分含量,提高动物对饲粮中营养物质的消化率[2]。在生产实践中,由于菌种组合比例、添加量及发酵方法的不同造成发酵豆粕营养成分差别很大[19],且在饲粮中发酵豆粕添加量、饲喂时间长短、饲喂猪生长阶段也不尽相同。因此,饲喂发酵豆粕对猪生长性能的影响研究结果也不完全一致。目前应用于发酵豆粕的菌种多为芽孢杆菌、酵母菌和乳杆菌,发酵豆粕在饲粮中添加量在4.0%~24.5%,有效剂量在10%左右,饲喂时间一般在21 d以上,可显著提高断奶仔猪平均日增重,降低料重比[20-23]。本试验添加9%复合益生菌固态发酵豆粕饲喂断奶仔猪,并未发现采食量的显著提高,但是终末体重和平均日增重显著提高,料重比显著降低。因此,我们推断本试验中,断奶仔猪平均日增重的提高与采食量无关,可能与添加发酵豆粕的营养成分组成及营养物质消化吸收率有关。而本试验中豆粕发酵后大豆蛋白大量降解,被降解后主要集中为26 ku左右的小肽,易于消化吸收。
3.2 复合益生菌固态发酵豆粕对断奶仔猪肠道形态的影响
豆粕中的抗营养物质会导致肠道绒毛萎缩及隐窝增生,如胰蛋白酶抑制剂会干扰胰蛋白酶和糜乳蛋白酶的正常功能,导致肠道形态异常,并影响动物的蛋白质消化。豆粕经过复合益生菌发酵处理后,抗营养因子大大减少,可以减轻抗原蛋白对肠道黏膜的刺激和损伤,改善肠道形态结构。Feng等[23]添加24.5%发酵豆粕发现,发酵豆粕可显著升高小肠各肠段绒毛高度,提高十二指肠隐窝深度。岳晓敬等[20]也发现,添加12%发酵豆粕可显著改善断奶仔猪肠道形态,改善断奶应激造成的绒毛断裂、粘连,提高肠道微绒毛密度和高度,且肠道绒毛整齐度好。与前人研究结果一致,本试验添加9%发酵豆粕饲喂断奶仔猪,发现肠道绒毛排列更整齐紧密。我们推断饲喂发酵豆粕对肠道形态的改善可能与其对自噬相关信号通路的抑制有关,在Zhu等[24]的研究中也发现,添加复合益生菌发酵豆粕可使仔猪肠道中自噬因子微管相关蛋白1轻链3B(LC3B)蛋白表达降低,发酵豆粕改善肠道形态的机制仍需进一步研究。豆粕发酵后,成分变化复杂,抑制自噬相关信号通路的有效成分尚待明确。
3.3 复合益生菌固态发酵豆粕对断奶仔猪肠道吸收相关基因表达的影响
本试验中豆粕发酵后,粗蛋白质含量由51.93%提高55.86%,蛋白质分子质量集中在26 ku以下。研究发现,豆粕发酵后必需和非必需氨基酸含量均显著提高[2],且添加益生菌发酵豆粕可提高仔猪肠道蛋白酶活性[23]。饲粮中的营养物质经胃肠道消化后通过转运载体进入肠道黏膜细胞参与机体代谢,而氨基酸、小肽、葡萄糖及水分的吸收都离不开转运载体的作用,目前关于发酵豆粕对断奶仔猪肠道黏膜消化吸收相关转运载体基因的表达少有人关注。本课题组前期研究发现,饲粮直接添加罗伊氏乳杆菌可显著改善断奶仔猪生长性能,这与肠道黏膜氨基酸转运载体PepT1、兴奋性氨基酸转运载体3(EAAT3)、中性和基础氨基酸转运载体(rBAT)、钠离子依赖中性氨基酸转运体(B0AT1)、b0,+AT等基因表达量的提高有关,分析其机制发现罗伊氏乳杆菌可通过提高核糖体S6蛋白(S6)及70ku核糖体S6激酶1(70S6K1)的磷酸化激活蛋白合成通路哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)[12-13,25]。本研究发现,饲粮中添加复合益生菌固态发酵豆粕可显著提高断奶仔猪空肠b0,+T和回肠PepT1 mRNA相对表达量,发酵豆粕有可能激活机体蛋白质合成通路,其潜在机制仍需进一步研究。饲喂发酵豆粕提高肠道黏膜组织中营养物质转运载体的表达是断奶仔猪生长性能提高的原因之一。
3.4 复合益生菌固态发酵豆粕对断奶仔猪肠道菌群的影响
有报道发现,饲粮添加发酵豆粕可降低断奶仔猪肠道有害菌(大肠杆菌和沙门氏菌)的数量[21,26-27],并增加肠道菌群的多样性,改善菌群结构,增加肠道中厚壁菌门、乳酸菌科和乳酸菌属等有益菌的相对丰度[28-29]。本研究也发现,饲喂复合益生菌固态发酵豆粕有提高肠道菌群物种多样性和丰富度的趋势,且益生菌Lactobacillusmucosae得到富集。这可能和发酵豆粕中存活的大量发酵菌种有关。有意思的是,本试验中添加的发酵豆粕中含有大量的存活益生菌,但是只有乳杆菌在仔猪肠道中得到了富集,这可能与发酵豆粕中乳杆菌的相对丰度有关。Zhu等[24]采用16S rRNA测序技术研究饲喂发酵豆粕的断奶仔猪的粪便和结肠内容物菌群结构,并与平均日采食量和免疫因子水平做相关分析,发现严格厌氧芽孢杆菌(Clostridiumsensustricto)、毛螺菌属(Lachnospira)和拟杆菌属(Bacteroides)相对丰度与仔猪腹泻率呈正相关,乳杆菌属(Lactobacillus)、布劳特氏菌属(Blautia)和Clostridiumsensustricto相对丰度与平均日采食量呈正相关,Lactobacillus及Lachnospira相对丰度则与血清免疫球蛋白M(IgM)含量呈正相关。因此,我们推断发酵豆粕提高断奶仔猪生长性能和免疫力可能和肠道菌群的改善有关。Jin等[30]利用唾液乳杆菌(Lactobacillussalivarius)、枯草芽孢杆菌(Bacillussubtilis)和酿酒酵母菌(Saccharomycescerevisiae)复合发酵豆粕后,应用16S rRNA测序技术结合液质联用技术分析发酵饲粮中的菌群结构和代谢产物分布,发现发酵后,饲粮中的优势菌种为肠球菌,而并非添加的益生菌种。且发酵后饲粮中的乳酸含量升高,总挥发性脂肪酸含量降低。进一步代谢组学分析发现,发酵使得马来酸、苯乙酸、亚油酸乙酯、二同-亚麻酸和L-茶氨酸等得到富集,而这些代谢产物具有较好的抗菌活性。综上所述,饲粮添加发酵豆粕影响断奶仔猪肠道菌群的可能原因有:1)豆粕发酵后本身含有大量活的益生菌,可产生占位效应,抑制有害菌生长;2)豆粕发酵过程中产生大量生物活性物质(寡糖、多肽及促生长因子等),促进有益菌生长,改善肠道微生物区系;3)豆粕发酵后的代谢产物具有较好的抑菌活性,阻碍有害菌的生长。发酵豆粕如何通过菌群影响机体生长代谢的机制仍有待进一步研究。
4 结 论
综合以上研究结果,利用自制复合益生菌固态发酵豆粕等量(9%)替换无抗饲粮中普通豆粕,可提高断奶仔猪的生长性能,改善肠道形态和吸收功能,并有提高肠道菌群多样性的趋势。

