鱼类胆固醇营养需求研究进展
孟晓雪 卫育良 梁萌青 徐后国*
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院黄海水产研究所,青岛 266071;3.青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室,青岛 266071)
脂类是鱼类的重要营养要素之一,胆固醇作为类脂的一种,是鱼体内最为丰富的固醇类化合物。胆固醇不仅是动物细胞膜的重要组成成分,还是类固醇激素、维生素D3及胆汁酸的重要前体物。在体内,胆固醇主要以游离胆固醇和胆固醇酯的形式存在,二者合称为总胆固醇。水生动物中,甲壳动物由于不能自身合成胆固醇,需要在其饲料中进行添加,而鱼类等脊椎动物能够合成胆固醇,通常认为胆固醇是鱼类的非必需营养物质,因此鱼类营养学家较少关注鱼类饲料胆固醇的营养生理作用[1-2]。然而,近几年的报道表明,鱼类饲料中胆固醇的营养需求受饲料配方及鱼的种类等因素影响较显著。目前国内外对饲料胆固醇影响鱼类生长及代谢机理的研究还处于初步探讨阶段,本文主要对鱼类胆固醇的营养需求、鱼体内胆固醇代谢及其代谢的调控机制进行综述。
1 鱼类饲料胆固醇的来源
在当今的水产养殖中,出于环境和经济成本的考虑,鱼粉和鱼油越来越多地被植物性原料所代替。不同饲料原料中,胆固醇含量的差别较大,部分饲料原料中胆固醇含量见表1。胆固醇是动物体内主要的甾醇类物质,因此动物原料中的胆固醇含量较高,而植物原料中胆固醇含量较低[3]。植物原料中的甾醇类主要包括β-谷甾醇、菜油甾醇及少量的豆甾醇和菜籽甾醇。这些植物固醇在动物体内会与肠道胆固醇进行竞争,抑制胆固醇的吸收并降低血液胆固醇的含量[4]。研究表明,摄食大豆蛋白的虹鳟(Oncorhynchusmykis)[5]和大西洋鳕鱼(Gadusmorhua)[6]均存在低胆固醇效应,这种现象可能主要与植物原料中胆固醇的缺乏及植物甾醇的竞争有关[7-8]。

表1 常用饲料原料中胆固醇含量
2 动物体内胆固醇的代谢
2.1 胆固醇的内源合成
肝脏是机体胆固醇合成的主要场所,也是维持胆固醇需求和血液胆固醇含量稳定的重要器官。胆固醇的稳态是维持正常生命活动的保障,不同动物合成胆固醇的能力存在显著差异。虾蟹类等甲壳动物不能自身合成胆固醇,所需要的胆固醇依靠外源性摄入[2]。而对于鱼类等脊椎动物而言,机体自身能够利用乙酸合成胆固醇[9]。胆固醇的生物合成可以分为4个阶段:甲羟戊酸合成、异戊二酸合成、鲨烯合成、胆固醇生成。羟甲基戊二酸辅酶A还原酶(HMGR)是胆固醇合成的主要限速酶[10]。
2.2 胆固醇的分解与转化
胆固醇在体内不能被彻底氧化分解为二氧化碳和水,但其侧链可以被氧化、还原和降解,转化为固醇类物质。皮肤组织中的胆固醇可转化为维生素D3。胆固醇还可以与脂肪酸在胆固醇脂酰转移酶的催化作用下结合形成胆固醇酯,并通过脂蛋白运至其他组织中进行储存[11]。
此外,由胆固醇转化为孕烯醇酮是所有类固醇激素(性类固醇激素和皮质类固醇)合成的第1步[12-13]。所利用的胆固醇主要来源于贮存在脂滴中的胆固醇酯,以及通过选择性摄取获得的血浆脂蛋白[14]。类固醇激素生物合成的限速步骤是胆固醇从肾上腺或性腺的线粒体外膜转移至线粒体内膜,由类固醇合成急性调节蛋白介导。随后在细胞色素P450胆固醇侧链裂解酶的催化作用下生成孕烯醇酮,从而转化为有活性的性激素(睾酮、雌二醇和孕酮)。类固醇激素会激活性腺发育,并在鱼类的整个生殖期发挥重要的调节作用。
胆固醇降解最重要的机制是转化为胆汁酸,主要包括经典途径和替代途径[15-16]。胆固醇在肝脏中转化为胆汁酸后贮存于胆囊,在肠道中被重新吸收由门静脉进入肝脏,从而实现胆汁酸的肝肠循环。以胆汁酸盐的形式进入肠道未被吸收的胆固醇,一般是在细菌作用下转化为粪固醇或以残量胆固醇的形式排出体外。
2.3 胆固醇的转运
胆固醇在动物机体内主要以胆固醇酯的形式借助具有亲水性结构的脂蛋白通过血液进行运输[11]。饲料中的脂类与载脂蛋白结合形成乳糜微粒,将外源胆固醇和甘油三酯从肠道运输到其他组织进行利用。在肝细胞中合成的极低密度脂蛋白(VLDL),主要将外源摄入和内源合成的胆固醇以及甘油三酯由肝脏运输到其他组织进行利用、贮存或代谢转化。在血液循环的过程中,VLDL在脂蛋白脂肪酶的作用下通过脱脂得到低密度脂蛋白(LDL),然后肝外组织在LDL受体的帮助下通过内吞作用对其进行摄取和胆固醇的利用。过多的胆固醇则被高密度脂蛋白(HDL)逆转运回肝脏进行降解清除,以维持体内胆固醇的稳态。
低密度脂蛋白胆固醇(LDL-C)/高密度脂蛋白胆固醇(HDL-C)比值作为胆固醇转运的标志,同时也是反映外周血管中胆固醇蓄积的指标[17]。在以鱼粉为基础的饲料中添加胆固醇显著增加了LDL-C/HDL-C比值[9,18],即增加了胆固醇在外周组织中的蓄积,而在以植物性蛋白质源为基础的饲料中添加胆固醇则该比值显著降低[9,17,19-20]。
3 鱼类胆固醇营养需求
水产养殖对鱼粉鱼油具有很强的依赖性。为缓解鱼粉鱼油短缺对水产养殖可持续发展的影响,鱼粉鱼油替代逐渐成为目前鱼类营养研究的一大热点,也是产业应用的一大趋势。植物性原料由于可获得性高且相对廉价,正越来越多地被用在水产饲料中。以植物性原料部分或全部替代鱼粉鱼油后,一些必需氨基酸、脂肪酸和矿物质通常需要额外补充,但胆固醇等因子则容易被忽略,导致水产动物的生长以及机体成分可能受到胆固醇缺乏的影响。
由于鱼类等脊椎动物能够在体内合成胆固醇,目前很少有研究关注胆固醇在鱼类营养代谢中的作用及机理。然而,胆固醇的生物合成是一个高耗能的过程,合成1个胆固醇需要18个乙酰辅酶A、36个ATP和16个还原型辅酶Ⅱ(NADPH)。若饲料中胆固醇含量较低,则会迫使养殖鱼类不断进行内源性胆固醇合成,产生大量能量消耗。因此,外源胆固醇对于鱼类营养生理的重要性和必要性需要重新进行评估。
3.1 饲料胆固醇对鱼类摄食和生长的影响


3.2 饲料胆固醇对鱼体营养组成的影响
肝脏中胆固醇的沉积量随饲料胆固醇含量的增多而上升[1,17]。饲料中胆固醇的过度添加可能会造成肝脏中胆固醇的过度累积,引发肝脏损伤或组织病变[27]。使用豆粕替代饲料中45%的鱼粉后,牙鲆鱼体的粗脂肪和血清胆固醇含量显著降低[24];而饲料中添加1%左右的胆固醇显著提高了大菱鲆[17]、牙鲆[24]、虹鳟[26]鱼体粗脂肪和血清胆固醇含量。与之类似的,当以脱脂鱼粉为主要蛋白质源时,在饲料中梯度添加(<2%)胆固醇显著升高了大菱鲆鱼体粗脂肪和血清胆固醇含量[29]。与对鱼体粗脂肪含量的影响相对应,饲料中添加1%的胆固醇后,大西洋鲑的肝体指数(HSI)显著升高[18]。脂蛋白脂肪酶(LPL)与肝脂酶(HL)是血液中参与脂肪分解代谢的2种关键酶,而激素敏感脂酶(HSL)是负责脂肪组织细胞中脂肪水解的限速酶之一。研究发现,饲料胆固醇对血液中HL活性的影响不显著,但显著提高了LPL和HSL的活性[27]。这些研究出现饲料胆固醇影响鱼体粗脂肪含量的结果,可能是因为所添加的胆固醇能够在体内转化为胆汁酸,促进脂类物质的消化和吸收,从而促进了脂肪的累积[21],但过多添加胆固醇又会造成脂质代谢紊乱,使得机体粗脂肪含量降低[27]。与脂类沉积规律不同,在鲆鲽鱼类中,鱼体的粗蛋白质、水分和粗灰分含量均未受到饲料胆固醇添加量的显著影响[24,29];在军曹鱼中,饲料胆固醇含量在一定范围内增加(0~0.8%)对鱼体粗蛋白质含量无显著影响,但当胆固醇含量继续增加(1.2%~2.0%)时,鱼体粗蛋白质含量显著增加[27]。
此外,在大西洋鲑上的研究表明,饲料中添加1%的胆固醇使得肝脏中棕榈酸(C16∶0)、花生四烯酸(C20∶4n-6,ARA)和二十二碳六烯酸(C22∶6n-3,DHA)的相对含量显著降低,油酸(C18∶1n-9)和二十碳烯酸(C20∶1n-9)的相对含量显著升高,而粪便中饱和脂肪酸的相对含量显著降低,不饱和脂肪酸的相对含量显著升高[18]。这说明胆固醇的添加不但会导致肝脏胆固醇的累积,还会对粪便和肝脏的脂肪酸组成产生一定的影响。
3.3 饲料胆固醇对鱼体健康的影响
胆固醇添加量过低或过高都会降低鱼体的免疫功能并加重其炎症反应。饲料中胆固醇含量的异常会降低草鱼(Ctenopharyngodonidella)抗皮肤出血和损伤能力及相关免疫酶的活性[32]。在以豆粕为基础的饲料中添加适量(0.9%~1.2%)的胆固醇可以提高虹鳟的免疫应答能力和抗嗜水气单胞菌能力[33]。
本文就目前针对鱼类胆固醇营养需求的相关研究进行了总结,详见表2。
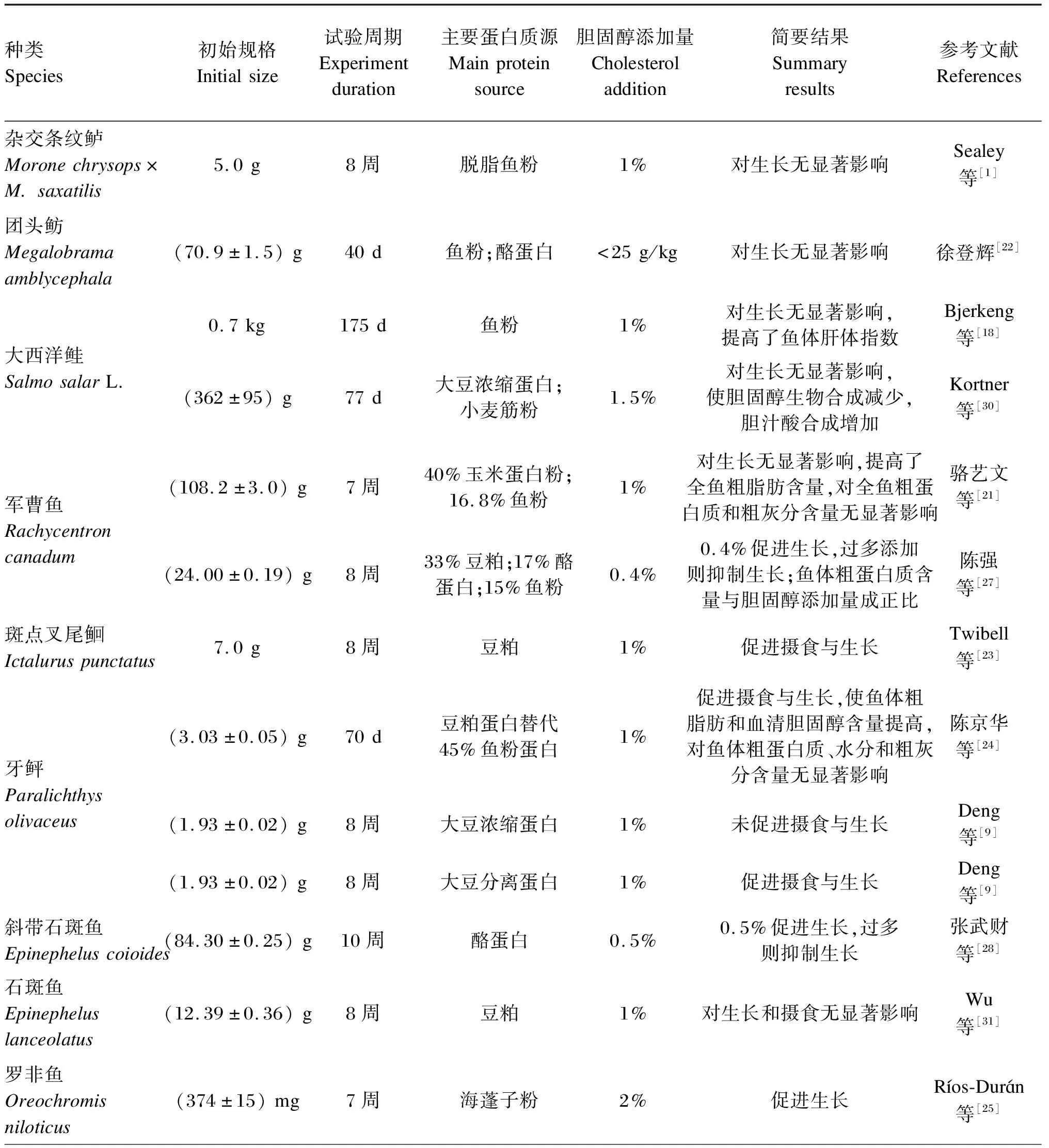
表2 鱼类胆固醇营养需求的相关研究
4 胆固醇代谢的影响因素及调控机制
4.1 胆固醇代谢的影响因素
4.1.1 营养素
外源摄入的营养物质可以通过调节胆固醇代谢的相关因子及关键酶的活性来改变机体的胆固醇代谢,影响胆固醇稳态。胆固醇在机体内的运输与脂蛋白密切相关,而磷脂又是脂蛋白的重要组成成分,在胆固醇的转运过程中发挥着重要作用。韩冰[34]研究发现,饲料中磷脂与胆固醇在影响半滑舌鳎(Cynoglossussemilaevis)稚鱼的生长作用上具有很强的相关性,当饲料中不含磷脂时,随胆固醇含量的升高,特定生长率先升高后下降;而当饲料磷脂含量为5.0%或7.5%时,不添加胆固醇组的特定生长率显著高于胆固醇添加组。由此可见,在饲料中添加磷脂可以起到一定的节约胆固醇的作用。
升高狼鲈(Dicentrarchuslabrax)饲料中碳水化合物的含量后,肝脏HMGR基因表达上调,胆固醇合成增多[35]。在虹鳟中,投喂富含碳水化合物的饲料也导致了血浆胆固醇含量的增加[36]。植物油替代鱼油使得大西洋鲑的胆固醇生物合成相关基因表达量升高[37]。而本实验室在对红鳍东方鲀(Takifugurubripes)的研究中则发现,富含n-6多不饱和脂肪酸的油源倾向于升高总胆固醇含量而降低HDL-C含量[38]。对长链多不饱和脂肪酸调节鲆鲽类性类固醇激素合成的作用,本实验室也进行了初步的研究,发现在半滑舌鳎饲料中DHA/二十碳五烯酸(C20∶5n-3,EPA)比例为1.09时显著促进了雌鱼雌二醇的生成,DHA/EPA比例为2.05时显著促进了雄鱼睾酮的生成[39]。饲料中的ARA亦可调节半滑舌鳎体内性类固醇激素的合成,但其效果取决于鱼的性别和成熟阶段[40]。大体来看,ARA对性类固醇激素合成的调控作用在性腺发育早期更加明显(相对于性腺发育后期),在雄鱼中更加明显(相对于雌鱼)[40]。而且,相关研究结果还发现,3β-羟基类固醇脱氢酶(3β-HSD)可能是饲料脂肪酸调控半滑舌鳎性类固醇激素合成的重要靶标蛋白。本实验室在另一种鲆鲽鱼类大菱鲆中也进行了类似的相关试验,但与在半滑舌鳎中所得结果不同的是ARA的添加降低了亲鱼性类固醇激素的合成[41]。饲料中添加抗坏血酸会增加虹鳟血清总胆固醇和LDL及粪便胆汁酸含量,上调肝脏HMGR和胆固醇7α-羟化酶(CYP7A1)的表达,降低肝脏LDL受体含量和血清皮质醇含量[42]。

当然,低胆固醇含量的饲料原料替代鱼粉会影响胆固醇代谢,但这种影响可能主要是胆固醇含量的变化而非其他营养成分的变化所带来。例如,以脱脂豆粕替代鱼粉会降低虹鳟血浆胆固醇和甘油三酯的含量[46]。饲料中添加450~600 g/kg橡胶籽粕可降低杂交罗非鱼(Oreochromisniloticus×O.aureus)肝脏HMGR、CYP7A1活性和LDL受体含量[47]。此外,饲料营养水平的不同对机体胆固醇代谢产生的影响也不同。饥饿和禁食处理会减少机体HMGR的合成,从而抑制肝脏胆固醇的合成[48]。最后,值得一提的是,植物固醇的添加可能会抑制外源性胆固醇的吸收,增加肝脏合成胆固醇的能力,这在大鼠中得到了证实[49],但是在鱼类中尚未有相关报道发表。
4.1.2 非营养性饲料添加剂
大豆皂苷具有热稳定性,是三萜系化合物配糖体。饲料中添加300 mg/kg的皂苷可以显著提高尼罗罗非鱼肌肉胆固醇的含量[50],但是在以鱼粉为基础的饲料中添加大豆皂苷对大菱鲆胆固醇代谢无显著影响[4]。赵峰等[51]研究表明,在罗非鱼饲料中分别以及联合添加果寡糖和枯草芽孢杆菌,均能使得机体血清甘油三酯及胆固醇含量下降。
4.1.3 环境因素
鱼类作为一种水生脊椎动物,其生长及生理代谢受环境因子如盐度、密度以及水污染的影响较大。盐度是影响鱼类生长和生存的重要环境因子之一,金枪鱼(Trachinotusovatus)血清胆固醇含量随水环境盐度的增加先降低后升高,当盐度为25‰时机体血清胆固醇含量最低[52]。随着饲养密度的增加,团头鲂血清中的皮质醇和甘油三酯含量显著增加,而总胆固醇含量显著下降[53]。当对鲤鱼(Cyprinuscarpio)进行急性氨氮胁迫时,对照组与试验组间血清胆固醇含量无显著差异[54]。此外,重金属和人工合成药物的不恰当处理会导致脂质调节类药物被排放到水环境中成为污染物,通过水环境干扰鱼类的脂质代谢[55]。对成年斑马鱼(Daniorerio)分别投喂喷洒有吉非罗齐和阿伐他汀的饲料后,发现雌鱼和雄鱼的胆固醇含量均显著降低[56]。
4.2 胆固醇代谢的调控机制
4.2.1 激素调节
激素是调节胆固醇代谢的重要因素之一,主要通过促使HMGR磷酸化(非活性)和去磷酸化(活性)的发生影响胆固醇的合成。可对胆固醇代谢产生调节作用的激素主要包括胰岛素、胰高血糖素、甲状腺激素和皮质醇等。胰高血糖素会促进HMGR的磷酸化,从而抑制胆固醇的合成[11],胰岛素的作用与之相反。此外,胰岛素和甲状腺激素还可以通过诱导HMGR的合成来促进胆固醇的合成。
4.2.2 胆固醇的负反馈调节
细胞内胆固醇的含量可以负反馈调节胆固醇的合成代谢,主要是通过调节胆固醇合成的主要限速酶HMGR来实现的[10]。肝脏HMGR的活性以及mRNA水平的反馈调节有助于实现机体的胆固醇稳态[57-58]。HMGR的合成与降解都受到胆固醇含量的调控,当机体内胆固醇含量超过正常水平时,HMGR的转录减少且降解增加,从而减少机体胆固醇的合成。相关研究表明,随着饲料胆固醇含量的增加,鱼类肝脏中HMGR的表达量显著降低[17,20,59]。并且,与植物性蛋白质组相比,鱼粉组黄尾鰤肝脏中HMGR的表达量显著降低[10]。与之相对应的是,胆汁酸合成关键酶CYP7A1的表达量显著上升。这表明胆固醇底物的增加促进了胆汁酸的合成,从而增加了胆汁酸的转化率[30]。
5 小结与展望
鱼类能够自身合成胆固醇,但外源胆固醇的添加在鱼类饲料中的必要性目前存在争议,尤其是在“不含胆固醇的植物性原料在水产饲料中应用越来越广泛”这一大背景下,在高植物性蛋白质饲料中添加外源性胆固醇的必要性需要重新进行系统的评估。目前关于鱼类胆固醇营养需求的评估仍然仅仅局限在对鱼类摄食、生长性能和体成分的关注上。然而,胆固醇作为一种重要的类脂质及载脂蛋白的重要组成成分,其对鱼体脂质代谢的影响及相关调节机制值得进行深入研究。此外,胆固醇代谢的鱼类种属差异、鱼类不同生长阶段间胆固醇的营养需求差异、不同饲料原料及其他营养素对胆固醇代谢的影响也需要进行进一步评估和深入研究。此外,目前关于胆固醇代谢途径的研究多集中于哺乳动物,相关代谢途径在鱼类中是否完全保守,也需要大量试验进行科学验证。

