荷瘤小鼠血清中细胞因子表达谱分析
徐俪菲,王宇
(锦州医科大学基础医学院,辽宁 锦州 121000)
恶性肿瘤是21世纪全球范围内最常见的疾病之一,随着癌症患者死亡率的不断增加,已经严重损害了人类的健康[1-2]。癌症的发生、发展是一个复杂的多阶段过。在临床实践中,包括手术切除、放射治疗、化学治疗、激素治疗等传统的癌症治疗方式取得了一定的疗效[3],但癌症患者5年生存率低。研究表明[4],如果能早期发现恶性肿瘤,其5年生存率可高达90%。因此,癌症的早期诊断对癌症患者的临床治疗至关重要。
研究表明[5],多种细胞因子参与癌症的增殖、凋亡、侵袭等生理变化过程。细胞因子是细胞在各种刺激下分泌的小分子,通过与靶细胞上的特定受体结合参与生物学过程。相关研究证明[6],细胞因子分泌的炎症因子不仅可以直接损伤肿瘤细胞,而且在激活单核细胞杀灭肿瘤细胞中起着关键作用。例如,在肝癌患者中,引发肝脏损害的因素主要是Th1型炎症细胞中的IP-10和趋化因子配体5(chemokine igand 5,RANTES)细胞因子。它们不仅能高效活化淋巴细胞,并能发挥识别、渗入和黏附炎症部位的功能。因此,IP-10和RANTES可以直接参与机体的免疫应答过程,还可以有效发挥其抗病毒和聚集淋巴细胞的重要作用[7]。白介素和趋化因子作为促炎因子,在许多免疫性疾病和炎症反应中起着至关重要的作用,它们也与肿瘤密切相关。鉴于发现白介素和趋化因子在多种恶性肿瘤表达中均有不同程度的差异,因此,检测其在血清或者组织中的表达情况对恶性肿瘤的临床诊断具有重要参考价值。本研究通过构建荷瘤小鼠模型检测IL -2,IL -6 和IP-10等细胞因子在常见恶性肿瘤中的表达水平,为癌症的预防和诊断提供参考。
1 材料与方法
1.1 实验动物及试剂
SPF级6~8周龄的BALB/c小鼠和C57BL/6小鼠购买自北京维通利华公司,饲养于实验动物中心。DMEM培养基、1%青、链霉素和胎牛血清、0.25%胰酶消化液购于美国Gibco公司。
1.2 方法
1.2.1 细胞培养
肿瘤细胞培养在含有10%FBS和1%青、链霉素的DMEM完全培养基中,于37 ℃,5%CO2培养箱中孵育。
1.2.2 荷瘤动物模型
取对数生长期的肿瘤细胞,经0.25%胰酶消化后,用PBS清洗并计数,重悬后备用。将各系肿瘤细胞悬液皮下接种于实验组小鼠背侧皮肤,其中MC-38组细胞数为1×105、B16组细胞数为1×105、E0771组细胞数为1×106、Hepa1-6组细胞数为1×107、4T1组细胞数为2×106。观察30 d后通过小鼠眼球取血,离心后取上层血清。对照组小鼠不做任何处理后,直接通过小鼠眼球取血,在相同条件下,离心后取上层小鼠血清。解剖分离所有荷瘤小鼠的肿瘤并称量,绘制相关曲线。
1.2.3 Luminex细胞因子检测
Luminex 200系统用于测量血清样品的细胞因子表达水平,包括肿瘤坏死因子α(tumor necrosis factor,TNF-α)、白细胞介素1α(interleukin-1α,IL-1α)、白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)、白细胞介素8(interleukin-8,IL-8)、白细胞介素10(interleukin-10,IL-10)、白细胞介素15(interleukin-15,IL-15)、白细胞介素1(interleukin-13,IL-13)、干扰素γ (interferon γ,IFN-γ)等。使用Luminex200 IS V2.1软件从平均荧光强度获得浓度值,标准曲线由参考细胞因子梯度浓度生成,从标准曲线计算样品中这些细胞因子的浓度。
1.2.4 统计学方法

2 结 果
2.1 小鼠血清中各型细胞因子水平的检测结果
TNF-α,IL-1α,IL-1β,IL-6,IL-8,IL-10,IL-15,IL-13,IFN-γ在肿瘤的发生、发展中发挥重要作用。在MC-38组中,IL-2、白细胞介素9(interleukin-9,IL-9)、趋化因子巨噬细胞炎性蛋白MIP-1(MIP-1α和MIP-1β),IP-10表达最高(P<0.001),见图1A。此外,还观察到B16组MIP-1α、IL-6高于正常对照组的趋势持续存在,见图1B。E0771组与正常组相比,IL-2、MIP-2有显著性差异(P<0.01),见图1C。MIP-1的浓度结果显示,Hepa1-6组均高于正常组(P<0.05),见图1D。对于IL-2的水平,4T1组明显高于正常组(P<0.05),见图1E。值得注意的是,在MC-38,E0771,Hepa1-6,4T1组之间也发现了IL-2水平的显著差异。与正常组相比,B16组IL-6浓度较高(P<0.01),而MC-38组IL-6浓度差异明显低于B16组。各组间IFN-γ浓度无显著差异。对于趋化因子IP-10来说,Hepa1-6组的浓度低于正常对照组;MC-38,B16,4T1组水平则高于正常组。
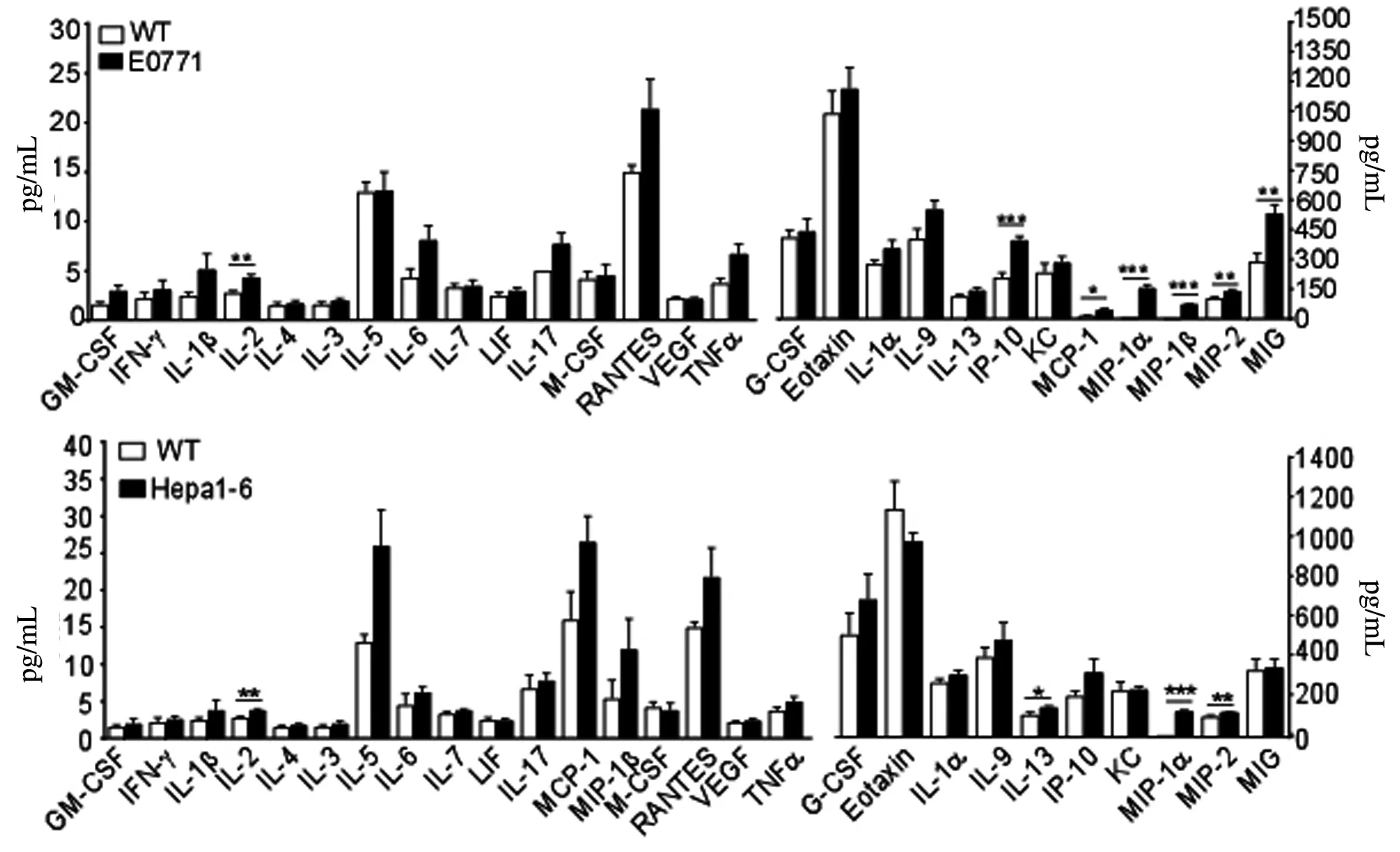


A代表MC-38组血清中细胞因子表达谱;B代表B16组血清中细胞因子表达谱;C代表E0771组血清中细胞因子表达谱;D代表HEPA1-6组血清中细胞因子表达谱;E代表4T1组血清中细胞因子表达谱(*P<0.05,**P<0.01,***P<0.001,n=15)
2.2 对照组与荷瘤小鼠血清中各型细胞因子水平
对照组和荷瘤实验组血清中相关几种细胞因子(G-CSF、IL-2、IL-4、IL-9IL-6、IL-10、IP-10、MIP-1β、TNF- α、IFN- γ、IL-6)水平。与对照组比较,4T1组荷瘤小鼠血清中G-CSF、IL-2、IL-4、IP-10 、TNF- α水平明显升高(P<0.05),见表1。而MC-38组血清中,IL-2、IL-9、MIP-1β、IP-10有明显差异(P<0.001),见表2。与正常组相比,B16组IL-6、Eotaxin浓度较高(P<0.01),见表3。E0771组中,TNF-α水平则无显著差异,见表4。Hepa1-6组中,IL-2的水平与对照组相比,仍然有显著差异(P<0.01),见表5。
2.3 肿瘤重量与细胞因子相关性分析
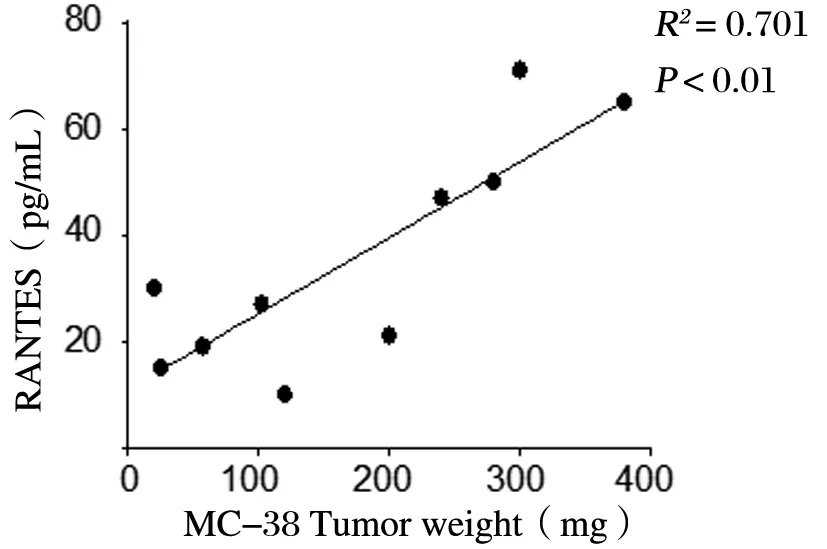
Pearson相关分析显示,MC-38组中,IP-10、MCP-1、RANTES与肿瘤重量均呈正相关,E0771组中,IL-9与肿瘤重量呈正相关,见图2。

表1 对照组和4T1组血清中细胞因子水平

表2 对照组和MC-38组血清中细胞因子水平

表3 对照组和B16组血清中细胞因子水平

组别G-CSFEotaxinIL-2IL-4IL-9IL-10IP-10MIP-1βMIP-2TNF-αIFN-γIL-6E0771组48.5±38.4517.8±237.75.1±4.14.3±0.96.4±7.8601±1627.7±2.9113±80.44.5±2.82.1±0.33±1.413.1±4.9对照组519±2201415±6482.7±0.51±0.8410±1255.7±11.5204±566.7±5.3105±11.88±82.2±1.58.5±8.4t值0.1012.3231.1675.7941.7027.1542.0000.2260.1802.0000.8431.598P0.9010.0650.2230.1000.110<0.0010.8300.9670.9230.0700.4230.146

A
C

D
3 讨 论
癌症是全球死亡的主要原因之一。迄今为止,超过1600万人被诊断患有癌症。由于肿瘤发病隐匿及初期症状不明显,肿瘤患者被确诊时多处于中晚期,临床治疗效果差而导致恶性肿瘤患者的术后生存率低[8]。为了提高全民健康水平,亟需对癌症进行早期诊断和治疗。
细胞因子是由外界刺激炎性细胞而合成分泌的一类具有多种功能的小分子蛋白质,作为细胞间信号转导分子,主要参与免疫细胞分化发育、介导免疫反应和炎症反应等。现如今细胞因子在各种疾病中的表达也有很多报道[9]。现有研究中酶联免疫吸附测定(enzyme-linked immuno sorbent assay,ELISA)等常用检测方法大多以单一因子检测为主,且检测的细胞因子种类也较少。本研究采用Luminex检测荷瘤小鼠血清中的细胞因子,我们发现,与对照组比较,血清中的IL-2,IL-6,IP-10的表达量在多种肿瘤细胞中都具有显著差异。临床上,IL-2,IL-12和IL-15已经在小鼠癌症模型中显示了疗效,并且大剂量IL-2已经用于治疗转移性肾细胞癌和转移性黑色素瘤,表明这些血清标志物对癌症具有一定的诊断价值[10]。然而,单一的细胞因子疗法并没有达到小鼠模型试验中所看到的效果,所以,我们的目的是利用多参数联合分析细胞因子来提高诊断的敏感性和特异性。
炎症被认为是癌症进展的危险因素。在这个过程中,活化的吞噬细胞分泌大量的促炎细胞因子,如IL-6、IL-8、TNF-α等。这些促炎细胞因子的表达水平在炎症反应性疾病中显著增加。有关血液中细胞因子的表达谱检测在肿瘤中也有很多报道[11]。故本研究从细胞因子表达谱着手,观察荷瘤小鼠及野生型小鼠相关细胞因子表达的情况,并对上述模型的特征进行初步探究。实验结果显示,荷瘤各组小鼠均出现了血清细胞因子表达谱的差异。与正常组比较,MC-38、B16组IL-6、TNF-α水平明显升高,具有统计学意义。大量文献表明[12],IL-6在许多肿瘤组织和周围血管中活跃,引起各种细胞因子的分泌增加。它不仅能直接刺激单核-巨噬细胞和成纤维细胞分泌IL-6,而且其在自身生长过程中也能分泌大量IL-1α促进恶性细胞增殖。IL-6及其受体的失衡影响了整个微环境的稳定性,导致免疫功能紊乱,从而诱发肿瘤。TNF-α是由巨噬细胞和活化的T细胞产生的多功能细胞因子,它参与诱导急性白蛋白反应,并通过激活中性粒细胞和淋巴细胞来调节代谢活动。我们发现,趋化因子家族在肿瘤微环境中的研究也逐渐受到重视。趋化因子本身能够与血管内皮细胞相结合,具有激活并趋化白细胞移动的作用。IP-10是一种由I型和II型干扰素诱导的淋巴细胞靶向CXC趋化因子,它由肿瘤浸润性免疫细胞及富含干扰素和细胞因子的肿瘤细胞和实质细胞分泌,并且在炎症条件下对淋巴细胞的募集起重要作用[13]。
在本研究中,虽证实抗炎性细胞因子、趋化因子及促炎性细胞因子与肿瘤的发生有着密切的关系,然而,前期我们只做了基础性研究,之后其中一个主要问题是在动物模型中,我们将讨论上述基因参与促进肿瘤发育的机制。利用STRING数据库构建这些基因的相互作用网络模型,从而依据模型来预测潜在的靶向基因有IL18、foxp3等。利用生物信息学分析确定了差异表达的基因,它们可能与癌症的发生、发展和预后相关,并对发现的差异表达基因,进行RNA测序,探寻其调控肿瘤发生、发展的信号通路[14]。然而,这些我们还没有后续的实验验证,还有许多困难需要克服,需要对其调控机制进一步研究。
综上所述,抗炎性细胞因子、趋化因子及促炎性细胞因子等细胞因子形成了错综复杂的细胞因子调节网络,进而影响临床癌症治疗。阐明这些细胞因子的变化和作用,对于研究肿瘤的发生及发展机制具有重要意义,进而为临床肿瘤早期诊断及治疗提供新的理论基础。

