N-myc下游调控基因1在肝细胞癌中的表达及其与预后的相关性
郭晶晶,徐瀚峰,朱传东,缪 祎,郑 勤
0 引 言
肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌中最常见的一种恶性肿瘤。在全球范围内,肝细胞癌是第六大最常见的癌症和第四大癌症死亡原因[1]。2018年,肝癌发病人数约为84.1万人,死亡人数为782 000人[1]。遗憾的是,由于早期发现困难,复发率高,目前对于大多数确诊为中晚期的HCC患者尚无有效的治疗方法。因此,探索可靠的HCC生物标志物对早期诊断和预后尤为重要。N-myc下游调控基因1(N-myc downstream regulatory gene1,NDRG1)是NDRG家族的基因之一,在不同的肿瘤类型中表现出不同的抗肿瘤或致癌作用[2]。有研究表明,NDRG1作为抑癌基因在前列腺癌、胰腺癌和结直肠癌中低表达[3-5]。相反,有报道称NDRG1在胃癌、宫颈癌、肾癌、鳞状细胞癌等多种癌症中过表达,提示其具有致瘤作用[6-10]。NDRG1在肝癌中的表达目前存在争议。有研究认为NDRG1在肝癌中高表达,NDRG1表达增加可促进体外肝细胞癌和肝癌细胞的增殖和侵袭,促进肿瘤生长和血管生成,促进了肝癌的发展[11-13]。但是其他一些研究人员认为NDRG1作为抑癌基因在肝癌组织中低表达,抑制肝癌的发展[14-15]。本研究旨在探讨NDRG1在肝癌组织和正常肝组织中的表达,探讨NDRG1在肝癌发生发展中的作用机制。
1 资料与方法
1.1 数据收集从TCGA (The Cancer Genome Atlas) (https://portal.gdc.cancer.gov/repository)公共数据库下载mRNA表达数据(465例,包括58例正常肝组织标本和407例肝癌标本)及与之相应的临床信息。
1.2 NDRG1在正常肝组织和肝癌组织中的表达及其与临床因素相关性分析407例肝癌患者的临床资料,包括年龄、性别、临床分期、组织学分级、淋巴结转移(TNM)分级、生存状况和生存时间。使用R语言软件(R 3.6.3),采用Limma包检测NDRG1在407例肝癌患者和58例正常肝组织中的表达。使用beeswarm包对407例肝癌患者和58例正常肝组织的NDRG1表达进行了可视化。根据NDRG1表达的中位数,将所有患者分为NDRG1低表达组和NDRG1高表达组。使用survival包分析NDRG1低表达组和NDRG1高表达组的生存情况。使用logistic回归分析NDRG1表达与临床因素(年龄、性别、分期、分级、远处转移状态、淋巴结状态、组织学分级)的相关性。
1.3 基因集富集分析(gene set enrichment analysis, GSEA)使用GSEA软件,上传407例肝癌组织中的NDRG1表达文件,比较NDRG1高表达和NDRG1低表达的数据集,依据功能基因集数据库,选择京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路,筛选HCC中潜在信号通路,发现可能的信号通路,探讨NDRG1的生物学功能。富集结果必须满足两个条件:错误发现率(false discovery rate,FDR)<0.05和P<0.05。
1.4 浸润免疫分析利用TIMER网站(https://cistrome.shinyapps.io/timer/)在线研究NDRG1表达与肝癌免疫浸润细胞的关系,得到NDRG1在HCC中的表达与CD4+T细胞、树突状细胞、B细胞、CD8+T细胞、中性粒细胞、巨噬细胞的相关性。应用CIBERSORT(http://cibersort.stanford.edu/)评估HCC中不同免疫浸润细胞与NDRG1表达的关系,并揭示免疫细胞之间的相关性。将407例肿瘤标本分为NDRG1高表达组和NDRG1低表达组,观察2组免疫浸润细胞表达的差异。
1.5 使用Human Protein Atlas (HPA)数据库验证NDRG1蛋白表达为进一步检测NDRG1蛋白的表达,使用来自HPA公共数据库(http://www.proteinatlas.org/)的免疫组织化学(IHC)数据,对HPA中NDRG1蛋白在肝正常组织切片和肝癌组织切片中的免疫组化染色结果进行检索。比较NDRG1在正常肝组织和HCC组织中的蛋白表达。
1.6 使用基因型组织表达(GTEx)数据库显示NDRG1在人类肝组织中的表达GTEx数据库是一种包含人体各种器官遗传信息的工具。GTEx数据库包含了来自44个组织的7000多份尸检样本的基因表达。使用GTEX数据库(https://www.gtexportal.org/home/),以发现NDRG1在正常人体组织中的表达水平。
1.7 统计学分析采用SPSS 22.0和R 3.6.3进行统计分析。使用R软件对NDRG1在TCGA数据集中的表达采用单因素Cox分析和多因素Cox分析。使用Wilcoxon符号秩检验和logistic回归比较TCGA数据集中肝癌样本的临床特征和NDRG1的表达的相关性。总体生存分析采用Kaplan-Meier法进行双侧对数秩检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 NDRG1在肝癌中的表达及临床病理因素与正常组织相比,肝癌组织中NDRG1表达增加(P<0.001)。NDRG1表达与组织学分级(G)(P<0.001)、临床S分期(P=0.03)、临床T分期(P=0.018)呈正相关。采用logistic回归分析显示NDRG1表达与临床病理不良预后相关。NDRG1在肝细胞癌的高表达与组织学分级(G)显著相关(G3vsG1:OR=2.072,95%CI=1.091~3.992,P=0.027;G4vsG1:OR=6.957,95%CI=1.640~48.134,P=0.018)、临床分期(S)显著相关(ⅢvsⅠ:OR=1.832,95%CI=1.095~3.095,P=0.0221)和临床T分期显著相关(T3vsT1:OR=1.908,95%CI=1.142~3.224,P=0.0145)。见表1,图1。提示NDRG1高表达对应临床分期较差,预后较差。HPA数据库中检索发现在正常肝组织中,NDRG1蛋白低表达,而在HCC组织中NDRG1蛋白高表达。

表1 肝细胞癌中NDRG1表达与临床病理特征相关性

a:在正常肝组织和肝癌组织的表达;b:在正常肝组织及其相对应肝癌组织的表达;c:年龄;d:性别;e:G分级;f:S分期;g:T分期;h:M分期;i:N分期图1 NDRG1在肝细胞癌中的表达与临床因素相关性
2.2 NDRG1在正常肝组织中的表达使用GTEx数据资料,发现NDRG1在不同组织中的表达不同,相比较其他正常组织,正常肝组织中NDRG1表达较低。
2.3 NDRG1表达与生存结果相关性及其单因素、多因素分析NDRG1的高表达与较差的总生存率显著相关(P=0.005),见图2。单因素Cox分析显示,NDRG1高表达与较差的总生存率显著相关(HR=1.012,95%CI=1.008~1.015,P<0.001)。不良生存相关的临床病理的特点包括S分期(HR=1.865,95%CI=1.456~2.388,P<0.001),T分期(HR=3.850,95%CI=1.207~12.281,P=0.0228)和M分期(HR=3.850,95%CI=1.207~12.281,P=0.0228)。多因素Cox分析表明,高NDRG1表达是独立危险因素,与肝细胞癌患者的总生存期密切相关(HR=1.010,95%CI=1.006~1.014,P<0.001)。见表2。

图2 NDRG1在肝细胞癌患者中的表达与总生存率
2.4 GSEA识别NDRG1相关的信号通路GSEA显示了在丰富MSigDB集合方面的显著差异(h.all.v6.2.symbols.gmt),FDR-q<0.25和P<0.05的基因组显著富集。根据标准化的富集分数,确定最显著的富集信号通路。NDRG1高表达与DNA修复、E2F、G2M检查点、MYC-V1、P53通路、TGF-β通路等相关。见图3。

表2 NDRG1表达与肝细胞癌患者生存结果的单因素Cox分析和多因素Cox分析
2.5 NDRG1表达与肿瘤浸润免疫细胞的关系NDRG1表达与B细胞(P=2.33×10-9)、CD4+T细胞(P=2.68×10-5)、巨噬细胞(P=3.95×10-12)和树突状细胞(P=1.98×10-9)相关。与NDRG1低表达组相比,高表达组单核细胞和M0巨噬细胞升高(P<0.05)。见图4。
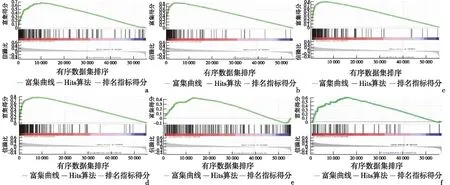
a:DNA修复;b:E2F通路;c:G2M检查点;d:MYC-V1通路;e:P53通路;f:TGF-β通路图3 基因集富集分析

a:与免疫细胞的相关性;b:NDRG1高、低表达组的免疫细胞水平图4 肝细胞癌中NDRG1表达与肿瘤浸润免疫细胞的关系
3 讨 论
NDRG1是一个与细胞分化相关的基因,属于NDRG家族。该基因编码的蛋白质是一种细胞质蛋白,参与应激反应、激素反应、细胞生长和分化[16]。在前列腺癌、结直肠癌、卵巢癌等恶性肿瘤中下调表达是一种转移抑制剂,可以抑制血管生成、细胞增殖和侵袭[17-19]。在肺癌、胃癌等恶性肿瘤中,表达上调并有致瘤作用[20-21]。NDRG1对癌症患者的预后影响也不一致[22-23]。大多数关于NDRG1与肝癌关系的研究倾向于该基因在肝癌组织中的表达增加,在正常肝组织中的表达降低。该基因参与肿瘤的发展,但它抑制或促进肿瘤的发展仍存在争议。
本研究结果显示,NDRG1在肝癌组织中的表达明显高于正常肝组织,且NDRG1的表达水平在临床病理分级、TNM临床分期、肝癌患者生存时间等方面均有统计学意义。GTEx数据库的正常人类数据显示,NDRG1在肝中低表达。HPA数据显示NDRG1蛋白在肝癌组织中表达量高,在正常肝组织中表达量低。两者都表明NDRG1可能在肝细胞癌的发展中发挥潜在的癌基因作用。目前NDRG1可能的致癌信号机制主要包括AKT、EGF、ErbB、Wnt/β-catenin、MAPK、jak-stat等途径[24-27]。本研究通过GSEA富集分析发现其主要信号通路为E2F、MYC、G2M、pik-Akt、P53、TGF-β。本研究验证了NDRG1在肝癌中的高表达,发挥促进肝癌发生发展的作用,与多数文献报道相一致。提示NDRG1可作为肝癌诊断和预后的潜在预后标志物。但本研究局限于利用公共数据库进行分析,还需要进一步的实验进行验证。对于其致癌信号通路研究只限于生物信息学研究,还需要进一步的实验室研究。
肝细胞癌是原发性肝癌的主要组织学类型,对于不能手术的中晚期患者,放化疗及介入治疗为可选的治疗方法,但预后较差。肿瘤免疫治疗是新的治疗手段,张南征等[28]采用细胞因子诱导的杀伤性细胞(cytokine induced killer cells,CIK)联合介入治疗中晚期肝细胞肝癌,有效率优于单纯介入治疗,延长了患者的生存期。
肿瘤微环境中免疫细胞的组成与预后有关。肿瘤新抗原在抗肿瘤免疫反应和预测免疫治疗的临床反应中发挥重要作用[29]。M2巨噬细胞和M1巨噬细胞与肿瘤的生长和扩散以及免疫抑制微环境的形成有关[30-31]。有研究表明,在结肠癌组织中,M0巨噬细胞,M1巨噬细胞和CD4记忆激活的T细胞浸润明显更多。M0巨噬细胞在N1期肿瘤中最高,提示M0巨噬细胞可能促进肿瘤生长发展[32]。另一项对于865例HCC患者的研究表明,生存率较差的高危组中巨噬细胞M0的比例高于低风险组,细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)、程序性死亡受体-1(programmed cell death-1,PD-1)和T细胞免疫球蛋白黏连蛋白-3(T cell immunoglobulin mucin molecule 3,TIM-3)的表达也高于低风险组[33]。本研究发现NDRG1与M0巨噬细胞呈正相关,在肿瘤组织中高表达,与M0巨噬细胞促进肿瘤发生发展的作用相一致,提示其可能通过M0巨噬细胞参与肿瘤微环境,促进肝癌的发生发展。目前对于M0巨噬细胞在肝癌微环境中的作用相关研究很少,需要进一步实验验证。本研究推测M0巨噬细胞可能成为未来肝癌免疫治疗的新靶点。是否可以通过调控NDRG1表达进而影响M0巨噬细胞在肿瘤微环境中的比例,从而达到抑制肝癌发展的作用,需要进一步研究。

