艾滋病合并肝细胞癌患者的病理特征及其对生存率的影响
赵辉 汪勇 许飞龙 凌洲焜
近 年 来 艾 滋 病(acquired immune deficiency syndrome,AIDS)患者生存期明显延长,预期寿命已经接近普通人群[1]。随着艾滋病患者的寿命延长,发生恶性肿瘤的机会增加。有研究显示肝细胞癌(hepatocellular carcinoma,HCC)已成为艾滋病患者的发病率和死亡率的主要原因,人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者的HCC发病率是普通人的7.7倍[2]。HCC是世界上最难治性的恶性肿瘤之一[3],目前普遍认为手术治疗是能够实现根治癌症及使其获得长期生存的最重要手段[4]。但手术比例低,术后易复发转移,总体预后差。近年来,免疫检查点抑制剂在HCC治疗上取得一定突破,有望成为未来最具前途的治疗方式之一。但目前HIV+HCC患者很难获得公平、合理的治疗,许多患者接受不太符合标准的治疗甚至根本未接受任何治疗[5]。认识不足、缺乏专业共识指南及职业暴露风险是其重要原因[6]。目前国内外关于手术治疗艾滋病合并肝细胞癌的临床、病理研究非常少,也还未见将免疫检查点抑制剂应用于艾滋病合并肝细胞癌患者的研究报道。因此,加强对该类患者的病理、临床研究既非常必要又迫在眉睫。笔者近年来对HIV+HCC的治疗特别是手术治疗进行了一系列研究。前期研究发现对HIV+HCC患者行根治性肝切除术是可行的,但更易发生围手术期死亡,肝功能衰竭是围手术期死亡的主要原因[7];HIV+HCC患者比非艾滋病HCC患者生存预后更差,HIV与HCC患者的生存率下降有关[8]。本研究通过对比艾滋病合并肝细胞癌与非艾滋病肝细胞癌患者的病理特征,从病理角度探讨HIV感染对HIV+HCC生存率的影响,并寻找PD-1/PD-L1抑制剂治疗HIV+HCC的可能依据。以期能提高对HIV+HCC患者的认识,并为其提供更佳治疗决策,改善治疗效果。
1 资料与方法
1.1 一般资料
回顾性分析2013年1月-2018年12月在广州医科大学附属市八医院接受根治性肝切除术的26例HIV+HCC患者的临床及病理资料。该26例患者HIV感染诊断经广州市疾病控制中心确认,均为HIV-1型,均已进入艾滋病期。将该26例患者设定为研究组即艾滋病肝细胞癌组,简称HIV+组。选择同一时期在本院接受根治性肝切除术的113例未合并艾滋病的肝细胞癌患者作为对照,即非艾滋病肝细胞癌组,简称HIV-组。肝癌诊断及根治性切除标准符合文献[9]原发性肝癌诊疗规范(2019年版);病理诊断符合文献[10]原发性肝癌规范化病理诊断指南(2015年版);艾滋病诊断符合文献[11]中国艾滋病诊疗指南(2018版)。纳入标准:(1)术前影像学评估为可切除肝癌;(2)手术达到根治性肝癌切除;(3)术后病理检查证实为HCC;(4)术前肝功能Child-Pugh分级A级或B级;(5)术前ECOG评分0或1分;(6)年龄≥18岁;(7)有完整的临床资料。排除标准:(1)术中发现有临近组织侵犯、肝门及远处淋巴结转移;(2)行腹腔镜肝切除术;(3)术前曾合并有肝癌破裂出血;(4)术前曾行放疗、化疗和/或消融治疗;(5)合并其他恶性肿瘤;(6)合并严重的心、肺、肾等脏器功能障碍。HIV+组26例,全部为男性;年龄28~64岁,中位年龄44.5岁。HIV-组113例,男101例,女12例;年龄29~75岁,中位年龄50岁。该研究经广州医科大学附属市八医院伦理委员会批准。
1.2 方法
1.2.1 常规病理检查 聘请两位资深病理专家重新阅片,根据病理资料收集要求单独阅片,分别报告。如出现差异,则讨论后一起重新阅片,达成一致意见。
1.2.2 PD-L1抗体表达检测 主要仪器:Dako公司Autostainer Link48自动免疫组织化学染色仪、全自动免疫组化预处理仪(PT Link,PT200)。主要试剂:Dako 公 司 EnVinsion FLEX(PD-L1 IHC 22C3)套装试剂盒:包括 Linker Anti-Mouse、Monoclonal Mouseanti-PD-L1 Clone 22C3、Target Retrieval Solution Low pH (50×)、Peroxidase-Blocking Reageagent、DAB Enhancer、Vi-sualizationI Reagent-HRP、Negative Control Reagent、DAB+Chromogen、Control SlidesDAB+Substrate Buffer等试剂。组织蜡块切片:取对照组、检测组蜡块,将蜡块3 μm切片各两张,裱在防脱载玻片上。所有蜡块均分蜡块阴性对照组、检测组,组织切片65 ℃烤片30 min,二甲苯脱蜡,经梯度乙醇至水化后待用。免疫组织化学染色:免疫组织切片抗原修复使用Dako全自动免疫组化预处理仪。先根据编辑程序打印相关条形码,蜡块测试及蜡块阳性对照片各一张,每例病例分组贴好不同条形码。再将EDTA组织修复液装入自动免疫组化预处理仪中,然后扣上仪器盖。按启动键,将修复液加热预温到65 ℃后。打开仪器盖,将组织切片及细胞片浸入修复液中。继续启动预处理程序进行98 ℃,20 min的抗原修复,到程序结束,将组织切片及细胞片pH 7.2~7.4 PBS缓冲液洗涤 3 min,蒸馏水洗涤 1 min。
PD-L1(22C3) 蛋 白 检 测: 使 用 Da-ko Autostainer Link 48 自动免疫组织化学染色仪,Dako EnVinsion FLEX(PD-L1 IHC 22C3)套装试剂盒上机检测(室温 22 ℃ ~25 ℃),染色主要步骤:(1)将修复好的组织切片及细胞片上机扫描开始染色,内源性过氧化物酶封闭 5 min,pH 7.2~7.4 Buffer冲洗,一抗PD-L1(22C3)室温孵育30 min(阴性对照片不需要加一抗),pH 7.2~7.4 Buffer冲洗 1 min。二抗室温孵育 30 min,pH 7.2~7.4 Buffer冲洗 1 min。(2)VisualizationI Reagent-HRP 室温孵育 30 min,pH 7.2~7.4 Buffer冲洗 1 min;DAB 室温显色 5 min×2 ;pH 7.2~7.4 Buffer冲洗 1 min。(3)扩大剂室温 5 min;pH 7.2~7.4 Buffer冲洗 1 min;苏木精复染 1 min,无水乙醇脱水,电吹风微风吹干,二甲苯透明,中性树胶封固。
1.2.3 PD-1抗体表达的检测 仪器、步骤参考PD-L1检测,抗体试剂采用广州安必平医药科技股份有限公司生产的鼠抗人PD-1单克隆抗体。
1.2.4 结果判定 PD-L1免疫组化(TPS)判读标准(参考试剂盒说明书):指部分或完整膜染色的肿瘤细胞占样品中存在的所有活肿瘤细胞的百分比(PD-L1染色阳性肿瘤细胞数/总活肿瘤阴性和阳性细胞数),判读中应排除任何免疫细胞、基质细胞、坏死细胞的阳性表达。TPS<1%或无肿瘤细胞表达为阴性,TPS≥1%为阳性;TPS 1%~49%为低表达,TPS≥50%为高表达。PD-1结果判定参考抗体试剂说明书:组织切片中可见目标细胞细胞质有棕色/棕黄色染色,且无背景染色即染色阳性。组织切片中未见目标细胞有棕色/棕黄色染色即为染色阴性。
1.3 统计学处理
本研究数据采用SPSS 25.0统计学软件进行分析和处理,计量资料以(±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。对预后相关因素采用Kaplan-Meier曲线生存分析、单因素分析,并以对数秩和检验(Log-rank)法比较各组间的生存率(OS)。
2 结果
2.1 两组临床基本资料对比
HIV+组确诊HCC时的年龄小于HIV-组,差异有统计学意义(P<0.05)。两组性别、体质量指数、BCLC分期、TNM分期比较差异无统计学意义(P>0.05)。HIV+组术前肝功能稍差,Child-Pugh评分B级占11.5%,而HIV-组为0.9%,差异有统计学意义(P=0.021),见表 1。HIV+ 组 CD4+<200 μl 13 例(50.0%),≥200 μl 13 例(50.0%);HIV RNA <400 拷贝 /ml 17 例(65.4%),≥400 拷贝 /ml 9例(34.6%)。

表1 两组临床基本资料对比
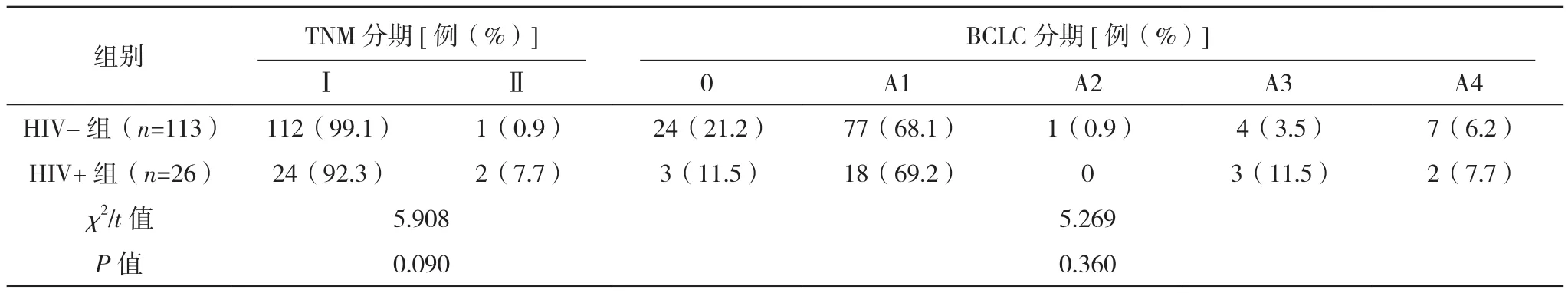
表1 (续)
2.2 两组常规病理特征对比
HIV+组微血管侵犯(MVI)发生率高于HIV-组,差异有统计学意义(P=0.017),HIV+组肿瘤直径>5 cm比例高于HIV-组(P=0.019),两组肿瘤分化程度、组织学分级及肝硬化差异无统计学意义(P=0.905、0.101、0.820),两组肝纤维化分级差异无统计学意义(P=0.050),见表2。

表2 两组常规病理特征对比[例(%)]
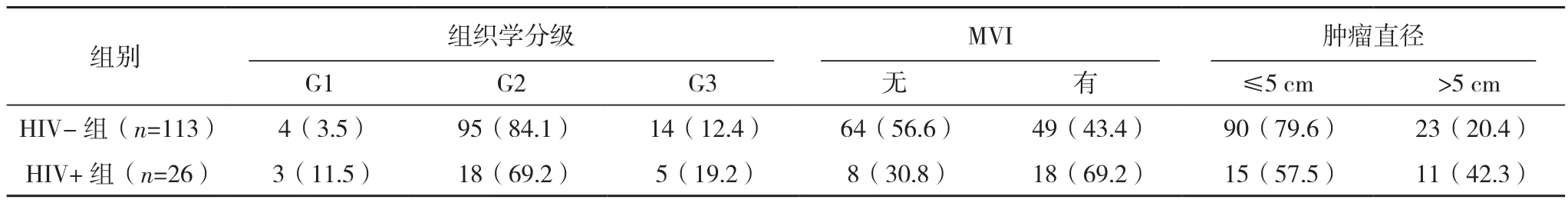
表2 (续)
2.3 不同病理特征肝细胞癌患者生存率比较
单因素分析MVI、肿瘤直径>5 cm影响预后,差异有统计学意义(P<0.05),见表3。

表3 不同病理特征肝细胞癌患者生存率比较
2.4 两组免疫组化检查(PD-1/PD-L1表达)对比
两组PD-1、PD-L1阳性表达率比较差异无统计学意义(P>0.05),单因素分析PD-1、PD-L1表达与预后不相关(P>0.05),见表4、表5。
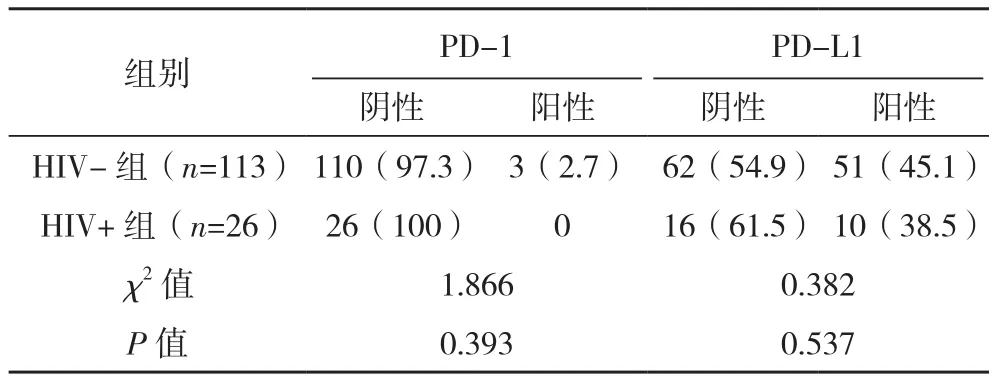
表4 两组PD-1/PD-L1在肿瘤细胞的表达对比[例(%)]
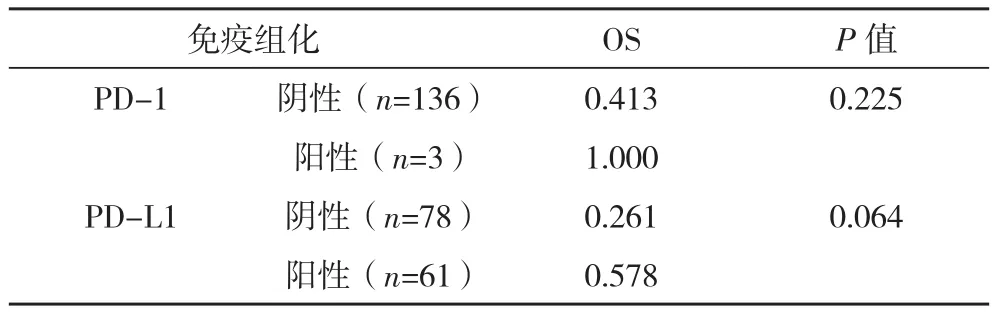
表5 不同免疫组化检查结果肝细胞癌患者生存率比较
3 讨论
肝细胞癌通常起病隐匿,早期多无明显症状,当患者就诊时多已进展到中晚期,错过最佳治疗时期,总体预后差,多年来形成的以手术为主的治疗模式正面临严峻挑战。近年来,免疫检查点抑制剂在抗肿瘤治疗领域异军突起、捷报频传,为肝细胞癌的治疗带来了新的希望,但免疫检查点抑制剂在艾滋病合并肝细胞癌患者应用尚未见相关研究报道。原因可能是多方面的,缺乏相关研究支持就是其中重要原因之一。笔者前期从流行病学、临床表现、手术治疗及术后并发症等方面对该病进行了一系列研究。本文从病理角度探讨HIV感染对艾滋病合并肝细胞癌生存率的影响,并寻找PD-1/PD-L1抑制剂治疗艾滋病合并肝细胞癌的可能依据。
本研究中HIV+HCC患者确诊时更年轻,这与文献[12]相似,主要考虑HIV的免疫协同作用导致肝细胞癌的更快进展。另一方面,随着艾滋病患者生存质量不断改善,其更重视自己身体状况,更愿意接受规范随访及常规检查,也更容易发现肿瘤。本研究中26例HIV+患者均为男性,男性比例明显高于HIV-组。性别差异主要考虑HCC好发于男性,男女比例接近4∶1。也可能与HIV传播方式的改变有关,近年来以男男同性传播为主。BCLC、TNM分期两组间差异无统计学意义(P>0.05),说明本研究中两组肿瘤分期及进展具有可比性,术前HIV+HCC患者肝功能稍差,考虑可能与HIV对肝细胞的直接损伤及抗HIV感染治疗药物的毒性作用有关。
在本研究中,两组始发表现、临床症状相似,但HIV+组容易发展成更大肿瘤,这可能与机体感染HIV后肿瘤更具侵袭性,生长更快有关。但两组间肝纤维化分级尚不能认为有差异(P=0.050),是否合并肝硬化两组间差异无统计学意义(P=0.820),但无合并肝硬化比例更高,与文献[12]相似,提示HIV/HBV患者更易从非肝硬化状态进展为HCC。目前机制不完全清楚,考虑是患者免疫功能受损或者HIV的免疫协同作用及与肝炎病毒共同感染加速了疾病进程。本研究中HIV+组更易发生MVI,两组间MVI发生率差异有统计学意义(P=0.017),无微血管侵犯的患者表现出较好的预后。近年来的研究表明:肿瘤大小、肿瘤形态、肿瘤包膜及癌周强化等与MVI相关[13]。随着肿瘤大小的增加,肿瘤向晚期发展,肿瘤的分化程度及其侵袭性增加,MVI 发生的概率也随之上升[14],这与我们的研究有很多相似之处。研究中发现HIV+组有92.3%为中低分化肝癌,单个肿瘤直径大于5 cm者明显多于HIV-组(P=0.019),这可能就是艾滋病合并肝癌更易发生MVI的原因。另外,HIV+ HCC患者中位诊断年龄更小,肿瘤更大,说明艾滋病患者肝细胞癌生长更迅速,更具侵袭性,更易出现MVI。
近年来,多项研究证实免疫检查点抑制剂对肝细胞癌特别是中晚期肝细胞癌具有明显的效果[15-17]。但是,免疫检查点抑制剂在临床的全面应用还面临许多问题。首先,关于PD-1和PD-L1在肝细胞癌上的表达水平及意义报道不一,甚至存在一些争议。李冰等[18]研究发现PD-1和PD-L1在肝癌中表达显著增高,并且可能与肝癌发生、发展及预后相关,但并未报道表达率比值。邱晓莉等[19]研究发现PD-1和PD-L1在中分化原发性肝癌组织中的表达显著高于高分化及低分化者。其次,目前PD-L1表达水平被广泛认可为PD-1/PD-L1抑制剂疗效预测标志物,但PD-L1检测存在缺乏一致性与检测金标准的缺陷[20]。肝细胞肝癌PD-L1靶向治疗的伴随诊断、判读阈值等也尚未达到比较统一的标准,目前甚至有文献在肝细胞癌采用其他肿瘤的评判标准[21]。但是,不论是先前的各种临床研究还是新近的药物试验,都没有将HIV感染人群纳入研究。这为免疫检查点抑制剂在艾滋病合并肝癌患者中展开治疗蒙上了一层阴影。在本研究中,PD-1在HIV+组的表达为0,在HIV-组的表达为2.7%,两组差异无统计学意义(P>0.05),也不影响患者的预后。这与李冰等[18]研究报道的高表达存在差异。PD-1在本研究中的低表达原因目前不清楚。一般认为肝细胞癌组织中PD-1的表达水平与肿瘤大小、有无门静脉癌栓和TNM分期有关,而与患者性别、年龄、肿瘤数目、病理分化程度和临床分期无关[22]。由于PD-1主要在活化淋巴细胞上表达,由此推测可能与各种刺激最终导致CD8+T淋巴细胞功能障碍和衰竭有关,但也有可能与本研究样本量太小有关。目前普遍认为免疫检查点抑制剂治疗肿瘤时其治疗效果取决于肿瘤细胞是否表达PD-1和PDL1,低表达或不表达PD-L1或PD-1的肿瘤,抗体治疗效果欠佳[23]。因此PD-1抑制剂是否可以被考虑在艾滋病合并肝癌的免疫治疗中有待进一步研究证实。在本研究中,PD-L1在HIV+组与HIV-组的表达率为(38.5% vs 45.1%),差异无统计学意义(P=0.537),且不影响患者的预后,但部分PD-L1表达人群却表现出更好的预后。这是否意味着像非艾滋病肝细胞癌患者一样,PD-L1抑制剂也应该被考虑到艾滋病合并肝癌的免疫治疗中值得进一步研究证实。
本研究是基于我国人群的单中心回顾性研究,这可能会在分析中引入潜在的偏见,且样本量相对较小,未能对HIV+组进一步分层分组研究。未来的研究中,应扩大样本并进行多中心研究。
综上所述,HIV合并肝细胞癌预后更差,可能与微血管侵犯有关,肿瘤大小是影响预后的重要因素,PD-L1抑制剂应用于HIV合并肝细胞癌应该被考虑。

