妊娠合并凝血因子Ⅺ缺乏症临床分析
焦海宁, 钟慧萍*, 刘 延, 王学锋
1. 上海交通大学医学院附属瑞金医院妇产科,上海 200025 2. 上海交通大学医学院附属瑞金医院输血科,上海 200025
女性孕期抗凝物质减少,凝血因子增加,纤溶性活性降低。妊娠晚期孕妇表现为生理性高凝状态,若同时合并凝血因子缺乏,就会存在出血倾向,危及母儿安全[1]。凝血因子Ⅺ(factor Ⅺ, FⅪ)缺乏症又被称为血友病C,是一种罕见的常染色体隐性遗传性出血性疾病,在犹太人和法国巴斯克人中常见,而罕见于中国人群,女性患者多于男性,发病率为1/100万~1/10万[2]。由于FⅪ在肝脏中合成,不依赖维生素K,故FⅪ缺乏均由合成量减少所致,但由FⅪ功能异常造成的其缺乏较罕见[3]。妊娠合并FⅪ缺乏症的总人群发病率较低,目前国内外相关研究较少,故国内对其临床诊治、妊娠结局及预后的评估较少。本研究回顾性分析我院产科11例妊娠合并FⅪ缺乏症患者的临床资料,旨在为今后的临床处理和评估提供参考。
1 资料与方法
1.1 一般资料 选取2015年1月至2020年4月上海交通大学医学院附属瑞金医院产科收治的妊娠合并FⅪ缺乏症患者11例,平均年龄为(29.63±7.14)岁,其中孕前确诊6例,3例孕早期及孕晚期外院产检发现活化部分凝血活酶时间(activated partial thromboplastin time,APTT)延长,查凝血因子确诊后转入我院,2例于我院初次产检时发现APTT延长,查凝血因子后确诊。其中9例足月妊娠均行剖宫产术终止妊娠,另2例早孕期患者由于个人因素行负压吸宫术终止妊娠。所有患者均知情并签署知情同意书。
纳入标准:无高血压、糖尿病、心脏病等内科疾病史;无妊娠期肝脏疾病等引起获得性凝血功能障碍性疾病;免疫相关指标(抗双链DNA抗体、抗核抗体、抗心磷脂抗体、类风湿因子等)均为阴性;狼疮抗凝因子试验阴性;未曾接受任何药物抗凝治疗;家族成员无相关病史;行双下肢动静脉彩超未见明显异常。排除标准:有高血压、糖尿病等内科疾病史;存在阳性免疫相关指标;有药物抗凝病史;有血栓栓塞疾病史。
1.2 FⅪ缺乏症的诊断标准 凝血功能检测:(1)APTT参考值为22.3~38.7 s,超出10 s以上为异常;(2)凝血酶原时间(prothrombin time,PT)参考值为10~16 s,超出3 s以上为异常;(3)纤维蛋白原(fibringen,Fg)参考值为1.8~3.5 g/L,低于1.8 g/L为异常。
凝血因子检测:若出现以上凝血功能异常则行凝血因子检测,FⅪ活性参考值范围为50%~150%,FⅪ活性<50%考虑诊断明确,需由血液科专科医师诊断。本研究所有患者均明确为FⅪ缺乏症。
1.3 资料收集 详细记录所有孕妇围产期的临床资料,包括年龄、孕周、产检次数、输血前后凝血功能及FⅪ活性等,新生儿出生后的情况(体质量及评分)及凝血功能(DIC全套),回顾性分析妊娠合并FⅪ缺乏症患者的围产期管理及母儿结局。
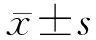
2 结 果
2.1 一般资料分析 结果(表1)显示:11例妊娠合并FⅪ缺乏症患者中有继续妊娠愿望者9例,整个孕期平均产检共(8.89±0.92)次,产检过程中每月查凝血功能及FⅪ活性共(4.78±1.30)次,均为足月妊娠。术前根据凝血功能及FⅪ活性,按体质量分别输注新鲜冰冻血浆(fresh frozen plasma,FFP)600~800 mL,共3 d,纠正凝血功能后行剖宫产术终止妊娠,术后使用氨甲环酸止血,共4 d。由于个人因素要求行负压吸宫术终止妊娠的早孕期患者2例,术前及手术当日按体质量输注FFP 800 mL纠正凝血功能后行负压吸宫术。

表1 11例妊娠合并FⅪ缺乏患者一般资料分析
2.2 凝血功能及FⅪ活性对比 结果(表2)显示:11例患者输血后APTT均恢复正常,明显短于输血前(P=0.000 0);输血后FⅪ活性及术后第1天FⅪ活性明显高于输血前FⅪ活性(P=0.000 0),输血后FⅪ活性与术后第1天差异无统计学意义。输血后PT及Fg与输血前均在孕妇正常范围内,两者差异无统计学意义。

表2 11例妊娠合并FⅪ缺乏症患者输血前后凝血功能及FⅪ活性对比
2.3 产后出血情况 9例足月妊娠患者中3例有产科指征(胎儿生长受限、瘢痕子宫、双胎妊娠),另6例由于凝血功能异常对经阴道分娩有顾虑,坚决要求剖宫产,故9例均行子宫下段横切口剖宫产术,均行椎管内麻醉,产后出血量(500.00±291.55)mL。其中1例(病例9)发生产后大出血(1 200 mL),系体外受精-胚胎移植(invitrofertilization-embryo transfer, IVF-ET)术后,双胎妊娠,于我院产检术前查FⅪ活性25.3%,APTT、PT均正常,请血液科会诊后根据体质量输注FFP 800 mL,共3 d,后行剖宫产术终止妊娠,术中出现宫缩乏力性产后出血。术中及术后予卡前列素氨丁三醇注射液(欣母沛)及麦角新碱肌肉注射,积极促宫缩治疗后好转,手术当日共输注红细胞6 U及FFP 800 mL,患者产后出血共1 200 mL,治愈后出院。产后第12天,再次阴道流血(400 mL)入院,考虑晚期产后出血,查FⅪ活性(30.4%)、APTT、PT均正常,妇科B超无特殊,即刻予积极的药物促宫缩治疗,并请血液科会诊,输入FFP 800 mL,共4 d,纠正FⅪ活性至52.3%后出血明显减少,治愈后出院。
行人工流产术患者2例,均行负压吸宫术,静脉麻醉,术中出血约10 mL,术后第2天出院。
2.4 妊娠结局 结果(表3)显示:9例足月妊娠均为活产,1例术前考虑胎儿生长受限,新生儿出生体质量1 980 g,为足月低体质量儿。所有新生儿外观正常,无畸形,Apgar新生儿初评均为10分,凝血功能均正常。

表3 11例妊娠合并FⅪ缺乏症患者的妊娠结局
2.5 随访情况 9例足月妊娠患者于产后42 d产科门诊随诊,结果为子宫复旧正常,无异常阴道流血症状,新生儿无异常临床表现。2例行人工流产术患者于术后2周妇科门诊随诊,血清β特异性人绒毛膜促性腺激素(HCG)及妇科B超未见异常,未有异常阴道流血,恢复良好。
3 讨 论
3.1 FⅪ缺乏症的诊断 FⅪ参与凝血接触激活途径,其在病理性血管内凝血中具有重要作用。FⅪ缺乏症患者体内FⅪ低于正常水平,多数患者临床表现仅为手术或者创伤后出血,虽有出血倾向,但并无自发性出血。
FⅪ缺乏症患者检测凝血功能后可发现,APTT延长,PT却处于正常范围,同时行凝血因子活性检测可确诊,FⅪ活性水平低于正常值(50%~150%),<20%则为严重缺乏症[4]。在排除FⅪ抗体和狼疮抗凝物的基础上,可通过基因突变筛查Cys482Trp的杂合突变及DNA测序等确诊疾病,还需同时排除其他出血性疾病,例如血友病A和B等[3,5]。血友病A和B的疾病特点:血管性血友病因子(vWF)无明显减少,FⅨ:C或FⅧ:C则明显降低[6]。
3.2 妊娠合并FⅪ缺乏症的孕期管理 妊娠合并FⅪ缺乏症患者早孕期的流产率(22%)与一般人群(15%~20%)相似[7]。目前并无评估其孕期出血风险的相关指标,孕妇孕期产检时凝血功能的监测次数和频率也无相关共识[8]。妊娠会加重凝血功能异常,故需严密监测患者凝血功能并观察有无出血倾向。我院将该类孕妇列为高危孕妇,与输血科共同管理,定期随诊监测孕妇的凝血功能及FⅪ活性。孕期避免外伤,避免使用影响血小板功能的药物,如阿司匹林、双嘧达莫片(潘生丁)等。
本研究11例患者中9例有继续妊娠愿望,整个孕期管理按常规产检,孕36周后每周产检1次,共产检(8.89±0.92)次,产检过程中每月查凝血功能及FⅪ活性共(4.78±1.30)次。11例患者除病例9外孕期APTT延长均大于5 s,严重者APTT大于90 s。整个围产期母儿均未发生出血。因此,本研究认为,妊娠合并FⅪ缺乏孕妇,孕期并不需特殊处理,多能顺利妊娠。但是病例9虽然凝血功能正常且FⅪ活性为25.3%(11例中FⅪ活性最高者),仍发生产后大出血及晚期产后出血,其具体原因值得仔细斟酌。
3.3 妊娠合并FⅪ缺乏症的围产期管理 FⅪ缺乏症孕妇在孕前及孕期常无明显出血表现,但仍有产后大出血的风险。分娩方式不同,分娩前预防性输血方案也不同。剖宫产术中的出血风险比自然分娩高,故对预防性输血治疗的要求更高。Myers等[9]分析33例妊娠合并FⅪ缺乏症的临床资料,发现产后出血发生率高达12%。Chi等[10]发现该类患者分娩时产后出血和晚期产后出血各占11%。Kadir等[11]研究11例FⅪ缺乏症患者妊娠情况,发现原发性产后出血发生率为15%,晚期产后出血发生率为25%。由此可见,FⅪ活性和患者孕期出血倾向无相关性,但仍是产后出血风险评估的一部分。
英国血友病中心医师组织[12]推荐,FⅪ活性小于15%的患者在剖宫产手术前或分娩发动前应接受FⅪ浓缩剂的预防性治疗,如没有FⅪ浓缩剂,可用FFP。FFP中FⅪ半衰期约45 h,一般给予7~20 mL/kg FFP, 一般治疗剂量为每天15 mL/kg,可使FⅪ活性上升到25%~50%,达到有效止血水平, 术后每天输注5 mL/kg或隔天10 mL/kg FFP直至切口愈合。我院输血科建议剖宫产手术或者经阴道分娩前每天输入FFP 15 mL/kg,共3 d,FⅪ活性达到或超过FⅪ活性参考值20%才可手术,同时建议术后持续使用抗纤溶制剂(如氨甲环酸)至阴道分娩后3 d,剖宫产术后4 d。小手术(负压吸宫术等)术前1 d及手术当日输入FFP 15 mL/kg后才可手术。
选用FFP进行替代治疗应考虑血浆中其他凝血因子水平变化也可有效止血,FⅪ活性并不是唯一参考标准。另外,FⅪ对血栓形成更重要,提高血浆FⅪ水平可能增加人类血栓性疾病的发生。鉴于血栓风险,输血等替代治疗后,应避免FⅪ活性超过70%[13]。分娩前建议行FⅪ抗体检测,若存在抗体,建议采用rⅦa联合氨甲环酸治疗,可有效预防围手术期出血合并症的发生,低剂量(15~20 μg/kg)rⅦa即可预防手术相关出血,并可降低血栓发生风险。Lynda等[7]建议妊娠合并FⅪ缺乏症时,应由多学科团队适当管理,严重的FⅪ缺乏症患者若是经阴道分娩,可能无法及时进行替代治疗而导致产后出血,故提倡选择性剖宫产[14]。
本研究9例足月妊娠患者中,3例有产科指征(胎儿生长受限、瘢痕子宫、双胎妊娠),6例由于凝血功能异常对经阴道分娩有顾虑,坚决要求剖宫产,故9例均行子宫下段横切口剖宫产术,FⅪ抗体均为阴性,术前根据凝血功能及FⅪ活性并按体质量分别输注FFP 600~800 mL,共3 d,纠正凝血功能后行剖宫产术终止妊娠,术后使用氨甲环酸止血4 d,产后出血量为(500.00±291.55)mL,与文献[15]报道的总孕妇人群剖宫产术的出血量相似。2例由于个人因素要求人工终止妊娠者行负压吸宫术,术前1 d及手术当日输注FFP 800 mL纠正凝血功能后手术,术中出血约10 mL,术后第2天出院。
3.4 妊娠合并FⅪ缺乏症的术中麻醉 Wiewel等[16]的研究提示,FⅪ缺乏症的产妇若分娩时采用椎管内镇痛或麻醉,无并发症发生。Singh等[17]也对9例FⅪ缺乏症的产妇实施椎管内麻醉(包括1例FⅪ活性仅为5%的产妇),均无并发症发生。故目前我国并未见FⅪ缺乏症产妇因使用椎管内麻醉而产生硬膜外血肿等不良事件的报道。
我院9例产妇均于椎管内麻醉后行剖宫产术,无并发症发生,也证实上述观点。故本研究认为,对于预防性输血治疗的妊娠合并FⅪ缺乏症患者,凝血功能明显改善后,若行剖宫产手术可考虑椎管内麻醉;而对于重度FⅪ缺乏症患者及产前有出血倾向患者,则应选择全麻。对选择经阴道分娩却又无法行椎管内麻醉分娩镇痛的产妇,可考虑行静脉镇痛[18]。
3.5 妊娠合并FⅪ缺乏症与产后出血的关系 妊娠期虽存在凝血因子含量增加,但针对FⅪ活性无显著性变化,且FⅪ活性高低存在与临床出血表现不符的情况——严重的FⅪ缺乏症患者术后无大出血,反而轻症的FⅪ缺乏却可出现术后大出血[10,19]。可见FⅪ活性并不能真实反映机体FⅪ的凝血功能,推断血小板中存在少量FⅪ,其对出血的影响可能比血浆中FⅪ更大,认为出血的风险更多取决于血小板中FⅪ的量,但此证据不充分[20]。另外FⅪ具有抑制纤溶的能力,FⅪ缺乏症患者纤溶亢进,会导致出血增多,故其出血的症状还与纤溶活性高的部位(例如口鼻腔、泌尿生殖系统等)相关[21]。
本研究中,病例10系IVF术后双胎妊娠,既往有腹腔镜手术后大出血病史,本次术前检查FⅪ活性为25.3%,APTT、PT均正常,术前预防性输注FFP后行剖宫产,术中发生宫缩乏力产后大出血(1 200 mL),同时于产后12 d再次出现晚期产后出血,予积极促宫缩治疗,并输入FFP纠正FⅪ活性至正常范围(约52.3%)后出血减少,治愈后出院。由此可见,无论患者的FⅪ水平如何,均应积极预防和治疗产后出血,尤其是既往有出血病史者,临床医师在积极纠正凝血功能外,更要重视宫缩的处理[16]。
3.6 妊娠合并FⅪ缺乏患者的新生儿管理 目前未有妊娠合并FⅪ缺乏症患者新生儿娩出后自发性出血的报道,也缺乏对其子代在遗传方面的研究。但本研究认为,其新生儿仍应按高危新生儿处理,尤其是剖宫手术分娩患者,需严密关注新生儿初评分。新生儿出生后应及时检查其凝血功能,甚至查FⅪ活性,若条件许可,行新生儿基因检查,同时严密监测新生儿血栓形成或出血倾向,适时血液科就诊。
研究[22]报道,由于凝血因子缺乏孕妇的新生儿肝脏组织尚未成熟,虽然凝血因子活性仅为成人的50%,但其新生儿6月龄时复查凝血因子水平可恢复至成人的80%。本研究9例足月活产儿凝血功能均正常,但由于父母均拒绝新生儿FⅪ因子监测,故无法判断是否有凝血因子缺乏。
综上所述,妊娠合并FⅪ缺乏症对产科来说,属于高危妊娠,母儿风险较大,需在产科和输血科医师协同管理下,围产期密切监测凝血功能,分娩前积极预防性输血以纠正凝血功能及FⅪ活性,尽可能减少母儿出血事件,才能够较好地保证母儿安全,获得好的妊娠结局。

