多模态MRI联合双源CT成像对甲状腺TI-RADS 4类结节鉴别诊断的临床价值
卢予婕,李文美,雷毅武,唐 成,韦明辉
(广西医科大学第一附属医院放射科,南宁 530021)
近年来,随着超声、CT、磁共振成像(MRI)、SPECT 及PET/CT 等成像方法的广泛应用,甲状腺结节的检出率显著提高。超声作为甲状腺结节的首选影像学检查方法,具有良好的可操作性和实用性。Kwak 等[1]指出TI-RADS,4 类结节恶性风险为3.3%~72.4%(4a:3.3%,4b:9.2%,4c:44.4%~72.4%),恶性风险跨度大,且超声成像对操作者的主观依赖性强,恶性特征外观有重叠导致准确性低[2,4]。因此,明确甲状腺成像报告与数据系统(TI-RADS)4类结节性质是超声诊断目前的重难点。在某些临床环境中,单一的影像学检查方法难以完成甲状腺癌的术前诊断,而CT 和MRI 能很好地评估甲状腺病变程度、局部浸润和远处转移情况,有助于完善术前检查系统,对患者的个性化治疗有很大帮助。目前鲜有在甲状腺癌术前联合MRI和CT 对甲状腺TI-RADS 4类结节进行评估的报道。故本研究将进一步探讨多模态MRI(DWI及DCE-PWI)、双源计算机断层扫描(DECT)以及两种方法联合在鉴别甲状腺TI-RADS 4 类结节中的临床应用价值,为甲状腺癌术前精准诊断提供新思路。
1 对象与方法
1.1 研究对象
选取2017 年4 月至2019 年1 月在广西医科大学第一附属医院初诊结果为TI-RADS 4类的甲状腺结节患者110例(共118个结节),行DECT和MRI检查。患者均获得病理结果,且检查前均签署知情同意书。其中男26 例,女83 例,年龄19~82 岁,平均(39.22±2.3)岁。组织病理确诊106 例,细胞病理确诊4 例,良性甲状腺结节21 个,恶性甲状腺结节97个。纳入标准:(1)符合甲状腺超声TI-RADS 4类诊断标准;(2)年龄≥18 岁;(3)无甲状腺穿刺、手术史和其他颈部手术史;(4)无造影剂过敏史。排除标准:(1)病理结果证实为甲状腺微小乳头状癌的患者。(2)未经手术或穿刺明确甲状腺结节性质者。(3)CT或者MRI检查过程中运动伪影较大的患者。
1.2 检査及操作方法
1.2.1 超声检查方法 使用LOGE9(GE Health‐care,Wauwatosa,WI,USA)诊断仪进行多普勒超声检查。
1.2.2 CT 检查方法 使用Siemens SOMATOM Definition Flash CT 进行扫描,范围为颅底至主动脉弓水平,再依据病灶大小合理扩大扫描范围。参数:A 球管管电压100 kV,管电流80 mAs;B 球管管电压Sn140 kV,双能融合系数0.4,球管转速0.28 s,螺距0.55,层间距为1.5 mm,重建层厚为1.5 mm。使用双筒高压注射器行增强扫描,流速3.0 mL/s,动脉期延迟25 s,静脉期延迟60 s。
1.2.3 磁共振检查方法 使用Siemens Verio 3.0T MRI 扫描仪,患者呈仰卧位,使用头颈联合线圈。扫描前嘱患者平静呼吸,将自制小米袋置于甲状腺两 侧。DWI 序 列:TR/TE:4 600/114 ms,FOV220 mm×220 mm,矩阵192×192,b 值0、800,激励次数10;T1-Mapping:TR/TE:7.06/3.1 ms,FOV 200×182 mm,矩阵224×143,层厚3 mm,反转角2°及15°。DCE:TR/TE:4.55/1.49 ms,翻转角90°,层厚3 mm,采集2+68 期图像,每期扫描时间为5 s,团注钆喷酸葡胺(Gd-DTPA,浓度0.5 mmol/mL),剂量0.2 mmol/kg体重,流速3 mL/s。
1.3 图像分析
1.3.1 超声诊断标准 根据TI-RADS 分类标准由超声科两位具有5年以上工作经验的超声科主治医师完成,并在不知病理学检查结果的情况下进行双盲诊断并评分。对病灶的成分、回声、形态、边缘和强回声5个征象参照ACR TI-RADS[3]相应的评分。
1.3.2 CT 和MRI 诊断 由2 位放射科头颈组主治医师完成。DECT 判定标准:甲状腺结节密度、形态、边界、钙化情况、强化方式、出血坏死囊变情况以及颈部淋巴结转移情况,联合结节碘含量、能谱曲线斜率来分辨其良恶性。MRI 判断标准:结节形态(类圆、分叶、不规则)、大小、边界(清晰或模糊)、平扫信号(正常甲状腺组织信号为参照)、强化方式(DCE—PWI 早期以及晚期强化方式和程度)、假包膜(延迟期)、淋巴结转移情况,再结合DWI 及ADC值以及灌注曲线类型(上升、平台或流出型)进行综合判断。结果意见一致时,即为最终诊断;意见不一致时,讨论得到最终诊断。
1.4 统计学方法
采用SPSS 25.0 统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以百分率(%)表示,组间比较采用配对χ²检验。对比不同方法的诊断效能,绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC),以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤的病理类型及病灶大小
纳入甲状腺结节共118 个,其中16 个良性结节为结节性甲状腺(16/21),90个恶性结节为乳头状甲状腺癌(90/97),见表1。
表1 肿瘤的病理类型及病灶大小 ±s
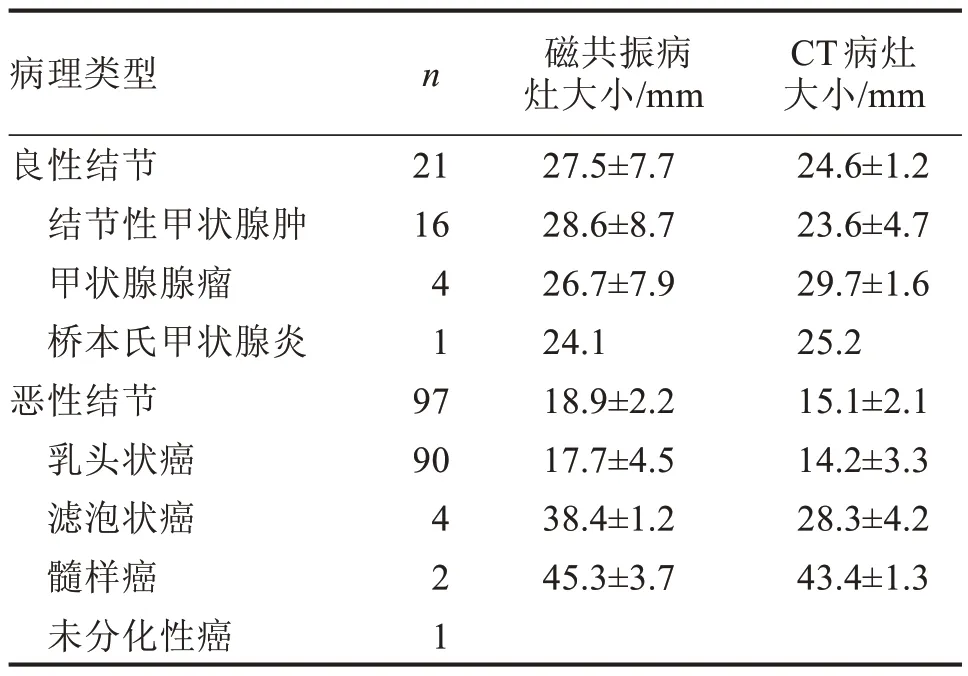
表1 肿瘤的病理类型及病灶大小 ±s
2.2 甲状腺结节的TI-RADS 分类与病理结果的关系,见表2、图1~图3。

表2 甲状腺T1-RADS 4类结节与病理结果的关系 n
2.2 DECT 与MRI 两种方法诊断效能比较及ROC曲线分析
MRI 对甲状腺TI-RADS 4 类结节恶性检出率优于DECT(P<0.01),见表3。
以病理结果为金标准,MRI、DECT 及二者联合诊断TI-RADS 4 类结节的ROC 曲线分析结果,见图4,两个方法联合诊断的AUC 最大(0.815±0.050),诊断效能最高,约登指数为0.63,敏感度为84.4%,特异度为78.6%,阳性似然比为3.94,阴性似然比为0.20,优于MRI单独诊断的灵敏度73.3%,特异度71.43%,阳性似然比2.57,阴性似然比0.37。联合诊断的AUC 与MRI(Z=2.316,P=0.020)、DECT(Z=3.781,P=0.0002)比较,差异有统计学意义。

图1 TI-RADS 4A类结节的超声、DECT、MRI表现
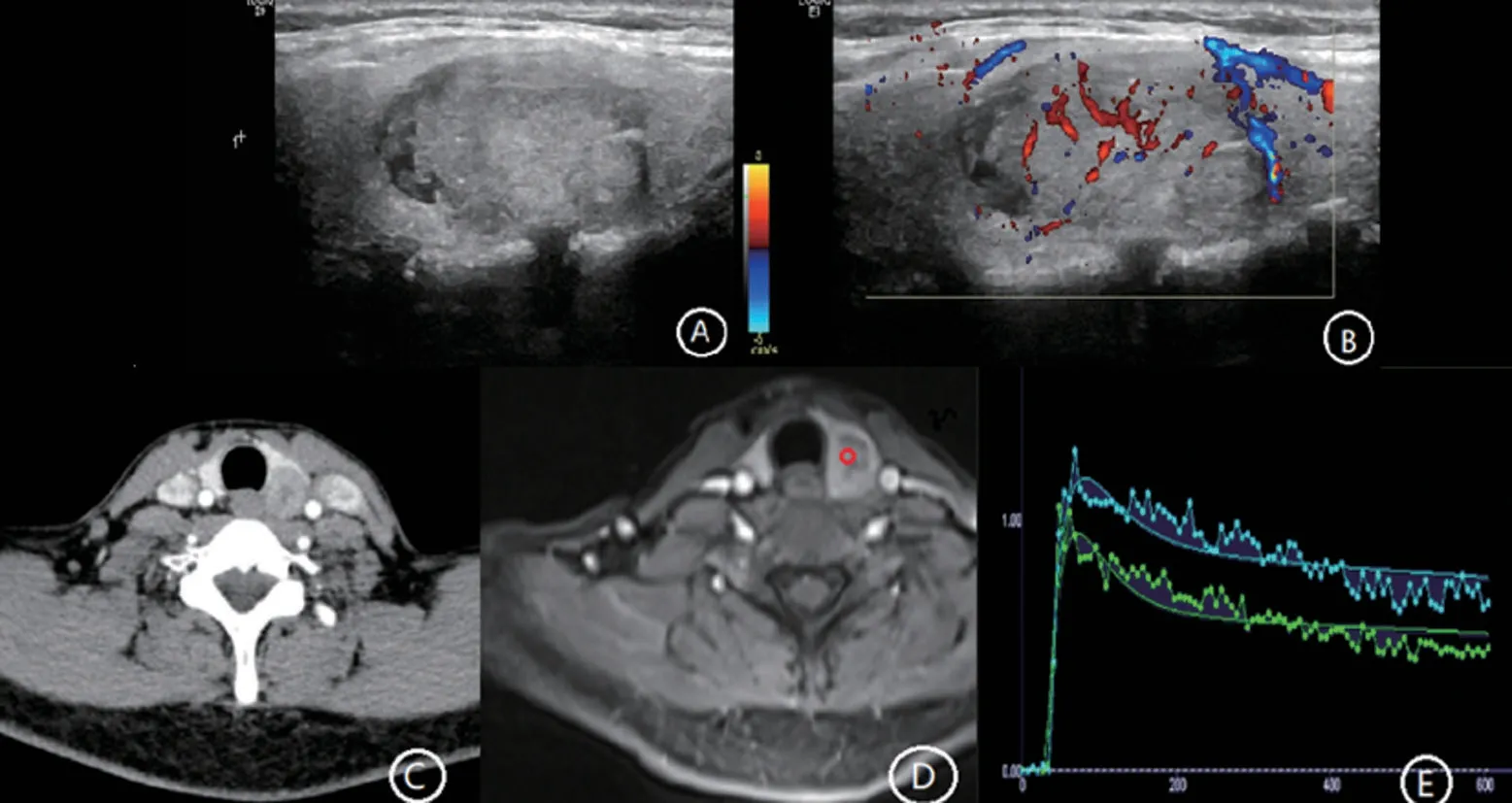
图2 TI-RADS 4B类结节的超声、DECT、MRI表现
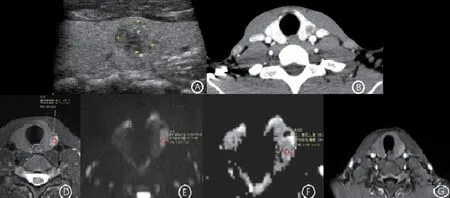
图3 TI-RADS 4C类结节的超声、DECT、MRI表现

表3 各方法的诊断效能比较

图4 MRI、DECT 及二者联合诊断TI-RADS 4 类甲状腺结节的ROC曲线图
3 讨论
甲状腺结节是迄今为止最常见的内分泌系统疾病,而治疗必须评估恶性的级别与风险。在临床上,超声被用作评估的第一步,然而没有明确超声标准被证明能够准确区分良性结节和恶性结节[4]。随着影像技术的发展,CT 和MRI 在甲状腺恶性肿瘤的术前分期和术后评估中发挥着越来越重要的作用[5-6]。DECT 可明确肿瘤软组织边界和关键结构的侵袭,且DECT 扫描的附加和定量信息(如λHU,IC和NIC)可用于更高级的组织特征描述[7]。从病理生理学角度来看,甲状腺结节代表细胞(通常但并不总是甲状腺细胞)的异常生长,与良性结节相比,恶性甲状腺结节具有更大的细胞核、更密集的基质和更高的细胞计数,导致细胞数量增加和细胞外空间减少[2,4],MRI 可以反映这些细胞内外的变化。超声检查中TI-RADS 4 类结节的恶性跨度最大,明确其性质对于医生的后续治疗和患者的生存至关重要。一般来说,大于1 cm 的结节更可能是恶性结节[6,8],且出于不利的成本或效益的考虑[2]和分辨率问题,本实验排除了小于1 cm的结节。
在超声TI-RADS 分类的基础上,本研究采用DECT 和MRI 两种方法对4 类结节性质进行进一步评估。DECT 在两个不同的峰值能量水平上同时或几乎同时进行采集,生成不同的虚拟单色图像(VMI)。基于碘的强光电效应,低能量VMI 可评估增强病变(如肿瘤)性质[9],这是传统CT 无法比拟的。一些研究证明,使用DECT 进行体内定量评估显示了甲状腺良恶性病变之间的显著差异[9-11],很可能是因为正常滤泡上皮细胞的细胞膜中含有碘转运蛋白,因此可以预测恶性甲状腺结节中碘的含量较低,在单色图像上的衰减比良性甲状腺结节低[10]。钙化是甲状腺良恶性结节中的常见现象,但在钙化结节的术前超声诊断中,有一半以上的结节是无钙化的,而钙化结节的术前CT 诊断通常与病理相符[11]。另一方面,超声对鉴别钙化的特异性较低,同时对微钙化的识别能力有限,因此在超声中的应用有一定的局限性[12-13]。研究表明,CT 鉴别孤立的甲状腺钙化结节的敏感性比超声、MRI 更高[13-14]。但部分容积效应会影响微小钙化的显示,且CT 软组织分辨率较低,这都可能导致CT 对甲状腺TI-RADS 4类结节的恶性检出率降低。这也可对本实验中MRI 对甲状腺TI-RADS 类结节的恶性检出率优于DECT这一结论做出合理解释。
磁共振成像软组织分辨率高,能较好地显示小病灶和肿瘤的浸润范围,且能提供病变形态学信息,这些优势奠定了MRI 在甲状腺的影像学检查中的位置。弥散加权成像(DWI)是目前应用于临床唯一一种在分子水平成像的MRI 技术[15],水分子在恶性肿瘤中的扩散受到限制,导致表观扩散系数(ADC)降低,ADC的这种差异有助于良恶性肿瘤的鉴别。正常情况下甲状腺的血管分布丰富,一旦发生病理改变,甲状腺球蛋白水平、血管通透性和灌注情况都会发生相应改变,因此会出现不同的时间强度曲线(TIC 曲线)类型,故TIC 曲线类型有助于术前判断癌细胞的增殖能力和肿瘤分化程度[16]。然而,MRI 检查也存在不足之处:甲状腺结节内的囊变、坏死、出血以及结节内钙化都会影响最终的结果判断。在本实验中,在量化DECT+MRI 中把TIRADS 4类中病理恶性结节误判成良性的为14个结节,远低于DECT 的51,大大降低了恶性结节的漏诊率。因此,MRI 联合DECT 诊断对甲状腺TIRADS 4类结节有更高的敏感性和特异性。
综上所述,与DECT 相比,MRI 对甲状腺TIRADS 4 类结节的恶性检出率更高。MRI 联合DECT 对鉴别诊断甲状腺TI-RADS 4 类结节具有更高的敏感度和特异度,对鉴别甲状腺TI-RADS 4 类结节有临床价值,对患者的个性化治疗有帮助。
- 广西医科大学学报的其它文章
- Effect of miR-200a-3p targeting transthyretin(TTR)on the biological behavior of placental trophoblasts in hypertensive disorder complicating pregnancy
- 沙利度胺对重型β地中海贫血患者红系细胞γ珠蛋白基因表达及分化的作用研究*
- CEMIP调控Src/AKT/STAT3信号通路对非小细胞肺癌上皮间质转化及细胞侵袭、迁移的影响*
- 乳铁蛋白对正畸复发移动过程中牙周改建的影响*
- 秦皮苷对脂多糖诱导的软骨细胞氧化应激和炎症因子的影响*
- miR-133b-3p对大鼠脑缺血/再灌注损伤的影响及其作用机制*

