基于网络药理学探讨牛大力治疗抑郁症的活性成分及分子机制*
郭 玥,王倩怡,莫祎祎,宋 慧,梁永红,苏志恒
(广西医科大学药学院,南宁 530021)
抑郁症又称抑郁障碍症,其临床症状表现为情绪低落,意志减退、躯体障碍、悲观厌世等,严重者可能出现自杀倾向并付诸行动[1]。世界卫生组织调查发现,全球抑郁症患者已达3.22 亿,中国抑郁症患病率约4.2%[2]。近年来,抑郁症的患病年龄呈下降趋势,越来越多的青少年罹患此症,目前临床常用的抗抑郁药物如三环类抗抑郁药(TCAs)、单胺氧化酶抑制剂(MAOIs)等均可控制症状,但该药物具有依从性和多种副作用(如依赖责任、精神运动障碍)。牛大力,为豆科蝶形花亚科崖豆藤属植物美丽崖豆藤Millettia speciosaChamp.的干燥根,味甘性平,具补虚润肺、强筋活络之效[3-4]。牛大力主要分布于广东、广西等地,常用于制作药膳、药酒等[5-10],为岭南地区著名的药食两用植物[11]。现代药理研究表明,牛大力具有提高免疫功能、保肝、祛痰、镇咳、平喘、抗氧化、抗炎、抗肿瘤以及抗应激等作用[12-14]。课题组前期也有研究过牛大力与其提取物在抗抑郁上的应用[15],但目前,牛大力治疗抑郁症的作用机制未见有相关报道。因此,本研究通过网络药理学的研究方法预测了牛大力治疗抑郁症的潜在活性成分以及作用靶点。网络药理学是基于系统生物学理论,通过选取特定信号节点来进行多成分、多靶点药物分子设计的新学科,本研究旨在从牛大力中筛选出与治疗抑郁症相关的潜在活性成分,并预测这些成分的关键靶点及相关的信号通路,为牛大力治疗抑郁症机制的研究奠定了理论基础。
1 材料与方法
1.1 牛大力活性成分的筛选与检索 在中药系统药理学数据库与分析平台(TCMSP 2.3,http://tc‐mspw.com)以“牛大力”为关键词进行检索,筛选标准:口服生物利用度(OB) ≥30%和类药性(DL) ≥0.18;同时查阅文献,检索和收集牛大力的活性成分信息,去除不明确的成分[16-19]。
1.2 牛大力活性成分靶点的预测 在PubChem(https://pubchem.ncbi.nlm.nih.gov,2020-08-15)数据库中查找牛大力活性成分的SMILES 格式并保存,并将其导入Swiss Target Prediction(http://www.swis‐stargetprediction.ch,2020-08-17)数据库以SMILES文件为模板进行靶点预测,选择物种为大鼠,保存导出的结果并删除可能性<0 的靶点,得到最终的活性成分靶点。
1.3 抑郁症相关靶点的预测和整理 利用Gene Cards 5.0(https://www.genecards.org/)对抑郁症相关靶点进行检索,在数据库中以“depression”为关键词检索,收集score≥10 的靶点信息进而获得最终的疾病相关靶点。
1.4 活性成分-靶点-疾病网络的构建 利用韦恩图筛选出成分-疾病共靶点,再将活性成分和疾病的共有靶点导入Cytoscape3.2.1 软件中构建活性成分-靶点-疾病网络结构图。该网络结构图中节点表示靶点,节点连线越多,连接的度值(degree)越大,说明这个节点在其中的作用越重要,因此本研究通过度值、介度等指标进一步评价了牛大力中较为重要的成分与作用靶点。
1.5 靶蛋白互作网络的构建 将共有靶点导入String(http://stitch.embl.de,2020-08-29)数据库,限定物种为大鼠,将结果以tsv 格式导出,筛选结合率评分(combined score)≥0.7的作用靶点蛋白,并导入Cytoscape3.2.1 软件构建PPI 图,计算度(degree)、介度(betweenness)和紧密度(closeness)3 个拓扑学参数。
1.6 富集分析 按度、介度和紧密度≥其中位数的筛选标准[20],将筛选得到的核心蛋白导入DAVID(https://david.ncifcrf.gov,2020-09-02)数据库,选择官方基因名,限定物种为大鼠,对牛大力作用靶点进行基因本体(GO)和KEGG 通路分析,以P<0.05为选择标准,从而分析牛大力主要涉及的KEGG 通路及生物过程。
1.7 分子对接 分子对接技术模拟小分子配体与受体大分子相互作用,并找到其最佳的结合模式。核心蛋白ID 从RCSB PDB(http://www.rcsb.org/,2020-09-15)数据库中检索下载,活性化合物的结构从PubChem 数据库中获得并转化为mol2 格式。利用Surflex-Dock 工具进行分子对接,了解蛋白质与活性化合物的结合方式。
2 结果
2.1 活性成分的筛选 结合TCMSP 数据库及文献检索共得到43 个牛大力活性成分,见表1,其中前10 个化学成分由TCMSP 数据库筛选得到;后33 个化学成分由查阅文献得到。

表1 牛大力活性成分
2.2 牛大力活性成分靶点的预测 SwissTargetPre‐diction 数据库得到成分预测靶点250 个;GeneCards数据可得到抑郁症预测靶点557个,见图1A。
2.3 活性成分-靶点-疾病网络的构建 经过韦恩图筛选后得到53 个共有靶点,将共靶点导入Cy‐toscape3.2.1得到网络结构图,见图1。图1 B中共有98 个节点,其中有53 个靶点节点,43 个活性成分节点,1个牛大力节点,1个抑郁症疾病节点,并构成了285条相互作用关系。
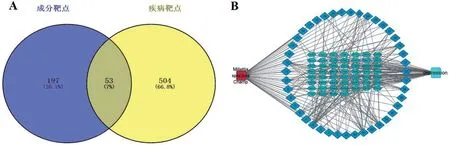
图1 活性成分-靶点-疾病网络
2.4 靶蛋白互作网络的构建 将String数据库结果进行筛选得到42 个作用靶点蛋白,并导入Cyto‐scape3.2.1 软件得到蛋白互作图,见图2。该网络共有42 个节点,构成164 个相互作用的线段,其中度值≥9.5,介度≥0.012 705 43,紧密度≥0.455 555 56的核心蛋白共有10个,提示牛大力治疗抑郁症的药理作用可能通过以上靶点起治疗作用。其拓扑性质见表2。

图2 蛋白互作网络图

表2 牛大力治疗抑郁症的关键靶点及拓扑性质
2.5 富集分析 GO 分析生物过程(BP),分子功能(MF)和细胞组分(CC);经过筛选后富集到38 个BP(图3 A),包括监管行为(regulation of behavior)、多巴胺分泌调节(regulation of dopamine secretion)、隔绝钙离子释放到细胞质(release of sequestered calci‐um ion into cytosol)、对可卡因反应(response to co‐caine)、突触传递负调控(negative regulation of syn‐aptic transmission)、谷氨酸(glutamatergic)等;8个MF(图3 B)包括药物绑定(drug binding)、5-羟色胺绑定(serotonin binding)、神经递质受体的活动(neu‐rotransmitter receptor activity)、G-蛋白偶联血清素受体活性(G-protein coupled serotonin receptor activi‐ty)、蛋白结合(protein binding)、Gi/Go 耦合多巴胺神经递质受体活动(dopamine neurotransmitter receptor activity,coupled via Gi/Go)等;5个CC(图3 C),包括原生质膜的组成部分(an integral component of plas‐ma membrane)、树突(dendrite)、轴突(axon)等。
KEGG 通路富集到4 条通路,见图3D,主要包括神经活动配体-受体相互作用通路(Neuroactive ligand-receptor interaction)、含血清素的神经突触(Serotonergic synapse)、CAMP 信号通路(cAMP sig‐naling pathway)、间隙连接(Gap junction)。
2.6 分子对接 将核心蛋白与其相对应的活性成分进行分子对接,对接结果见表3和图4。成分与靶点的对接得分和氢键的数量是评价其结合能力的重要指标,对接得分>5.0表明蛋白与成分有较好的结合能力,对接得分>7.0表明蛋白与活性成分结合能力较强[21]。
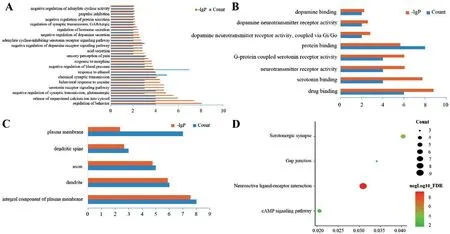
图3 富集分析图

表3 活性成分与靶点蛋白分子对接得分表
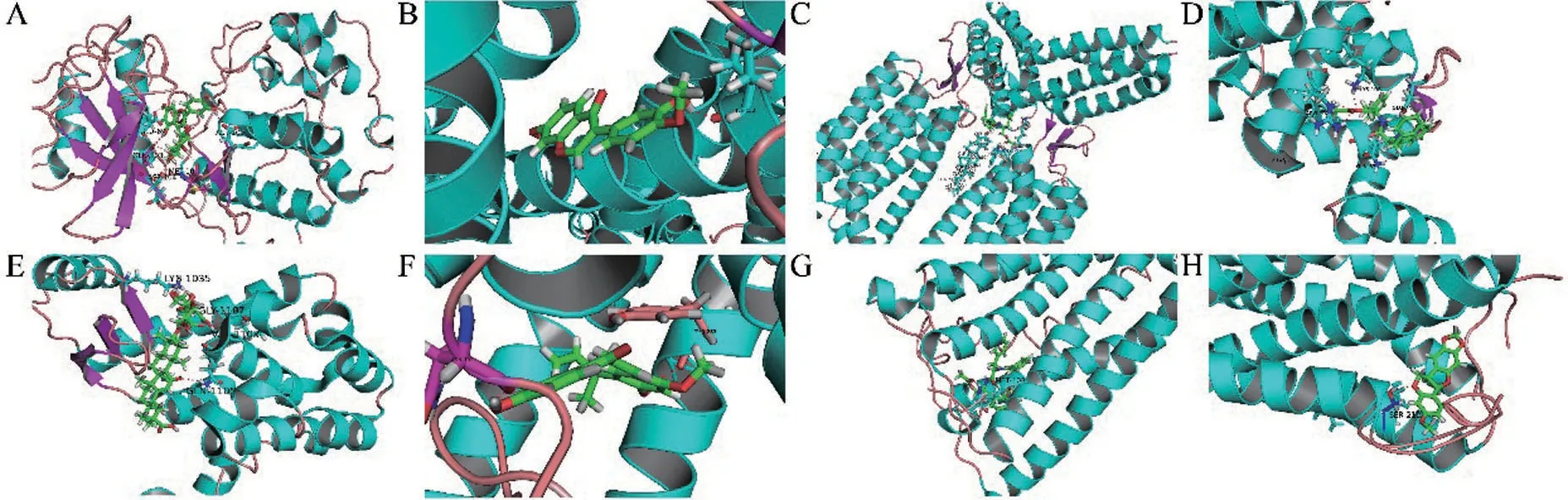
图4 活性成分与核心靶点对接示意图
3 讨论
本研究利用网络药理学的研究策略,对牛大力治疗抑郁症的主要成分、靶点和潜在的作用机制进行分析。由图2 可知,牛大力中2,2-二甲基-3-(3,7,12,16,20-五甲基-3,7,11,15,19-二十一碳五烯基)-环氧乙烷化学成分连接节点最多,在分子对接中得分也较高,但目前并未有文献报道其有治疗抑郁症的疗效。而补骨脂二氢黄酮、甘草酸、甘草素等化学成分可能是治疗抑郁症的主要药效成分,其中补骨脂二氢黄酮具抗肿瘤、抗氧化、抗菌、抗炎、抗抑郁的药理作用[22];甘草酸,甘草素具有抗氧化、抗凋亡损伤,抗单胺氧化酶、调节单胺神经递质等药理作用,进而发挥治疗抑郁症的疗效[23]。
通过蛋白互作网络分析,筛选得到大麻素Cnr1、5-羟色胺1b 受体(Htr1b)、Htr1d、Drd3 等10 个核心靶点蛋白,这些蛋白共同参与调控抑郁症的治疗。Cnr1 可以影响抑郁症的代谢,调节神经递质的释放而起到调节抑郁症的作用[24-25]。Htr1b、Htr1d是5-羟色胺受体的其中2 种,5-羟色胺(5-HT)是一类重要的单胺类神经递质,5-HT 受体可以调控HPA轴起到缓解抑郁症的作用,而5-HT的前体物质是色氨酸(TRP),TRP 是人体必需氨基酸之一,对中枢神经系统中的5-HT 在神经元和突触可塑性发挥着重要的作用[26-27]。Drd3 是多巴胺受体的一个亚型,已有研究表明,D3受体可能与大脑认知和性感活动有关[28]。Song 等[29]对小鼠的研究可知,D3 缺失将导致细胞为DA 水平升高以及对可卡因的敏感性增强;Leggio 等[30]在进行强迫游泳实验发现,D3 受体缺失小鼠对抗抑郁药物的作用更为敏感,由此表明DA对抑郁症的治疗有一定的疗效。
通过富集分析可得多巴胺分泌调节、对可卡因反应、突触传递负调控、5-羟色胺绑定、神经递质受体活动、Gi/Go 耦合多巴胺神经递质受体活动、含血清素的神经突触、CAMP 信号等相关通路,这些通路都与抑郁症的治疗机制相关联。神经发生障碍是抑郁症产生的关键病理机制。神经系统受体-配体通路、CAMP 信号通路与神经调节相关,在CAMP-PKA-CREB-BDNF 通路中,多种神经递质与G 蛋白偶联受体结合之后使CAMP 含量增高,从而调节转录因子活性介导细胞对外界的刺激[31]。
从分子对接结果可以看出,Cnr1 与金色酰胺醇酯有强烈的结合能力,金色酰胺醇酯具有抗炎作用[32],可能通过抗炎作用发挥治疗抑郁症作用;Drd3与甘草酸有较好的结合能力,蛋白与分子之间结合有4 个氢键,甘草酸通过调节验证水平因子发挥抗抑郁作用[33]。促性腺激素释放Gnrhr 与甘草查尔酮A、补骨脂二氢黄酮结合能力较好,均有氢键结合,甘草查尔酮A、补骨脂二氢黄酮属于黄酮类化合物,具有抗炎、抗抑郁作用[22];App 与双去氧基姜黄素、异槲皮素、槲皮素强烈结合,双去氧基姜黄素属于姜黄素类成分,姜黄素具有抗氧化、抗炎作用[34-35],由此推测其可能通过抗氧化自由基和调节皮质类固醇的活性而发挥治疗抑郁症的作用,其中与异槲皮素有8个氢键结合,异槲皮素、槲皮素可能通过调节升高5-HT、多巴胺、去甲肾上腺素的浓度而产生抗抑郁作用,也可以调节下丘脑-垂体-肾上腺皮质(HPA) 轴的应激应答反应来发挥其治疗抑郁症的疗效[36]。而亚麻酸乙酯、邻苯二甲酸二辛酯虽对接得分较高,但目前未见有相关文献报道其具有抗抑郁作用。
综上所述,本次研究采用网络药学的方法对牛大力治疗抑郁症的作用机制进行分析。牛大力和抑郁症预测到53 个共有靶点,经筛选得到大麻素Cnr1、Htr1b 等10 个关键靶点。这些核心蛋白经KEGG 通路富集,预测出牛大力可能是刺激神经组织,调节CAMP 信号通路、神经递质受体活动而发挥抗抑郁症作用,这体现了牛大力多成分、多靶点、多通路的特点。分子对接的结果也进一步说明了牛大力的主要活性成分与关键的靶点蛋白有很好的结合活性,为牛大力治疗抑郁症的研究提供了理论依据。本研究的不足之处在于网络药理学只是预测药理作用的一种方法,虽然在中药研究方面已经开始逐渐应用,但目前计算机结果还不能取代实验数据,因此还需要动物实验加以验证。
- 广西医科大学学报的其它文章
- Effect of miR-200a-3p targeting transthyretin(TTR)on the biological behavior of placental trophoblasts in hypertensive disorder complicating pregnancy
- 沙利度胺对重型β地中海贫血患者红系细胞γ珠蛋白基因表达及分化的作用研究*
- CEMIP调控Src/AKT/STAT3信号通路对非小细胞肺癌上皮间质转化及细胞侵袭、迁移的影响*
- 乳铁蛋白对正畸复发移动过程中牙周改建的影响*
- 秦皮苷对脂多糖诱导的软骨细胞氧化应激和炎症因子的影响*
- miR-133b-3p对大鼠脑缺血/再灌注损伤的影响及其作用机制*

