重组禽流感病毒三价灭活疫苗对鹅的免疫效果评估试验
肖 杰,陈金仙
(广东永顺生物制药股份有限公司,广东 广州 511356)
高致病性禽流感(Highly pathogenic avian influenza,HPAI)是由正粘病毒科A型流感病毒中的H5或H7亚型禽流感病毒引起的一种全身性或呼吸性的传染病,属于人畜共患病,被世界动物卫生组织规定为必须报告的动物疫病,我国将其列为一类动物疫病[1],常导致感染的家禽群体全部覆灭,甚至是感染人类后导致人的死亡,对家禽养殖业造成严重的经济损失和危害人类的健康,而禽流感灭活疫苗是防控该病的关键所在[2]。预防和控制禽流感最有效的手段就是免疫接种,目前我国用于禽流感H9N2防控的疫苗多为灭活疫苗,所采用的佐剂多数为注射用矿物白油佐剂。免疫佐剂是指与抗原同时或先于抗原使用,能增强机体针对抗原的免疫应答能力或改变免疫反应类型的物质[3],而白油佐剂是目前兽用佐剂使用最为广泛的佐剂。主要由矿物油、Span-80与硬脂酸铝加热溶解后形成的淡黄色油状液体,与抗原乳化成W/O型乳液。它可以延缓免疫原在机体内的存留时间,使之持续缓慢释放,增强巨噬细胞的吞噬能力。目前,白油Span佐剂虽然存在矿物油不可代谢的一些副作用,但由于出色的免疫效果,以及成本优势,在兽用佐剂中无可替代。油乳剂灭活疫苗由于其具有完整的免疫原性和无毒力返祖现象,并且具有免疫效力高,使用安全,持续时间长等优势,受到了广大养殖户的青睐。因此,注射用矿物白油作为一种佐剂被广泛地应用于禽用灭活疫苗生产中。但是,不同厂家生产的注射用矿物白油佐剂黏度和纯度等质量不一,其应激、免疫吸收和抗体消长效果差异较大,直接影响着疫苗的免疫效果[4]。因而选择佐剂时不仅要考虑其免疫促进作用,也要兼顾佐剂的安全性及佐剂与抗原适当比例配制后疫苗的黏度、稳定性等是否符合要求[5]。矿物白油佐剂在兽用灭活疫苗上的应用研究开始于上世纪80年代,对预防控制畜禽重大疫病的传播起到重要作用[6]。注射用矿物白油,其配制的灭活疫苗的共性问题是:如果注射用矿物白油的运动黏度系数高,则制备的灭活疫苗在免疫注射过程中出现黏稠度较大、注射困难、毒副反应较强(过敏)、引起注射部位红肿、化脓、吸收慢、残留量高,导致免疫动物生产和生长发育性能显著下降等现象;运动黏度系数过低,则制备的灭活疫苗在免疫注射过程中出现黏稠度较小、吸收过快、毒副反应较强(过敏),黏度过高过低均会引起大的应激问题,其本质与矿物白油佐剂的内在质量相关[7]。
为提高禽流感灭活疫苗的质量水平,本试验采用了三种不同白油配制的禽流感灭活疫苗对肉鹅进行免疫效果综合评估试验,为禽流感灭活疫苗选择合适的白油来配苗和对鹅的免疫方式提供实验数据支持。
1 试验材料
1.1试验动物 广东省广州市花都区红领巾农场养殖的同批次60日龄的鹅,共100羽进行免疫试验。
1.2试验疫苗 由广东永顺生物制药股份有限公司生产的三批试验疫苗,每批试验疫苗均采用不同的白油佐剂进行配制,疫苗分别为试2020004批,试2020005批和试2020006批三批试验疫苗。分别编为A、B、C三组对鹅进行免疫。三组试验疫苗使用的白油佐剂占比如表1。

表1 A、B、C三组苗白油佐剂占比
1.3检验试剂 H5N1Re-11标准抗原(批号:20180823)、 H5N1Re-12标准抗原(批号:20180823)、H7N9H7-Re2标准抗原(批号:20180823)、H5N1Re-11标准抗病毒血清(批号2019004)、H5N1Re-12标准抗病毒血清(批号2019004)和H7N9H7-Re2标准抗病毒血清(批号2019004)均购置于哈尔滨维科生物技术开发公司。
健康公鸡心脏血(无AI抗体),配制洗涤用的1%红细胞悬液,由广东永顺生物制药有限公司生物实验室制备。
2 试验方法
2.1试验动物分组 把100羽60日龄的鹅随机分成10组,平均每组10羽。用疫苗A、B、C对三组鹅分别进行腿部肌肉注射,注射剂量为1 mL/羽,注射完毕后,将这三组鹅分别对应编组为A1、B1、C1,同理,对进行胸部肌肉注射的三组鹅分别对应编组为A2、B2、C2;进行颈部皮下注射的三组鹅分别对应编组为A3、B3、C3。最后一组鹅则注射1 mL的生理盐水作为对照组。
2.2临床观察 对注射疫苗后鹅的表现状况进行观察,并详细记录鹅的饮食状况、精神状况、有无免疫反应副作用等。
2.3样品采集
2.3.1在免疫前随机抽取30羽鹅进行采血分离血清测定免疫前的HI抗体,并称重计算每组鹅的平均体重。
2.3.2分别在免疫后21 d、28 d和35 d对每组鹅进行称重并计算平均重和均增重,然后对每组鹅进行采血,分离血清测定HI抗体,同时每组每次取2羽鹅剖检观察注射部位的疫苗吸收状况。
3 试验结果
3.1免疫后鹅的死亡情况见表2。

表2 免疫后鹅的死亡情况
三组疫苗在腿部肌肉注射后的存活率均为100%,A、B疫苗在胸部和颈部肌肉注射的存活率分别为100%、100%、而C疫苗在胸部和颈部肌肉注射的存活率均为90%。
3.2免疫后增重见表3。
结果表明,各免疫组与对照组的体重增长基本无太大的差距,注射疫苗后疫苗接种组和没有接种疫苗组鹅群的精神状态无显著差异(P>0.05),免疫鹅精神食欲良好,无不良反映。
不同白油佐剂制备的疫苗在“腿部肌肉注射”的增重排序B1>C1>A1;不同白油佐剂制备的疫苗在“胸部肌肉注射”的增重排序A2>C2>B2;不同白油佐剂制备的疫苗在“颈部皮下注射”的增重排序C3>B3>A3;其中B2组的鹅在免后21 d状态不佳,部分鹅有呕吐粘液,所以B2组的鹅体重增长最差。

表3 免疫后鹅的增重情况
3.3鹅血清HI-GMT(nlog2)抗体结果统计见表4和图1。
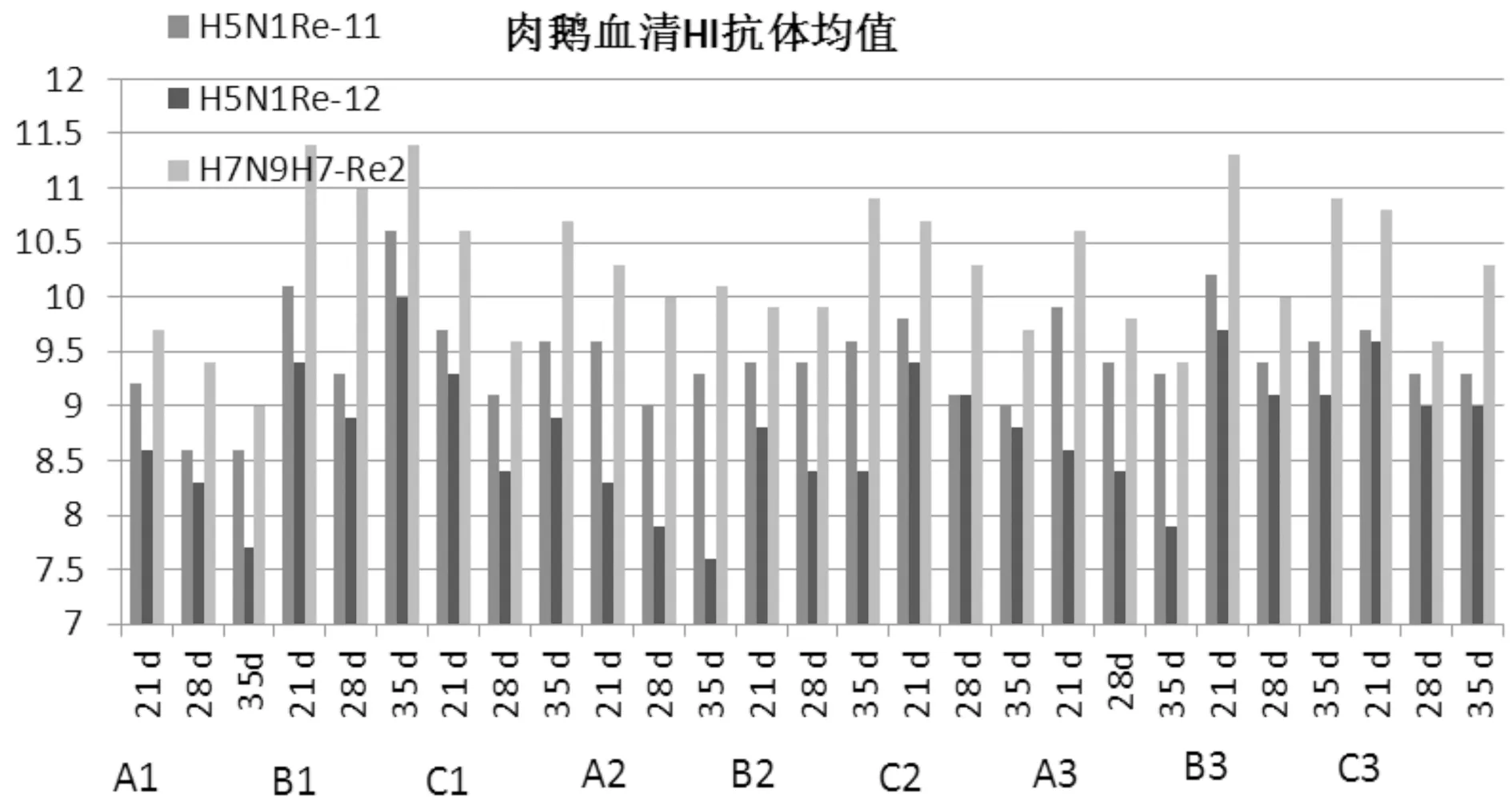
图1 A、B、C三组试验苗免疫后鹅血清HI-GMT抗体变化
肉鹅在免疫前,H5N1Re-11、H5N1Re-12、H7N9H7-Re2几何平均抗体滴度均达到4log2 以上,说明这批试验肉鹅有着比较强的母源性抗体。对禽流感疫苗免疫肉鹅21 d后,H5N1Re-11、H5N1Re-12、H7N9H7-Re2的几何平均抗体滴度均达到6log2 以上,符合中华人民共和国重组禽流感病毒(H5+H7)三价灭活疫苗(H5N1Re-11株+Re-12株,H7N9 H7-Re2株)制造及检验试行规程的要求。
在整个免疫期,三种抗体水平综合评估由高到低分别是:B>C>A。不同免疫途径的抗体水平由高到低分别是:颈部皮下注射>腿部肌肉注射>胸部肌肉注射。

表4 免疫后鹅血清HI-GMT抗体水平

图2 免疫21 d后颈部皮下、腿部肌肉和胸部肌肉(自左至右)解剖情况
3.4解剖观察疫苗的吸收情况 免后21 d,颈部皮下和腿部肌肉有少量疫苗残留,而胸部肌肉基本无疫苗残留;免疫28 d后均无疫苗残留痕迹。
4 讨论
试验结果表明三种白油佐剂制备的重组禽流感病毒(H5+H7)三价灭活疫苗安全性和免疫效果都很好。肉鹅对疫苗的吸收从优到差分别是:A>B>C;不同免疫途径肉鹅对疫苗的吸收从优到差分别是:胸部肌肉注射>腿部肌肉注射>颈部皮下注射。肉鹅免疫后存活率从高到低分别是:B=A>C;不同免疫途径肉鹅免疫后存活率从高到低分别是:腿部肌肉注射>胸部肌肉注射=颈部皮下注射。疫苗使肉鹅产生HI抗体水平整体由高到低为:B>C>A。不同免疫途径肉鹅免疫后产生HI抗体水平从高到低分别是:颈部皮下注射>腿部肌肉注射>胸部肌肉注射。
综合评估B组(试2020005批)疫苗即使用100%道达尔EOLANE150:D3901F29白油佐剂制备的重组禽流感病毒(H5+H7)三价灭活疫苗对肉鹅的安全性和免疫效果最好,且最优的免疫途径颈部皮下注射能更好地使肉鹅产生更高滴度的HI抗体和降低肉鹅对疫苗产生的免疫副反应。

