过敏性紫癜不同临床表型患儿肠道菌群的差异分析
唐兴珈 傅 睿 李 群 刘小青 胡少凡
(江西省儿童医院南昌大学附属儿童医院肾内科,南昌 330006)
过敏性紫癜(Henoch-Schönlein Purpura,HSP)是一种由IgA介导的以全身小血管炎症为主的变态反应性疾病,常表现为皮疹、腹痛、关节肿痛、血尿、蛋白尿等,可累及多个脏器,引起消化道出血、肾脏损伤等,严重影响患儿健康[1-2]。研究发现,肠道菌群紊乱参与狼疮性肾炎、支气管哮喘、新生儿湿疹等免疫相关性疾病发病过程,但肠道菌群与HSP,尤其是肾型HSP的发病机制是否相关尚不清楚[3-5]。本研究采用16S rRNA 测序技术,检测HSP不同临床表型患儿肠道菌群结构及多样性差异,现报道如下。
1 资料与方法
1.1资料
1.1.1研究对象 收集2018年5月至2019年5月江西省儿童医院初次就诊且诊断为HSP的患儿共30例为观察组,其中单纯紫癜型(B组)、消化道出血型(C组)、肾脏损伤型(D组)患儿各10例,招募同期年龄、性别与HSP患儿相匹配的健康儿童为对照组(A组)。
1.1.2纳入标准 HSP诊断标准符合2010年EULAR/PRINTO/PRES共同制定的诊断标准[6]。排除标准:①粪便采集前2个星期内接受过抗生素、微生态制剂、免疫抑制剂、激素治疗;②患有精神疾病或原发性免疫缺陷病者;③合并其他系统基础疾病者。
1.2方法
1.2.1粪便标本及血液收集 收集所有受试者粪便入院后第1次大便并立即置于-80℃冻存,取清晨空腹静脉血 5 ml,室温静置20 min,3 000 r/min离心10 min,收集血清-20℃保存待用。
1.2.2DNA提取 采用粪便DNA快速提取试剂盒进行粪便基因组DNA提取,按照试剂盒说明书操作。
1.2.3DNA 16S rRNA V4区检测 对DNA 16S rRNA进行高通量测序,高通量测序及测序文库构建由华大基因检测中心完成。
1.2.4生物信息学分析 通常将相似度在97%以上的序列聚类作为1个操作分类单元(operational taxonomic units,OTU),采用OTU的Venn图分析得到各组样品OTU数,Venn图展示多组样品共有和特有OTU数,直观展示各组样品间 OTU 重叠情况,结合OTU所代表的物种找出不同研究个体的核心微生物。Alpha多样性是对单个样品中物种多样性的分析,如shannon指数可反映群落多样性,受群落中物种丰度和均匀度的影响,相同丰度群落中各物种均匀度较大则认为群落具有多样性。
1.2.5临床指标检测 采用IL-6、IL-8、IL-10 ELISA试剂盒检测血清IL-6、IL-8、IL-10水平,采用全自动免疫化学发光法检测血清IgA、IgG、IgM、IgE水平。

2 结果
2.1一般资料比较 HSP不同临床表型患儿30例,其中单纯紫癜型10例,平均年龄(5.89±3.57)岁,男6例,女4例;消化道出血型10例,平均年龄(6.18±3.42)岁,男6例,女4例;肾脏损伤型10例,平均年龄(7.41±3.27)岁,男3例,女7例。HSP不同临床表型患儿给予对症支持治疗后,症状好转出院。对照组儿童10例,平均年龄(5.63±3.57)岁,男5例,女5例。4组儿童年龄、性别差异无统计学意义(F=2.17,χ2=2.45,P>0.05),见表1。

表1 一般资料比较例(%)]
2.2测序与质量控制 经测序共获得Raw Reads 6 551 486条,优化后获得Clean Reads 共6 418 300条,各样本平均160 456条,最多为160 544条/样本,最少为160 306条/样本,测序覆盖度较好,拼接后共获得序列3 200 920条,总序列平均504 bp,共获得OTU 692个。shannon指数曲线随测序深度增加趋向于平坦,表明测序数据样本量足以反映各组微生物信息(图1)。

图1 shannon指数值与样品深度的关系
2.3OTU的Venn图分析 观察组和对照组共产生OTU 692个,共有OTU 340个,其中对照组儿童OTU 441个,不同临床表型HSP患儿OTU分别为500个(B组)、554个(C组)、533个(D组),明显高于对照组。观察组特有OTU数较对照组高,其中B组26个,C组56个,D组36个,4组间差异有统计学意义,满足归类分析要求(图2)。

图2 肠道菌群的OTU 交叠Venn图
2.4物种及其丰度分析
2.4.1门分类水平比较 4组患儿肠道菌群均以Firmicutes(厚壁菌门)、Bacteroidetes(拟杆菌门)、Proteobacteria(变形菌门)为优势菌群,3个门类中所占比例分别为A组93.65%、B组98.95%、C组95.62%、D组96.19%。结合门水平差异筛选物种,在变形菌门中,C组丰度明显高于B、D组(P<0.05,图3)。
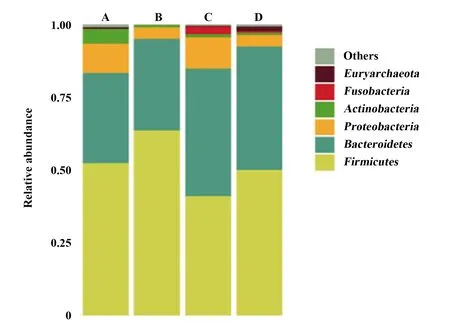
图3 4组样本肠道菌群门分类水平的相对丰度
2.4.2属分类水平比较 4组研究对象中,肠道菌群均以拟杆菌属、粪杆菌属、普雷沃氏菌属、巨单胞菌属、埃希菌属为优势菌属(图4)。Kruskal-Wallis分析发现,不同临床表型的HSP患儿中普雷沃氏菌属、芽殖菌属、梭形杆菌属存在显著差异(P<0.05,表2),且普雷沃氏菌属丰度由高到低为肾脏损伤型>单纯紫癜型>消化道出血型;芽殖菌属丰度由高到低为肾脏损伤型>单纯紫癜型>消化道出血型;梭形杆菌属丰度由高到低为消化道出血型>肾脏损伤型>单纯紫癜型。

表2 4组样本肠道菌群属水平差异比较
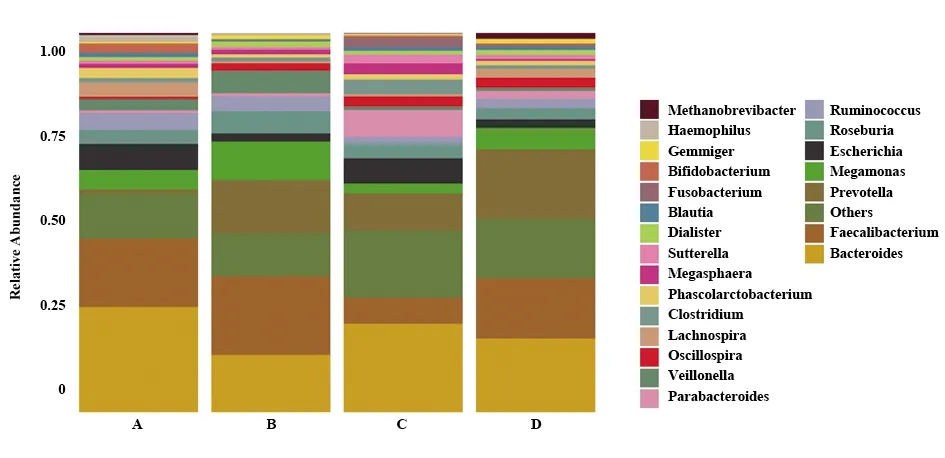
图4 4组样本肠道菌群属水平分布
2.5差异细菌种类 A组γ-变形菌纲丰度较高;B组双歧杆菌属(门到属水平)丰度降低;C组变形菌门、δ变形菌纲、脱硫弧菌科(目到科水平)、Oscillospira属、Parabacteroides属丰度提高,而双歧杆菌科(目到科水平)和链球菌科(目到科水平)丰度降低;D组脱硫弧菌属(目到属水平)、普雷沃氏菌属(科到属水平)、芽殖菌属、Barnesiellaceae科丰度提高,而乳酸杆菌目、双歧杆菌属丰度降低(图5)。

图5 GraPhlAn肠道菌群组成图
2.6肠道菌群与临床指标的相关性分析 HSP患儿血清IL-6、IL-8、IgA水平明显高于健康儿童,且肾脏损伤型HSP患儿组血清IL-6、IL-8、IgA水平均高于单纯紫癜型HSP患儿(P<0.05);各组IL-10、IgG、IgM及IgE水平差异无统计学意义(P>0.05,表3)。Spearman相关性分析发现,HSP患儿属水平的3种细菌与5个临床指标显著相关(>0.22或<-0.22,P<0.05,图6),其中芽殖菌属与IL-6、sIgA、IgG呈正相关(r=0.245、0.407、0.245,P<0.05),普雷沃氏菌属(Prevotella)与IL-8水平呈正相关(r=0.430,P<0.05),而双歧杆菌属(Bifidobacterium)与IL-10水平呈负相关(r=-0.382,P<0.05)。
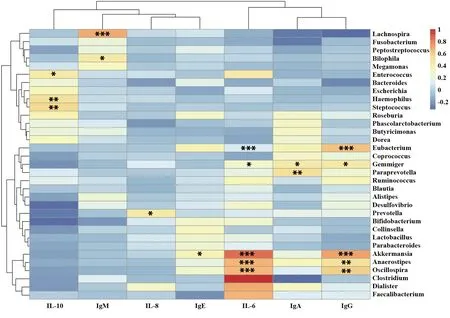
图6 通过Spearman相关性分析HSP患儿肠道菌群和临床指标相关性的热图
表3 临床指标比较
3 讨论
过敏性紫癜常见于儿童,是一种累及皮肤、消化道、肾脏等器官的小血管和毛细血管炎症,可导致多脏器损伤,脏器受累是影响HSP患儿预后的主要原因。HSP的病因及发病机制尚不明确。随着分子生物学技术发展,研究表明微生物的多样性与人体发育和功能免疫性疾病的发病机制相关,也提出了“微生物-脑-肠轴”“肠-肾轴”学说,为神经系统疾病和肾脏疾病研究提供了新的思路[7-8]。本研究通过检测HSP不同临床表型患儿肠道菌群的变化,探讨肠道菌群紊乱与HSP患儿脏器损伤的关系。
本研究显示,HSP不同临床表型OTU 数存在差异,且shannon指数曲线随测序深度增加趋于平坦,故各组纳入的样本量可反映各组微生物信息,进一步菌群差异分析发现,HSP不同临床表型患儿肠道菌群在门、纲、目、科、属、种水平存在差异,且HSP患儿的有害菌群或条件致病菌丰度提高,与既往研究HSP患儿Parabacteroides、变形菌门等有害菌群丰度较健康儿童升高的结果一致[9]。本研究发现,与健康儿童相比,HSP肾损伤型患儿芽殖菌种(属到种水平)、普雷沃氏菌种(科到种水平)、脱硫弧菌属(目到属水平)、Barnesiellaceae科丰度提高,芽殖菌、脱硫弧菌可,引起肠道慢性炎症。研究发现芽殖菌在炎症性肠病患者中打破肠道菌群平衡,且脱硫弧菌可使蛋氨酸产生高浓度硫化氢,从而抑制细胞色素C氧化酶,降低细胞呼吸作用,损伤肠黏膜上皮细胞,破坏肠黏膜屏障功能[10-15]。本研究发现HSP肾脏损伤型患儿芽殖菌和脱硫弧菌丰度高于其他组,说明HSP肾脏损伤型患儿肠道菌群平衡被破坏。普雷沃氏菌为严格厌氧菌,是口腔中的优势菌,且细菌表面的LPS可诱导单核细胞或巨噬细胞分泌炎症介质[16-17];Barnesiellaceae科可促进肠道菌群炎症反应,增加肠道通透性[18];研究发现HSP患儿尤其是肾脏损伤型患儿血清中IL-6、IL-8、IL-10和IgA等免疫因子呈高表达[19-20]。本研究发现芽殖菌属丰度与血清中IL-6、IgA、IgG水平呈正相关,普雷沃氏菌属丰度与IL-8呈正相关,提示肠道菌群改变与HSP肾脏损伤型患儿全身免疫反应过程及肾脏损伤有关。HSP肾脏损伤型患儿中以上肠道菌群丰度提高导致肠道炎症反应增强、肠道通透性增加,从而使肠道内毒素透过血液循环导致肾脏损伤。本研究发现,与健康儿童相比,HSP消化道出血型患儿变形菌门、δ变形菌纲、脱硫弧菌科(目到科水平)、Oscillospira属、Parabacteroides属丰度提高,其中变形菌门为革兰氏阴性菌,是兼性厌氧菌,包括多种病原微生物,在健康机体内变形菌门比厚壁菌门和拟杆菌门丰度降低,其在口腔中丰度较高,而在肠道内丰度较低,变形菌门丰度提高可作为肠道菌群紊乱的标志,本研究发现HSP消化道出血型患儿组变形菌门丰度明显高于其他组,说明HSP消化道出血型患儿存在更明显的肠道菌群紊乱。δ变形杆菌是一种含LPS较多的杆菌,其数量增加可导致较多的LPS 进入肠道黏膜并透过黏膜进入血液,LPS 可引起肠道内先天性免疫系统反应,从而引发局部炎症反应[21-22]。研究显示,脱硫弧菌、Parabacteroides属均可影响肠道菌群通透性,Parabacteroides属与肠道的紧密连接蛋白occludin和ZO-1 mRNA水平呈负相关,从而影响肠道通透性,因此HSP患儿消化道出血与变形菌门、δ变形菌纲、脱硫弧菌、Oscillospira属、Parabacteroides属丰度提高密切相关[23]。本研究发现,与健康儿童相比,HSP单纯紫癜型患儿中梭形杆菌属(门到属水平)丰度降低;目前认为梭形杆菌可产生丁酸,以丁酸为主的短链脂肪酸可通过影响5-HT释放改变结肠组织钠水吸收能力及直接影响肠道平滑肌收缩等机制影响肠道运动,可能与部分HSP患儿出现便秘有关[24-26]。与健康儿童相比,HSP不同临床表型患儿均存在肠道菌群紊乱。
本研究发现,HSP不同临床表型患儿存在不同程度肠道菌群变化,与HSP单纯紫癜型患儿相比,肾脏损伤型HSP患儿普雷沃氏菌科、Barnesiellaceae科丰度明显提高,消化道出血型患儿梭形杆菌属(门到属水平)丰度明显提高,与HSP消化道出血型患儿相比,肾损伤型患儿芽殖菌种(属到种水平)丰度明显提高;芽殖菌可破坏肠道菌群平衡,且普雷沃氏菌、Barnesiellaceae菌可促进炎症反应,从而破坏肠道屏障,可能促使炎症因子通过肠道屏障到达全身脏器,导致脏器损伤,如肾损伤。梭形杆菌在HSP消化道出血型患儿中丰度明显高于单纯紫癜型患儿、肾脏损伤型患儿,肠道中高丰度的梭形杆菌可产生大量丁酸,GE等[27]灌胃给予小鼠丁酸后粪便含水量升高,可能是引起部分消化道出血患儿出现血水样大便的原因。不同的肠道菌群变化可能是导致HSP患儿出现不同临床表型的原因,且随脏器损伤加重,有害菌群或机会致病菌丰度提高更为显著。
本研究发现HSP不同临床表型患儿有益菌群丰度降低,与既往研究发现HSP患儿双歧杆菌、链球菌等有益菌群丰度降低结果一致[28]。本研究显示,HSP肾脏损伤型患儿中乳酸杆菌目、双歧杆菌属丰度明显降低,双歧杆菌和乳酸杆菌有助于恢复肠道微生态平衡,促进肠上皮细胞分泌黏蛋白,促进潘氏细胞分泌sIgA,在肠道局部产生免疫作用,对全身性免疫反应也有一定调节作用[29]。HSP消化道出血型患儿中,双歧杆菌科(目到科水平)和链球菌科(目到科水平)丰富明显降低,链球菌为厚壁菌门,部分链球菌可引发人脑膜炎、肺炎、心内膜炎等疾病,但大多数链球菌在体内并不致病,在人皮肤、口腔、消化道等部位形成与人体共生的正常菌群,人乳汁中也含有链球菌[30]。HSP单纯紫癜型患儿中,双歧杆菌属(门到属水平)丰度明显降低,双歧杆菌可消耗人乳中复杂寡糖,抵抗肠道病原菌定植和入侵、增强肠道上皮的屏障作用,其代谢产物还可增强肠道的防御作用,是黏附于肠黏膜上皮的有益菌,研究发现,炎症性肠病患者肠道菌群中双歧杆菌水平较健康志愿者降低,含有双歧杆菌的益生菌可减轻溃疡性结肠炎炎症反应及预防贮袋炎[31]。本研究发现,HSP不同临床表型患儿随脏器损伤加重,有益菌群丰度降低更为明显,且双歧杆菌属丰度下降,与既往HSP患者肠道菌群研究双歧杆菌减少结论一致[32]。本研究发现双歧杆菌丰度降低与血清中IL-10水平提高有关,双歧杆菌丰度降低可能与HSP患儿疾病发生发展密切相关。
综上,本研究初步揭示HSP不同临床表型患儿肠道菌群组成结构和多样性具有明显差异,在临床应用中可通过选择相应的益生菌制剂,如双歧杆菌和乳酸杆菌调节胃肠道菌群治疗儿童HSP,并可通过肠道菌群丰度检测诊断是否存在脏器损伤,但由于16S rRNA基因测序技术的局限性及纳入样本量有限,后续将增大样本量并采用宏基因技术找出差异基因,进一步探讨菌群结构和多样性改变治疗HSP不同临床表型的内在机制,为HSP不同临床表型患儿的诊治提供依据。

