镍氰配合物滴定法快速测定高浓度氰化物
苑海涛,周丽华,关金锁,王 扬
(核工业北京化工冶金研究院,北京 101149)
氰化物多为剧毒物质,但被广泛应用于冶金、化工等领域[1],尤其在黄金冶炼工业中,冶炼过程产物中或冶炼废水中都可能存在高浓度氰化物[2]。研究建立快速测定高浓度氰化物的方法对实际生产过程控制或废水中氰化物检测有重要意义[3]。
氰化物的测定主要有滴定法、色谱法、光度法等。色谱法和光度法对于高浓度氰化物的快速测定不适用。滴定法测定范围较宽,通常是用硝酸银溶液滴定,氰根与硝酸银反应,过量银离子与碘化钾反应,生成黄色沉淀指示到终点。但此法试剂成本较高,不宜于高频次测定[4-7]。
试验发现,对于高浓度氰化物溶液,若用Ni2+滴定CN-,在滴定反应到达终点时会出现悬浮物,体系浊度迅速增大,溶液吸光度会随之发生改变。利用这一反应特征,无须加入指示剂就可判断滴定终点,实现对高浓度氰化物的快速测定。因此,研究了以Ni2+滴定CN-,使形成镍氰配合物快速滴定测定溶液中的高浓度氰化物。
1 试验部分
1.1 仪器与试剂
分光光度计,北京普析通用仪器有限责任公司;分析天平,德国Sartorius公司。
CN-标准溶液:0.256 mol/L,6.272 g NaCN溶于200 mL水中定容至500 mL;
Ni2+标准溶液:0.04 mol/L,7.308 g Ni(NO3)2溶于200 mL水中定容至1 000 mL;
NaOH溶液:1.00 mol/L,20.000 g NaOH溶于200 mL水中定容至500 mL。
除特殊说明外,试验所用试剂均为分析纯,试验用水为蒸馏水。
1.2 测定原理
Ni2+与CN-反应首先生成Ni(CN)2,过量的CN-与Ni(CN)2进行配合反应生成可溶性镍氰配合物[Ni(CN)4]2-;随滴定进行,当体系中CN-都与Ni2+反应生成[Ni(CN)4]2-后,再滴加多余的Ni2+时,Ni2+会继续参与体系中的反应,形成难溶镍氰化合物,并在溶液中形成悬浮颗粒,使溶液体系浊度剧烈增大、吸光度发生变化。
1.3 试验方法
碱性条件下,向稀释后的CN-标准溶液中加入滴定剂Ni2+溶液,在一定条件下滴加反应一定时间后,用分光光度计在550 nm处测定溶液吸光度。通过试验找到合适的滴定终点判定条件,以及最优反应条件,考察体系稳定性及共存物质的干扰影响,建立标准工作曲线。
2 试验结果与讨论
2.1 滴定过程变化与滴定终点判定
取CN-浓度0.032 mol/L溶液20.00 mL,滴加Ni2+浓度0.04 mol/L溶液,每滴加0.05 mL Ni2+溶液即测定一次溶液吸光度。选用1 cm石英比色皿。CN-与Ni2+反应过程中及反应终点溶液的吸光度变化如图1所示。
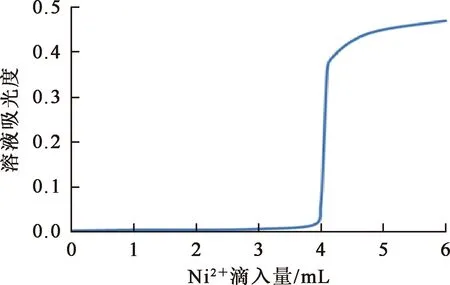
图1 反应溶液吸光度变化
由图1看出,滴定Ni2+溶液的体积在4.05~4.10 mL范围时,溶液吸光度存在跳跃变化,即当CN-与Ni2+配合反应达到终点后,多余Ni2+与体系溶液反应生成其他镍氰化合物,造成体系溶液吸光度发生变化,吸光度变化值为0.363,体系溶液明显浊度变大,肉眼观察现象明显。将吸光度突跃认定为滴定终点,与理论计算的滴定终点相一致,因此,可以利用此现象肉眼判定滴定反应终点。
为进一步确定滴定终点,取不同CN-浓度溶液20.00 mL,按上述方法进行滴定测定,在到达滴定终点附近时测定吸光度跳跃变化值。结果如图2所示。其中,以1#~5#分别代表CN-浓度为0.008、0.016、0.032、0.064、0.128 mol/L溶液。
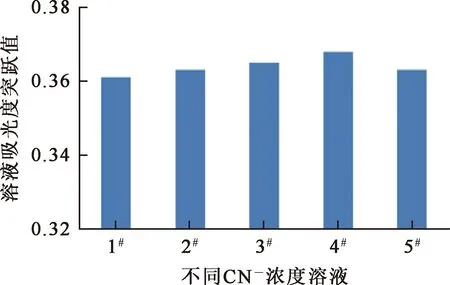
图2 不同CN-浓度溶液的吸光度突跃值
由图2看出,不同CN-浓度条件下,滴定反应终点时溶液吸光度所形成的突跃值在0.360~0.370之间。可以认定在不同CN-浓度条件下,都可以通过肉眼直观观察溶液浊度变化来判定滴定终点。
2.2 温度对滴定反应的影响
取CN-浓度0.032 mol/L溶液20.00 mL,在不同温度条件下,滴加Ni2+浓度0.04 mol/L 溶液进行滴定测定。温度与反应达到终点所消耗的Ni2+溶液量之间的关系如图3所示。
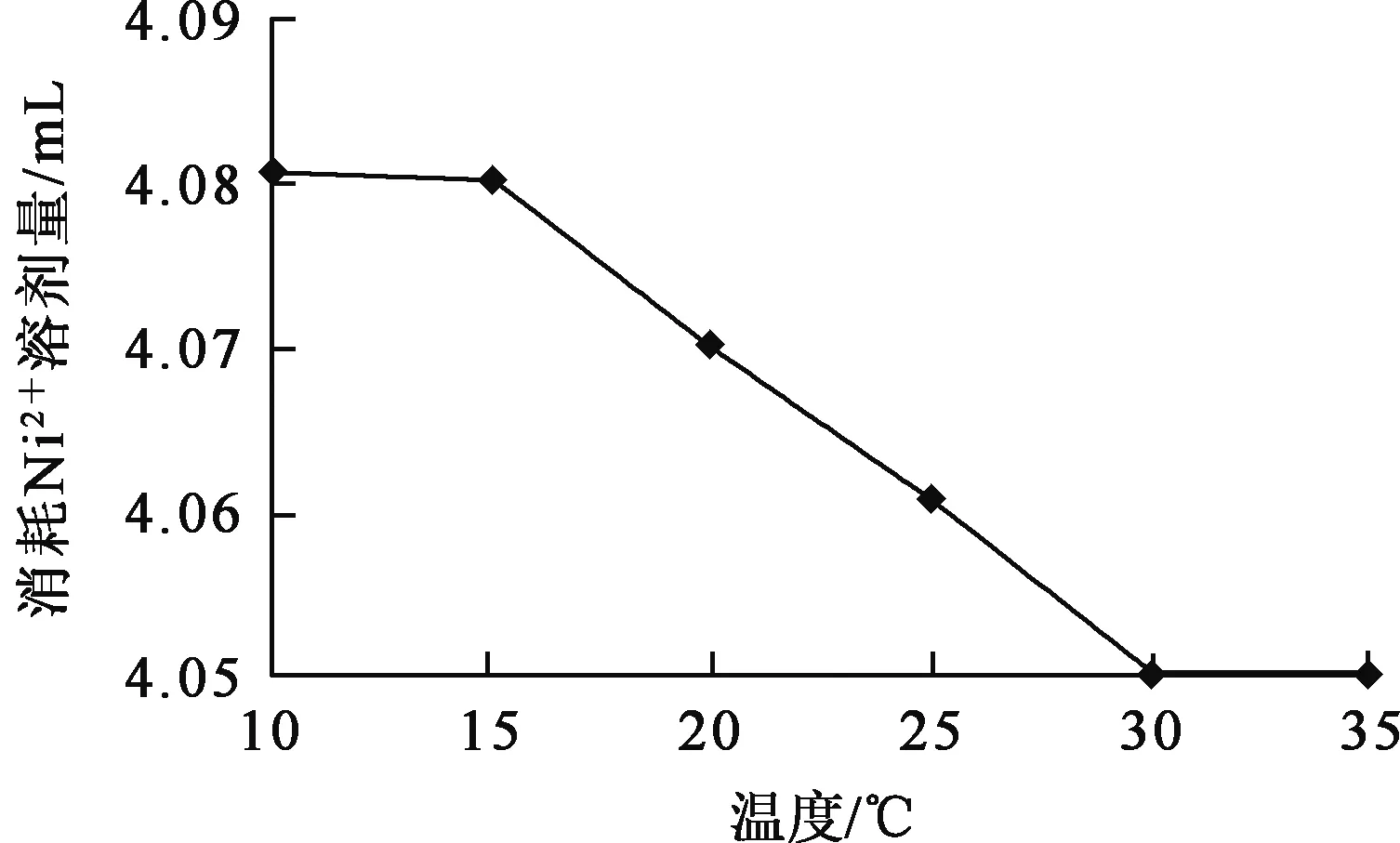
图3 温度与反应达到终点所消耗Ni2+溶液量之间的关系曲线
由图3看出,滴定达到终点所消耗Ni2+溶液量在4.05~4.08 mL之间,相差在1.00%以内。因此,环境温度在10~35 ℃范围时对反应的影响基本可以忽略。
2.3 OH-浓度对滴定反应的影响
取CN-浓度0.032 mol/L溶液20.00 mL,在不同温度条件下,滴加Ni2+浓度0.04 mol/L溶液进行滴定测定,将溶液出现浊度突跃认定为滴定终点。对于高浓度氰化物溶液,为避免有HCN逸出,溶液大都呈碱性,有大量OH-共存。OH-浓度对CN-的滴定测定的影响试验结果如图4所示。
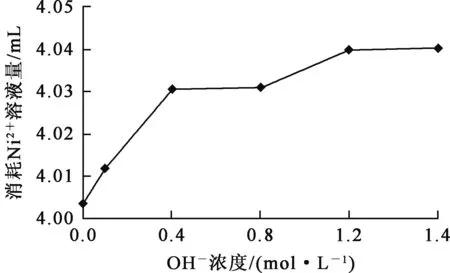
图4 OH-浓度对滴定测定结果的影响
由图4看出:在相同CN-浓度溶液中,当OH-浓度与CN-浓度比至少达到50时,滴定达到终点所需Ni2+溶液量变化都很小,最大、最小相差0.04 mL;对于4.00 mL滴定量,相差在1.00%之内,OH-对CN-滴定的干扰基本可以忽略。
2.4 其他共存物质的干扰
在最佳条件下,考察CN-浓度0.008 mol/L溶液中共存物质对CN-测定结果的影响,试验结果见表1。结果表明,CN-浓度测定值相对误差均不超过±2%。
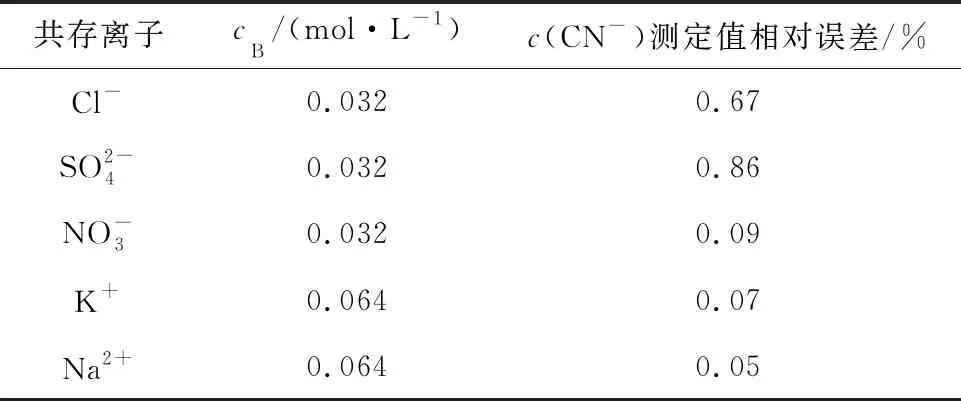
表1 共存离子的干扰情况
2.5 反应体系的稳定性
取CN-浓度0.032 mol/L溶液20.00 mL,滴加Ni2+浓度0.04 mol/L溶液,滴定达到终点时持续一定时间连续测定溶液吸光度,结果如图5所示。
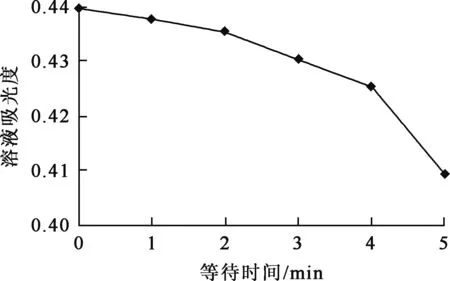
图5 反应体系的稳定性
由图5看出,滴定终点溶液吸光度随时间延长缓慢下降,但在2 min之内溶液吸光度变化在1.00%以内。因此,在滴定达到终点后溶液可以保持至少2 min。
2.6 滴定反应工作曲线
取不同CN-浓度溶液20.00 mL,分别滴加Ni2+浓度0.04 mol/L溶液,利用溶液吸光度突跃来判定滴定终点。CN-浓度与反应达到终点所消耗的Ni2+溶液量之间的关系如图6所示。
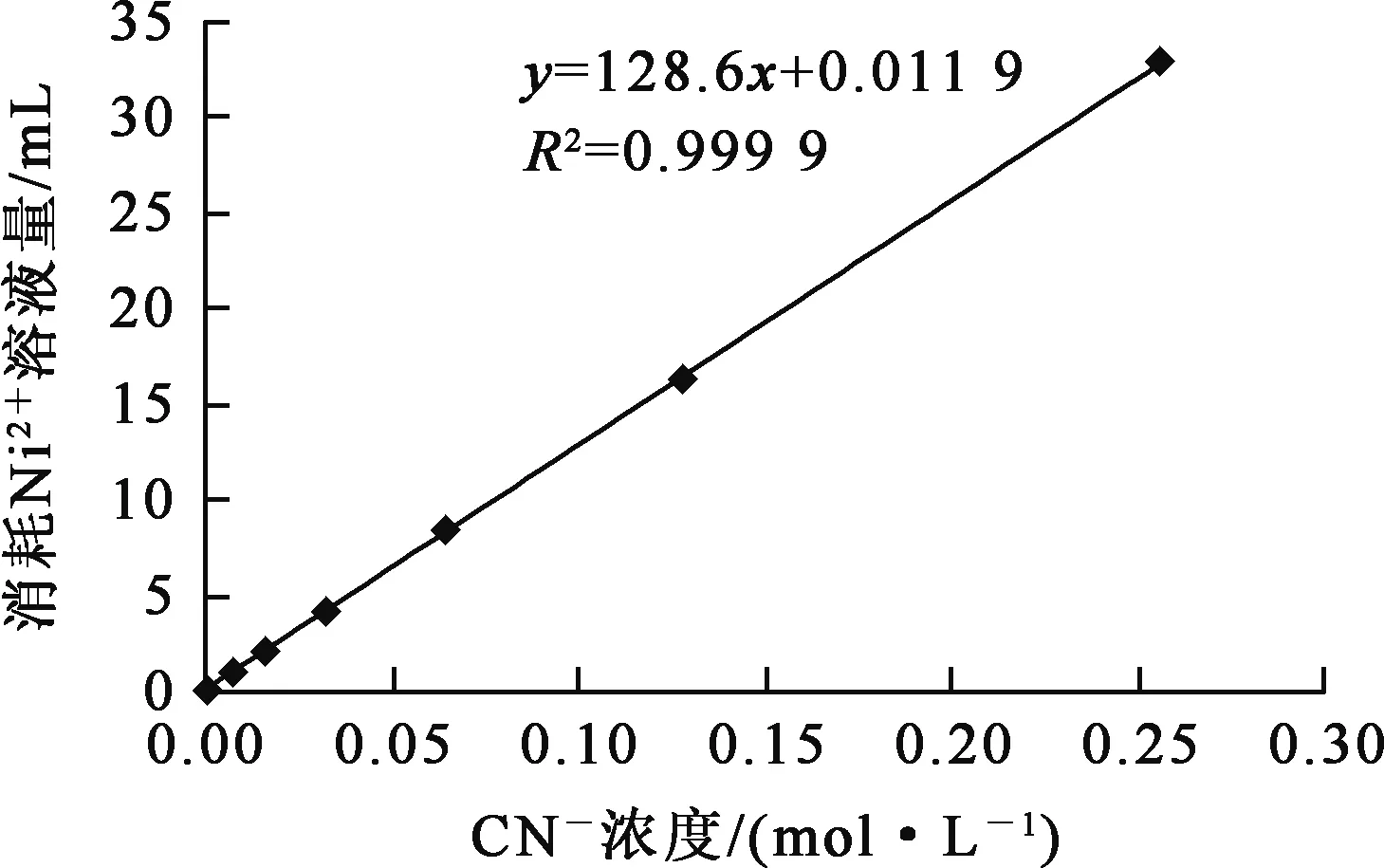
图6 CN-浓度与反应达到终点所消耗Ni2+溶液量之间的关系曲线
由图6看出:随CN-浓度升高,滴定达终点所需Ni2+溶液量增大,且CN-浓度与消耗Ni2+溶液量呈线性关系,线性回归方程为
y=128.6x+0.011 9,
相关系数为0.999 9,该结果与理论分析结果基本一致。所以,当CN-浓度在0.008~0.256 mol/L 范围内时,可以直接用此法来测定CN-浓度。
2.7 方法的精密度与准确度
取不同CN-浓度标准溶液,在试验条件下进行6次平行滴定测定,以测定结果的相对标准偏差检验方法精密度,以测定结果平均值与对应标准溶液的浓度值之差相对于量程值的百分率表示示值误差。测定结果见表2。可以看出:测定结果的相对标准偏差在2%以内,表明此方法的重现性较好,精密度较高;测定结果的示值误差在2%以内,表明准确度较为高。

表2 方法精密度测试结果
2.8 样品分析
采用此法对实际水样进行测定,并与实验室标准测定结果进行比较,结果见表3、4。可以看出,对实际样品的测定结果相对误差在5%以内,加标回收率在93.8%~104.7%范围内,说明此法对实际样品的滴定测得结果较为准确可靠。
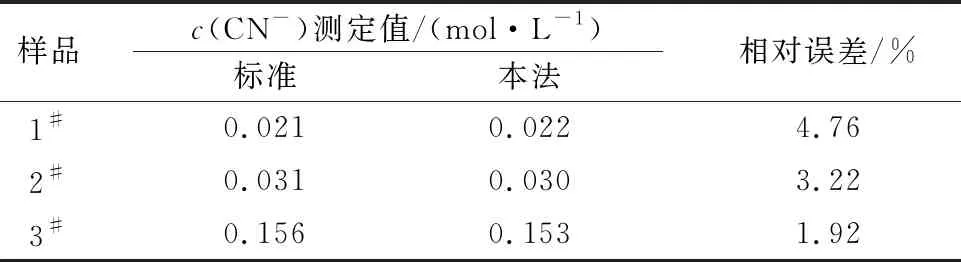
表3 实际样品的滴定测定结果
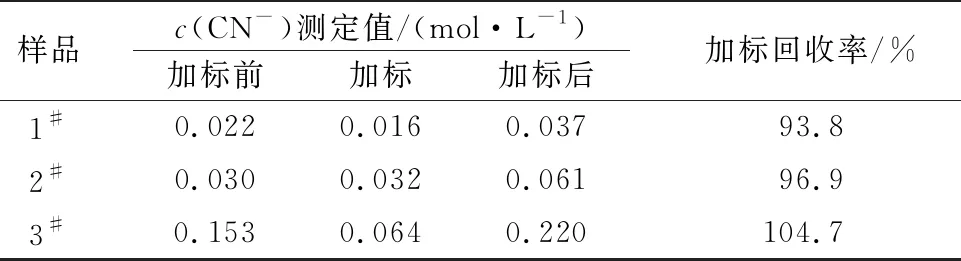
表4 实际样品加标回收测定结果
3 结论
研究建立了以Ni2+溶液滴定测定高浓度氰化物方法,此法操作简单,测量量程较宽,滴定终点判定简单,现象明显,测定速度快、具备一定抗干扰性且成本低廉。方法测定结果的精密度与准确度都较高。对于实际样品的测定结果相对误差在5%以内,加标回收率较高,测定结果较为准确可靠。此方法可以满足实际生产中对于高浓度氰化物的高频次快速测定要求。

