基于植物广泛靶向代谢组学技术探究小米粥中酚类化合物组成及其抗氧化性
康子悦,沈 蒙,葛云飞,王 娟,全志刚,肖金玲,王维浩,2,曹龙奎,2,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.国家杂粮工程技术研究中心,黑龙江 大庆 163319)
小米(Setaria italicaBeauv.),原名粟,在世界谷物产量中排名第6,我国黄河中上游为主要栽培区[1]。《本草纲目》中记载,小米“治反胃热痢,煮粥食,益丹田,补虚损,开肠胃”。中医亦讲小米“和胃温中”,认为小米粥具有清热解渴、健胃除湿、补虚损和健胃消食等功效。
多酚类化合物具有抗氧化、抗肿瘤、延缓衰老、预防或减少疾病的发生等作用,是世界上最广泛的膳食补充剂之一。多酚类化合物是小米中最主要的功能性成分之一,同样具有上述功能特性[2-3]。小米中含有游离和共轭形式的酚酸,包括羟基苯甲酸和羟基肉桂酸的衍生物;还含有黄酮类化合物,包括黄酮、黄烷酮、异黄酮等。此外,部分小米中还含有少量的单宁类物质[4-5]。小米粥作为家庭常吃的一种粥品,具有开肠胃、反胃热痢、健胃消食等养胃功能。而多酚类化合物作为一种功能因子存在于小米粥中,不仅具有抗氧化、抗肿瘤等作用,还具有修复胃黏膜损伤、提高胃肠动力和预防胃肠道疾病等功能,因此酚类化合物可能是小米粥养胃的功能因子之一。
现阶段,对于小米和小米粥中酚类化合物的研究停留在提取工艺、抗氧化能力测定及加工对总多酚或几种酚类物质的影响阶段。魏春红等[6]采用酶法辅助提取小米多酚,结果表明液料比14∶1 (mL/g)、双酶添加量0.9%、酶解时间2 h、酶解温度40 ℃为最佳提取工艺。延莎等[7]测定不同米色的小米多酚类化合物的抗氧化能力,结果表明晋谷21抗氧化能力最强。张玲艳等[8]探究蒸煮对小米多酚及抗氧化活性的影响,结果表明煮小米中总多酚的保留率较高。Geetha等[9]采用酶法-超声法协同萃取小米糠中多酚类化合物,该方法的提取率是常规法的2 倍,且抗氧化能力也随之提高。Hithamani等[10]提取的小米多酚总量为10.2 mg/g,发芽或压力蒸煮后多酚含量下降了50%,而开锅蒸煮后其多酚含量仅下降12%~19%。Taylor等[11]分析了脱皮、蒸煮、发芽后小米中多酚类化合物的变化,结果表明食品加工会降低多酚类化合物的含量。其中热处理影响复杂,可能是在此过程中发生结合酚的释放和多酚的解聚。
目前,小米经过煮制后酚类化合物含量和抗氧化能力变化的趋势鲜见报道,在此过程中,保持高含量或在体内具有重要作用的多酚类化合物种类也鲜见报道。本实验采用定性准确、灵敏度高、重复性好的植物广泛靶向代谢组学技术探究小米粥中酚类化合物的组成,并分析差异组分,以期为人们提供简便且更为合理的小米粥煮制方式,更为进一步探究小米粥中酚类化合物对胃的保护机制提供理论依据,同时也为开发功能性食品提供理论基础。
1 材料与方法
1.1 材料与试剂
小米(品种为东方亮,产地为山西省,粒径均匀,颜色金黄,有光泽,无霉烂碎米) 市售;石油醚、丙酮、乙酸乙酯(均为分析纯) 天津市大茂化学试剂厂;没食子酸(标准品)、无水碳酸钠、Folin-Ciocalteu上海市麦克林生化科技有限公司;总抗氧化试剂盒 南京建成生物工程研究所;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 梯希爱(上海)化学工业发展有限公司;甲醇、乙腈 美国Honeywell公司;甲酸 美国Sigma公司。
1.2 仪器与设备
MJ-10A高速万能粉碎机 天津市泰斯特仪器有限公司;Specord 210 plu紫外-可见分光光度计 德国耶拿仪器有限公司;DGG-9070A电热恒温鼓风干燥箱 上海森信试验仪器有限公司;AR2140电子天平、DSC1型差示扫描量热仪 梅特勒-托利多仪器(上海)有限公司;TD5A-WS台式离心机 湖南湘仪试验室仪器开发有限公司;1290超高效液相色谱仪、6490 Series三重四极杆质谱仪 安捷伦科技有限公司;Triple TOF 6600高分辨质谱仪 美国AB SCIEX公司;ACQUITY UPLC HSS T3色谱柱(2.1 mmh 100 mm,18 μm) 沃特世科技(上海)有限公司。
1.3 方法
1.3.1 小米粥最佳煮制工艺优化
1.3.1.1 单因素试验
以小米粥多酚含量为评价指标进行3因素4水平的单因素试验,料液比1∶20、1∶25、1∶30、1∶35(g/mL),煮制时间15、18、21、24 min,煮制功率500、700、900、1 100 W,以此优化小米粥煮制工艺。在选择不同因素时,其他固定条件分别为料液比1∶20(g/mL)、煮制时间15 min、煮制功率500 W。
1.3.1.2 正交试验
在单因素试验的基础上,设计3因素4水平正交试验,确定小米粥最佳煮制工艺参数,因素与水平设计见表1。

表1 小米粥煮制工艺正交试验因素与水平Table 1 Code and level of independent variables used for orthogonal array design
1.3.1.3 小米粥淀粉糊化度的测定
取1 粒煮后的小米粥,平铺于坩埚底部,擦拭坩埚边缘。盖上坩埚盖密封,并采用压样器对坩埚进行压制,保证坩埚不偏且密封良好。于4 ℃冰箱中静置12 h后放入差示扫描量热仪中。取5 mg生小米粉(60 目)加入7 μL去离子水,平铺于坩埚底部,其余操作同上。差示扫描量热仪测定参数:氮气流量为150 mL/min;压力为0.1 MPa;升温速率为5 ℃/min;从20 ℃升温至100 ℃,利用电脑程序记录差示扫描量热曲线,并进行对比分析[12]。
1.3.1.4 小米粥品质的感官评定
取一定质量的小米粥成品,由10 名专业人员组成评定小组,分别从小米粥的香味、口感、色泽、籽粒体态、米汤组织形态5 个方面进行感官评价,10 名评定人员评定结果的平均值为最终评定结果,评分标准如表2所示[13]。

表2 小米粥感官评定标准Table 2 Criteria for sensory evaluation of millet porridge
1.3.2 小米粥总多酚的提取
小米粥冷冻干燥后使用粉碎机粉碎后过60 目筛。称取2 g原料加入25 mL 70%乙醇溶液超声提取25 min后,4 000 r/min离心10 min。提取2 次后合并上清液,用于测定总多酚含量。
1.3.3 小米和小米粥游离酚的提取
采用Anoma[14]和Irakli[15]等的方法稍作修改。小米粥冷冻干燥后使用万能粉碎机粉碎。称取2 g原料加入25 mL 70%丙酮溶液,超声提取25 min后4 000 r/min离心10 min。提取2 次后合并上清液,冷藏备用。残渣用于结合酚的提取。生小米采用同样的方法提取游离酚作为对照实验。
1.3.4 生小米和小米粥结合酚的提取
采用Anoma[14]和Irakli[15]等的方法稍作修改。向上述风干的样品中加入20 mL 4 mol/L NaOH溶液,避光水解4 h后用浓盐酸将pH值调节至2.0。4 000 r/min离心10 min。加入25 mL正己烷去酯2 次后加入25 mL乙酸乙酯充分混合,提取2 次后合并上层提取液,冷藏备用。小米采用同样的方法提取结合酚作为对照实验。
1.3.5 酚类化合物含量的测定
1.3.5.1 标准曲线的制作
采用Folin-Ciocalteu法[16]。称取10 mg没食子酸标准品,蒸馏水定容至100 mL,配成0.1 mg/mL没食子酸标准溶液。吸取0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL没食子酸标准溶液,加入1 mL Folin-Ciocalteu试剂,混匀后避光静置2 min。加入2 mL 12% Na2CO3溶液,定容至100 mL。避光静置2 h后于波长760 nm处测定吸光度,做3 组平行。以没食子酸含量为横坐标,吸光度为纵坐标,绘制标准曲线。
1.3.5.2 样品酚类化合物测定
1 mL提取液置于100 mL容量瓶中,加入1 mL Folin-Ciocalteu试剂,摇匀后避光静置2 min。加入2 mL 12%的Na2CO3溶液,蒸馏水定容至刻度。避光静置2 h后,于波长760 nm处测定吸光度,做3 组平行。利用标准曲线计算质量浓度(μg/mL,以没食子酸计),含量按照式(1)计算[17]:

式中:M为多酚含量/(mg/g);C为没食子酸质量浓度/(μg/mL);V为提取液体积/mL;N为稀释浓度;m为样品质量/g。
1.3.6 小米粥中游离酚和结合酚抗氧化能力检测
1.3.6.1 总抗氧化能力检测
采用总抗氧化能力试剂盒测定。按照说明书进行实验,重复3 次。于波长520 nm处测定OD值,总抗氧化能力按式(2)计算[17-18]:

式中:T为总抗氧化能力/(U/mL);OD测量为样品管中待测样品光密度;OD对照为对照管中待测样品光密度;V反为反应液总体积/mL;V取为样品取样量/mL;A为样品测试前稀释倍数。
1.3.6.2 DPPH自由基清除能力检测
准确称取DPPH标准品10 mg,无水乙醇定容至250 mL。样品管中加入3 mL提取液和3 mL DPPH标准溶液;本底管中加入3 mL提取液、3 mL DPPH标准溶液和3 mL无水乙醇;空白管中加入3 mL DPPH标准溶液和3 mL无水乙醇,做3 组平行。静置70 min后于510 nm波长处测量吸光度,清除率按式(3)计算[17-18]:

式中:S为DPPH自由基清除率/%;Ai为样品吸光度;Aj为本底吸光度;A0为空白吸光度。
1.3.7 小米粥中游离酚和结合酚组分的鉴定
吸取6 mL提取液,氮气吹干后加入300 μL甲醇溶剂复溶。将混合样品(QC)和样品(生小米游离酚、小米粥游离酚、生小米结合酚、小米粥结合酚)置于4 ℃、13 000 r/min离心15 min。取上清液于进样瓶中。通过超高效液相色谱-质谱联用仪进行检测分析[19-21]。
仪器分析条件:Agilent液相色谱自动进样器。色谱柱:HSS T3色谱柱(2.1 mmh 100 mm,1.8 μm)。色谱条件:流动相A为0.1%甲酸、流动相B为100%乙腈;梯度洗脱条件:0 m i n,9 8% A、2% B;0~10 min,98%~40% A、2%~60% B;10~12 min,40%~2% A、60%~98% B;12~13 min,2% A、98% B;13~13.1 min,2%~98% A、98%~2% B;13.1~15 min,98% A、2% B。流速400 μL/min,柱温25 ℃,进样量2 μL。质谱条件:进样口温度650 ℃;离子源温度650 ℃;检测范围m/z5~1 250。
1.4 数据分析
煮制工艺、酚类化合物含量及抗氧化水平测定使用Excel 2010进行分析,每组数据进行3 个平行实验,取其平均值并计算相对标准偏差,用SPSS软件进行方差分析;利用MAPS软件进行数据分析,并对数据进行总峰面积归一化处理;使用MEV4.9.0软件绘制差异组分层次聚类分析热力图;使用R语言进行KEGG Passway富集分析并绘制代谢差异图;使用SIMCA软件进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 小米粥煮制工艺的优化
2.1.1 酚类化合物含量标准曲线
标准曲线回归方程为y=0.081 3x+0.005 8,R2=0.998 4,具有较好的线性关系。
2.1.2 煮制时间对小米粥总多酚含量影响
如图1所示,与生小米对比,随着煮制时间的延长,小米粥总多酚含量逐渐下降,且呈显著性差异。小米粥各因素间也存在差异性,其中煮制15 min和煮制24 min呈现高度显著差异。当煮制时间为15 min时小米粥总多酚的含量最高。这是由于多酚类化合物是一种热不稳定性的物质,随着加热时间的延长,多酚被氧化破坏或降解,导致其含量下降。这与Aguilera等[22]研究结果相符。
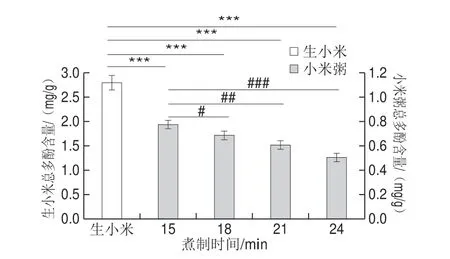
图1 煮制时间对小米粥总多酚含量的影响Fig.1 Effect of cooking time on total phenolic content of millet porridge
2.1.3 煮制功率对小米粥总多酚含量影响

图2 煮制功率对小米粥总多酚含量的影响Fig.2 Effect of cooking power on total phenolic content of millet porridge
如图2所示,与生小米相比,随着煮制功率的增加,小米粥总多酚的含量逐渐下降,且呈显著差异。当功率为500 W时小米粥总多酚的含量最高。其中,煮制功率500 W和1 100 W之间呈高度显著差异。这是由于总多酚类化合物热稳定差,随着功率的增加,温度也逐渐升高,导致总多酚含量下降。这与Gujral等[23]的研究结果相似。
2.1.4 料液比对小米粥总多酚含量影响
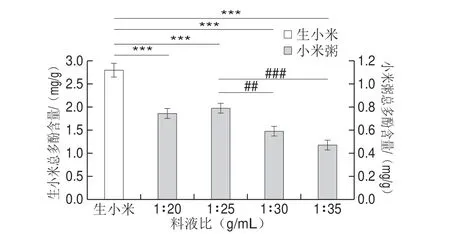
图3 料液比对小米粥总多酚含量的影响Fig.3 Effect of solid-to-liquid ratio on total phenolic content in millet porridge
由图3所示,与生小米相比,随着液体用量的增加,小米粥多酚的含量呈先上升后下降的趋势。当料液比为1∶25时小米粥总多酚的含量最高。可能是由于料液比为1∶25时小米保持良好的含水量,提高了总多酚的提取率。
2.1.5 煮制工艺优化正交试验
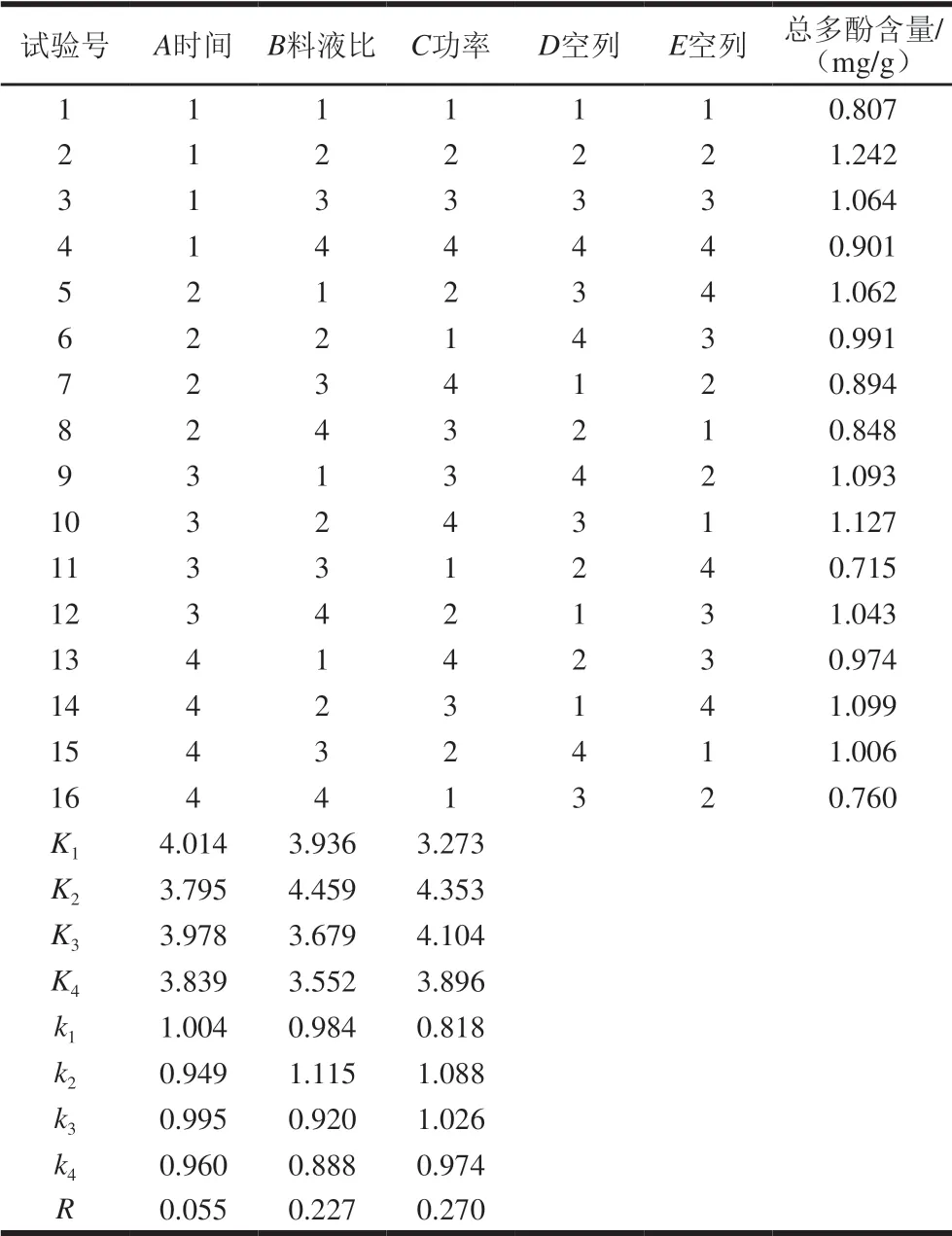
表3 煮制工艺正交试验设计及结果Table 3 Orthogonal array design in terms of coded data with response
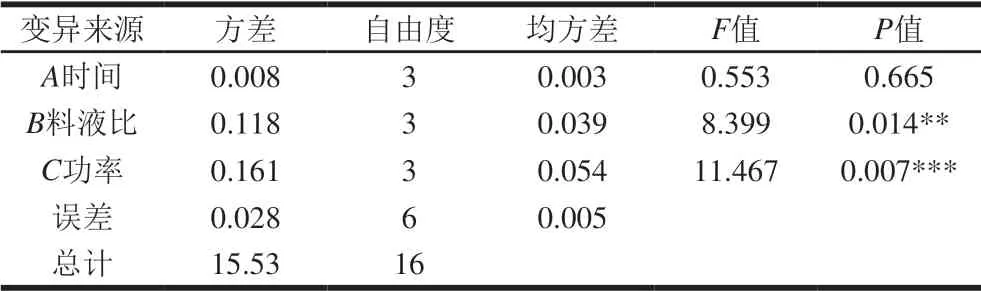
表4 传统煮制萃取方差分析Table 4 Analysis of variance for the effect of cooking parameters on total phenolic content in millet porridge
根据R大小,判断因素的主次顺序为A<B<C。由表3可知,最优结果为A1B2C2,即时间15 min、料液比1∶25(g/mL)、功率700 W。由表4可知,B、C对小米粥总多酚含量影响显著(P<0.05)。将最优组合进行验证,测得小米粥总多酚含量平均值为1.25 mg/g,与单因素试验相比其损失率降低了25%。
2.1.6 小米粥淀粉糊化度的测定结果
如图4所示,试验1号的煮制时间最短、煮制功率最低,若在此参数下小米粥中淀粉完全糊化,则可断定在其他参数下煮制的小米粥也完全熟制。淀粉糊化过程代表了淀粉分子从有序到无序状态的转变,同时也伴随着能量的变化,因此采用差示扫描量热仪对淀粉的糊化特性及糊化程度进行测定。当小米粥中淀粉完全糊化时,在热分析过程中应没有吸收峰,呈一条平坦的直线[13]。由图4可知,生小米出现了明显的吸热峰,表明其中含有大量的淀粉晶体,并未完全糊化。图中试验1号小米粥曲线没有出现吸收峰,表明小米粥已完全熟制。
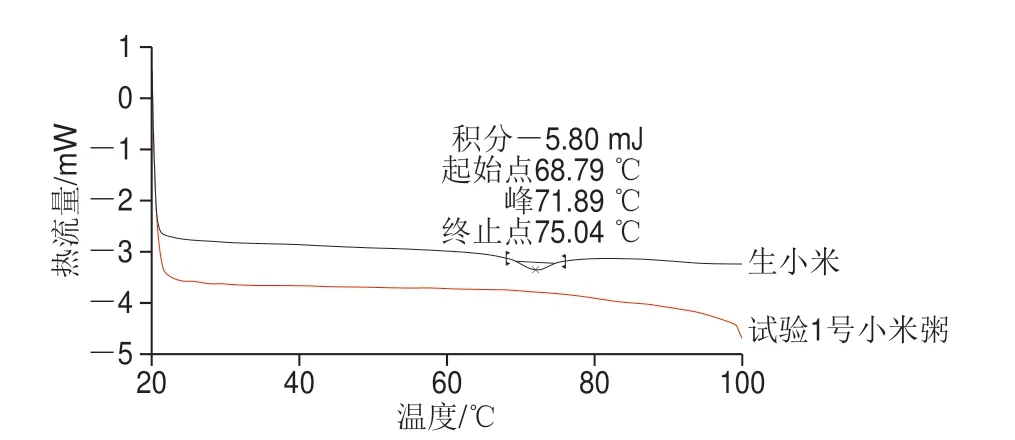
图4 生小米及小米粥的差示扫描量热曲线Fig.4 DSC curves of raw millet and millet porridge
2.1.7 小米粥品质的感官评定
根据表2制订的感官评定标准,对表3中16 个试验组进行感官评价,评价结果如表5所示。

表5 小米粥感官评定Table 5 Results of sensory evaluation of millet porridge
由表5可知,试验15组感官评定的结果最佳,其次为试验2组和试验11组。感官评定的结果表明,当水用量过高时,小米粥的香味呈下降趋势;当煮制功率过高时,其口感呈下降趋势;从表5可得出,烹饪小米粥时,煮制功率不易过大,同时煮制时间可以略微延长,也就是常说的“小火慢熬”,在此条件下,小米粥的风味物质不仅可以较好的溶出,且米粒的口感软硬适中。结合表3中总多酚含量,选取试验2组为最佳煮制工艺,也将采用试验2组的煮制工艺参数进行后续实验。
2.2 小米粥游离酚和结合酚的测定结果
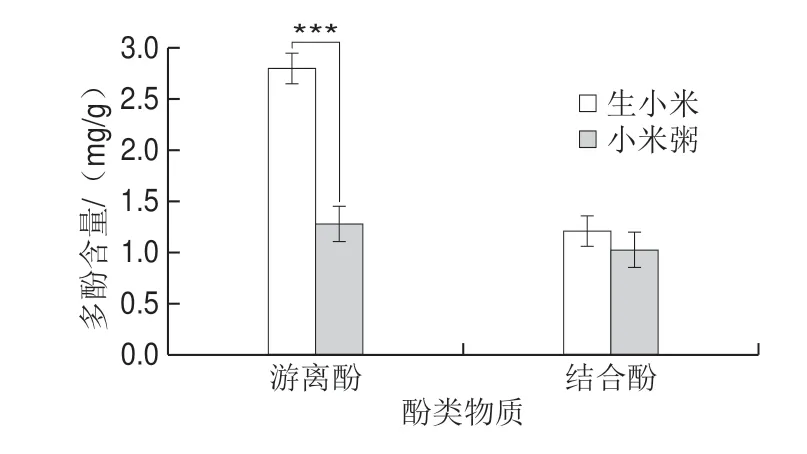
图5 小米粥游离酚和结合酚含量Fig.5 Free and bound phenolic contents of millet porridge
由图5可知,小米粥中游离酚损失率较高,差异显著,结合酚含量变化不显著。小米粥中游离酚和结合酚含量分别减少了53%和10%,这是由于游离酚不与大分子物质结合,结构不稳定,而结合酚通过碳碳双键、酯键或与细胞壁中木聚糖侧链上一些糖残基、结构蛋白、纤维素和果胶等大分子结合,结构稳定,不易被破坏,所以游离酚损失率高于结合酚,这与Chandrasekara等[24]的研究结果一致。食物中的结合酚在胃和小肠进行消化,再由结肠中微生物菌群发酵后释放,所以结合酚在体内发挥着重要的作用[25]。小米粥中结合酚含量下降不显著,说明小米经过煮制后结合酚在体内仍起到不可或缺的作用。
2.3 小米粥中游离酚和结合酚抗氧化能力
由表6所示,小米粥游离酚和结合酚DPPH自由基清除率分别为75.41%和56.54%,总抗氧化能力分别为14.72 U/mL和9.58 U/mL。与生小米游离酚相比,小米粥游离酚DPPH自由基清除率下降了2.2%,总抗氧化能力下降了1.91 U/mL。与生小米结合酚相比,小米粥结合酚DPPH自由基清除率下降了9.69%,总抗氧化能力下降了3.06 U/mL。Devi等[5]报道表明,小米DPPH自由基清除率大约为70%,与本实验得到的结果吻合。本实验使用的东方亮小米其结合酚的抗氧化能力低于游离酚的抗氧化能力。Kumari等[26]的研究表明,不同品种的小米,其游离酚和结合酚的抗氧化能力存在差异,例如:印度finger小米结合酚的抗氧化能力低于游离酚。Devi等[5]报道同样证明结合酚的抗氧化能力低于游离酚,与本实验的结果相同。小米粥中游离酚抗氧化能力变化不显著的原因可能是热处理引发的美拉德反应会导致新的物质形成,具有还原性和释放结合酚的能力,这也是小米粥结合酚抗氧化能力下降的原因。程安玮等[27]研究了豇豆、红小豆、绿豆和蚕豆4 种豆类中酚类化合物的抗氧化能力,小米和小米粥中多酚类化合物的抗氧化能力均高于这4 种豆类。尽管煮制后小米粥中多酚类化合物含量下降,但其抗氧化能力仍维持较高的水平,说明多酚类化合物在体内发挥着不可或缺的作用。

表6 小米粥中游离酚和结合酚抗氧化能力Table 6 Free and bound phenolic contents and antioxidant capacities in millet porridge
2.4 PCA结果
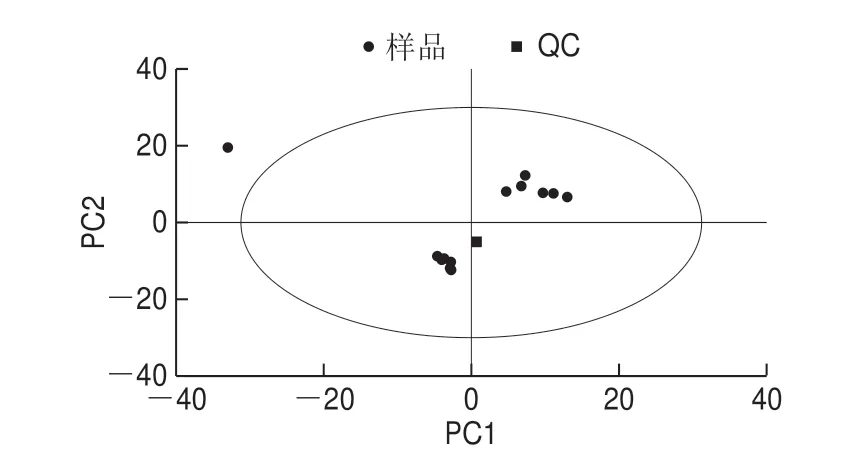
图6 生小米与小米粥PCA得分散点图Fig.6 PCA score scatter plot of raw millet and millet porridge
由图6可知,QC样本重合度较高,说明实验方法稳定性强、数据质量高。置信区间的右上角为小米多酚样本,左下角为小米粥多酚样本,说明小米经过煮制后样本之间存在显著差异。
2.5 小米粥中游离酚和结合酚组分鉴定
本实验定性出37 种多酚类化合物,包含24 种黄酮类化合物,其中7 种为异黄酮类化合物以及3 种为2-芳基苯并呋喃类黄酮类化合物;13 种酚酸类化合物,其中4 种为肉桂酸及其衍生物,具体信息见表7,这与Shahidi等[4]测定小米中酚类化合物的组成结果相似,但本实验更系统地定性出生小米及小米粥的组成成分。鼠曲草黄素、表儿茶素、光甘草素、peonidin 3-O-glucoside、金圣草黄素、芥子醇、香草酸、咖啡酸、丁香酸、间香豆酸、3,4,5-trimeth-oxycinnamic acid、芥子酸、大豆苷元、黄豆黄素、金雀异黄素、异黄樟素、胡椒醛、delphinidin-3-rutinoside和锦葵色素苷的含量均呈显著性差异。
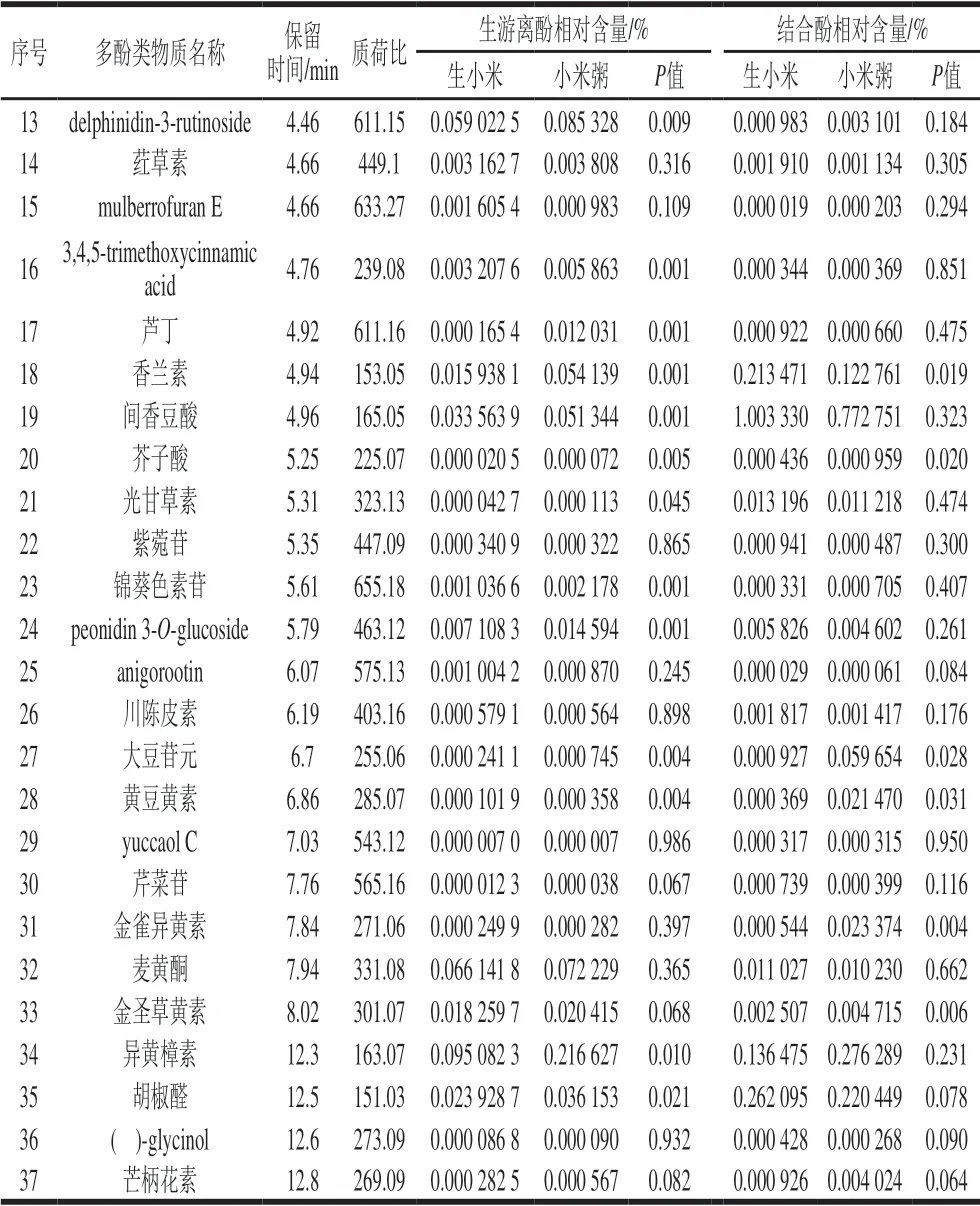
续表7
表儿茶素、香兰素、绿原酸、香草酸、芥子酸和芥子醇等酚类化合物相对含量较高,这与Hithamani等[28]的研究结果吻合。表儿茶素、绿原酸、芥子酸和香草酸为小米中主要的游离酚;而咖啡酸、间香豆酸为小米中主要的结合酚,Shahidi等[4]的研究得到同样的结果。香叶木苷、表儿茶素、川陈皮素等游离酚相对含量呈下降趋势[29],其原因可能是在煮制过程中部分游离酚被氧化,其次热处理后酚类物质因降解等原因可能会进入胚乳,与蛋白质等大分子形成复合物,从而使游离酚含量下降。有研究表明[30],表儿茶素可修复由幽门螺旋杆菌诱导的胃黏膜损伤。绿原酸、麦黄酮、间香豆酸等游离酚的相对含量呈上升趋势[31-32]。其原因可能是热处理破坏了结合酚的结构,促使结合酚转变成游离酚,提高了游离酚的含量,研究表明[33],绿原酸可以阻镉,阻止胃肠病变,从而保护肠道。荭草素、芦丁、香兰素等结合酚含量下降,出现这种趋势的原因可能是由于热处理破坏了包裹结合酚的酯键、碳碳双键等化学结构,或促使细胞壁组成中部分果胶或蛋白被溶解,从而释放食物基质中结合酚并促使其溶出,导致结合酚含量减少。研究表明[34],芦丁对胃和十二指肠溃疡的小鼠具有细胞保护和胃保护作用,芦丁还对乙醇相关的胃黏膜溃疡的修复起到重要作用。表儿茶素、芥子醇、咖啡酸、丁香酸、大豆苷元等结合酚的相对含量呈上升趋势,表明适当热处理会产生美拉德反应,可能会生成新的物质;其次,适当的热处理促使结合酚的半溶出,提高提取效率[35]。咖啡酸对胃肠炎病毒具有抑制作用,许多益胃、养胃的胶囊或冲剂中均含有咖啡酸。异黄樟素、金圣草黄素、大豆苷元、锦葵色素苷、香兰素、咖啡酸、香草酸等酚类化合物中游离酚和结合酚均呈上升趋势,其原因可能是煮制后部分可溶性结合酚游离出来,且适当的煮制和浸泡可以提高多酚的提取效率,致使其含量增加。川陈皮素、licoagrodin、环桑皮黄素等酚类化合物差异不显著,表明其热稳定性强于其他酚类化合物,其原因可能是此类化合物中含有苯环以及碳碳双键等稳定的化学结构。其次,苯酚上的羟基与多糖上的氧原子间会形成氢键,这种相互作用可以形成葡聚糖凝胶,提高多酚类化合物的稳定性。综上所述,煮制后部分多酚类化合物的含量呈现出显著差异,并且许多酚类化合物都具有养胃的功效。
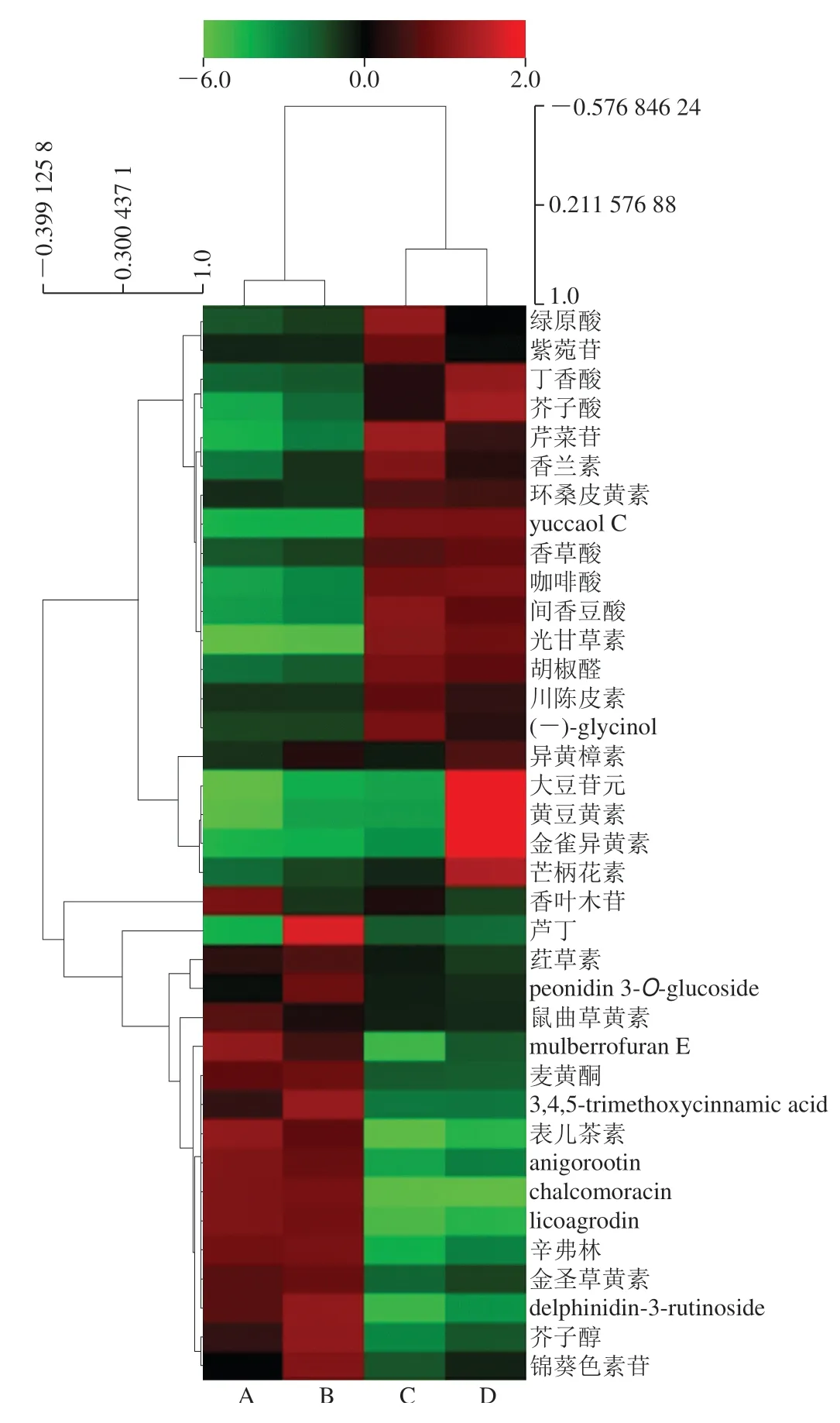
图7 生小米与小米粥差异组分层次聚类分析热力图Fig.7 Hierarchical clustering analysis heat map of differential phenolic components between raw millet and millet porridge
图7为生小米与小米粥差异组分层次聚类分析热力图。将差异组分的相对含量进行聚类,高低表达交互在一起,红色为高表达组分,绿色为低表达组分。表儿茶素、间香豆酸、辛弗林、咖啡酸、丁香酸等酚类化合物为高表达;yuccaol C、芹菜苷、芒柄花素和(-)-glycinol等为低表达;根据颜色变化差异得出绿原酸、紫菀苷、丁香酸、芥子酸、香木叶苷、芦丁、peonidin 3-O-glucoside、大豆苷元、黄豆黄素、金雀异黄素和鼠曲草黄素等物质存在极显著差异;香兰素、表儿茶素、香草酸、咖啡酸、间香豆酸等差异显著,这与表5结果相似。通过颜色深浅差异可知,游离酚变化差异大于结合酚,这表明小米经过煮制后游离酚含量变化显著,与图5结果相似。其中变化最显著的游离酚为芦丁、香木叶苷、peonidin 3-O-glucoside、鼠曲草黄素和锦葵色等。
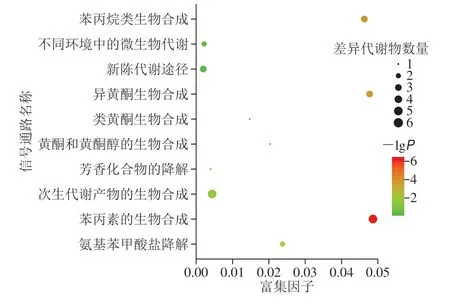
图8 小米粥差异组分代谢通路影响因子图Fig.8 Rich factors of metabolic pathways of differential phenolic components between raw millet and millet porridge
由图5及表7可以得出,煮制后小米籽粒中部分酚类化合物含量呈下降趋势。有研究表明[36],小米贮藏过程中若存在温度过高的现象,其籽粒中多酚类化合物的含量会相应减少。酚类化合物性质不是很稳定,当环境温度升高时,酚类化合物极易分解,所以本实验针对小米在生熟2 种状态下的差异组分进行KEGG富集分析,分析高温环境对小米中酚类化合物代谢通路的影响,以便为小米贮藏环境的选择提供参考。代谢通路富集分析结果以气泡图的形式展现,见图8。图中每个气泡代表一条代谢通路,共有10 个气泡,即在KEGG中查询到了10 个代谢通路,既有合成途径也有降解途径,分别为苯丙素的生物合成、异黄酮生物合成、苯丙烷类生物合成、氨基苯甲酸盐降解、次生代谢物的生物合成、黄酮和黄酮醇的生物合成、类黄酮生物合成、芳香化合物的降解、不同环境中的微生物代谢途径及新陈代谢途径。气泡所在横坐标和气泡大小表示该通路在拓扑分析中的影响因子大小,纵坐标和气泡颜色表示富集分析的P值(取负常用对数,即-lgP),颜色越深P值越小,富集程度越显著。其中苯丙素的生物合成途径、异黄酮生物合成途径、苯丙烷类生物合成途径气泡颜色较深,说明这些代谢途径受温度变化影响较大。

表8 差异组分参与的代谢途径Table 8 Metabolic pathways in which differential phenolic components are involved
由表8可知,涉及到这10 条代谢通路的差异组分有表儿茶素(C09727)、芥子醇(C02325)、咖啡酸(C01481)、大豆苷元(C10208)、金雀异黄素(C06563)、芥子酸(C00482)、香草酸(C06672)和金圣草黄素(C04293)。本实验通过KEGG富集差异组分得到的10 条代谢通路,其中部分代谢通路与高温环境下酚类化合物含量下降有关。因此在小米未经过加工处理前,使其保持良好的环境温度(尤其是夏季),以延缓酚类物质的代谢,尽可能将酚类化合物的含量维持在最高水平,同时保持功能因子的保健功效。
3 结 论
本实验通过单因素试验和正交试验得到小米粥最优煮制参数为煮制时间15 min、煮制功率700 W、料液比1∶25(g/mL)。煮制后小米粥游离酚DPPH自由基清除率下降了2.2%,总抗氧化能力下降了1.91 U/mL;小米粥结合酚DPPH自由基清除率下降了9.69%,总抗氧化能力下降了3.06 U/mL。通过Folin-Ciocalteu法测定游离酚和结合酚含量,结果表明游离酚比结合酚对煮制更加敏感,说明结合酚在体内可能起到更为关键的作用。通过植物广泛靶向代谢组学方法,定性分析出37 种多酚类化合物,其中鼠曲草黄素、表儿茶素、光甘草素、金圣草黄素等19 种酚类化合物均呈显著性差异。通过KEGG富集分析得到了10 个代谢通路。在定性检测出的37 种物质中,表儿茶素、芦丁、香兰素、咖啡酸、大豆苷元等研究较为广泛,但辛弗林、间香豆酸、环桑皮黄素、刺芒柄花素、鼠曲草黄素、荭草素等物质鲜有研究,甚至鲜少有人深入了解其结构及功能特性。但是,多酚类化合物作为小米粥中重要的保护肠胃功能因子,其研究价值不应被忽略。后续研究可对多酚类化合物进行分离纯化,对每一种多酚类化合物进行体内和体外功能特性的研究,例如:细胞抗氧化活性、修复被损伤的胃上皮细胞及动物实验等。从酚类化合物的角度阐明小米粥保护肠胃功能机制,筛选出高效、无毒害作用的功能因子,为功能性食品的开发提供理论依据。

