茅台镇不同主酿区域酱香型白酒酿造大曲中细菌菌群结构分析
任爱容,黄永光
(贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025)
中国传统白酒历史悠久且香型繁多,其中,以贵州茅台镇为主产区的酱香型白酒是中国传统白酒中酿造工艺最为复杂、风格最为典型的白酒香型之一[1]。而酱香白酒风格形成的关键之一是其酿造过程所使用的糖化发酵剂酱香大曲,即高温大曲。高温大曲是影响生产基酒出酒率和酒质的直接因素,通过利用一定粉碎度的纯小麦作为制曲原料,添加母曲、培养而成,制曲过程中曲胚发酵温度高达60~65 ℃,其高温发酵、培菌可实现制曲过程微生物菌群结构的演替和酶的有效富集,从而达到对原料降解、代谢发酵的作用[2-3]。其中包含的微生物种群主要有酵母菌、细菌、霉菌以及少量的放线菌[4]。细菌具有产酶和生香功能,对白酒风味的形成以及提供发酵动力具有重要的调控作用[1,5]。酱香型白酒酿造过程中的细菌主要来源于生产所用大曲、原料和环境等[6-8]。因此,对大曲中细菌菌群结构多样性及其组成的系统性研究和分析,有利于充分认识酿造微生物资源,解析酱香型白酒发酵机理,提高产品质量。
近年来,世界烈性酒核心产区茅台镇的酿造价值越来越被研究者所重视,特别是其生态效应和社会效应[9]。随着高通量测序技术的快速发展,其对酱香白酒酿造领域的应用也日益增多。如Xu等[10]通过高通量测序,在酱香型白酒大曲中发现芽孢乳杆菌科、链霉菌科、假单胞菌科、多孢放线菌科及柄杆菌科等细菌;郭敏等[11]采用高通量测序技术对3轮次和7轮次酿造酒醅中的细菌和真菌菌群结构进行比较研究,发现酱香型白酒发酵过程3轮次酒醅中乳杆菌属和芽孢杆菌属是原核微生物中绝对优势菌,7轮次酒醅中细菌优势菌属为盐单胞菌属,真菌优势菌属为隐球菌属。蔡雪梅等[12]对不同区域酱香型白酒人工窖底泥细菌多样性研究时,发现区域相近的二郎镇、习酒镇和茅台镇的窖底泥细菌菌群结构类似,其主要菌群包括变形菌门等;现有资料查阅结果表明,目前仍然缺乏对茅台镇酿造区域大曲细菌的系统性研究,对酱香型白酒酿造微生物动力来源及其调控机制仍然不清晰。加强对茅台镇酱香型白酒不同酿造区域生产大曲细菌菌群结构的研究是科学认识和揭示茅台镇区域化酿造酱香型白酒的酿造微生物资源特征及其应用调控的关键。因此,全面、系统地研究、认识茅台镇不同酿造区域生产大曲的微生物菌群结构,对酿造科学的认识和促进产业发展均有至关重要作用,而且迫在眉睫。
为揭示茅台镇酱香型白酒酿造体系的内在生态资源及其核心机制,解析不同区域酱香白酒酿造生产大曲发酵微生物之间的细菌菌群差异机制,本研究利用高通量测序技术对茅台镇主酿区域酱香型白酒酿造生产大曲样品(2018ü 2019酿造年度生产)的细菌菌群结构多样性及组成进行解析,旨在揭示茅台镇酿酒区域性细菌多样性的结构特征,为后续相关研究奠定基础,也为其酿造工艺优化及生产选址提供指导。
1 材料与方法
1.1 材料与试剂
样品取自贵州省仁怀市茅台镇观音寺区(1区域)、上坪村(2区域)、椿树村(3区域)、岩滩村(4区域)、向阳村(5区域)、卢荣坝村(6区域)及合马镇街道社区(7区域)共7 个酿造酱香型白酒的主要区域17 个代表性酿酒企业的7 个酿造轮次所生产应用的大曲(各企业采集大曲均为采样企业独立生产,并用于本企业的酱香型白酒基酒酿造)。取样时间为2018年1ü 9月,茅台镇酱香型白酒酿造1~7轮次生产期。每个企业样品采集的每次取样点固定为同一点。按照区域划分,将一个区域内所有酒厂相同轮次的大曲样品等量混合为一个区域的综合样(实验样品,代表一个区域的综合样品),共获取49 个综合样品。取样过程中,每个取样点从第1轮次到第7轮次均固定为同一点(每个取样点做有标记,以防被破坏),每轮次采集样品为2 d时间,采集样品均-80 ℃密封保存、备用。
DNA Marker、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、引物合成 上海生物工程股份有限公司;E.Z.N.A.®Soil DNA Kit 美国Omega BioTek公司;异丙醇(分析纯)、核酸电泳缓冲液 北京索莱宝科技有限公司;琼脂糖 南京生兴生物技术有限公司;Gengreen染料 上海赛百盛有限公司;rTaqDNA聚合酶试剂盒 北京全式金生物技术有限公司。
1.2 仪器与设备
Zealway G154DW高压蒸汽灭菌锅 致徽(厦门)仪器有限公司;台式高速冷冻离心机 德国Sigma公司;GeneAmp®9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;DYY-8C型电泳仪 北京六一仪器厂;JS-680C凝胶成像仪 上海培清科技有限公司;MiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 样品预处理
分别取最后充分混匀的综合样各16 g于100 mL离心管中,用30 mL灭菌后的0.1 mol/L PBS悬浮,加入3~5 颗玻璃珠,旋涡振荡7 min,400 r/min离心5 min,取上清液。沉淀用PBS洗涤,旋涡振荡4 min,400 r/min离心5 min,收集上清液。将沉淀用PBS洗涤,旋涡振荡2 min,400 r/min离心5 min,收集上清液。全部上清液于12 000 r/min离心5 min,弃上清液,收集细胞沉淀。
1.3.2 样品总DNA提取
预处理结束后即对各样品中的微生物总DNA进行提取,置于-20 ℃备用。提取步骤参见E.Z.N.A.®Soil DNA Kit的操作说明。
1.3.3 PCR扩增
所提基因组DNA的浓度和纯度符合测序要求的标准,通过Illumina MiSeq PE250平台进行高通量测序。用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对V3-V4可变区进行PCR扩增。扩增程序:95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s, 72 ℃延伸30 s),最后72 ℃延伸10 min。扩增体系为20 μL,4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶;10 ng DNA模板。
1.3.4 Illumina MiSeq测序
使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluor™-ST进行检测定量。根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE 2×300的文库,构建文库步骤:1)连接“Y”字形接头;2)使用磁珠筛选去除接头自连片段;3)利用PCR扩增进行文库模板的富集;4)氢氧化钠变性,产生单链DNA片段。利用Illumina公司的MiSeq PE300平台进行测序。
1.4 数据及图像处理
原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接:
1)设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,去除质控后长度低于50 bp的序列。
2)barcode需精确匹配,引物允许2 个碱基的错配,去除模糊碱基。
3)根据重叠碱基overlap将两端序列进行拼接,overlap需大于10 bp。去除无法拼接的序列。使用UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行可操作分类单元(operational taxonomic units,OTU)聚类;使用UCHIME软件剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,细菌比对silva128/16s_bacteria数据库。
4)采用Microsoft Office Excel 2016进行数据计算和分析。利用生信云平台(www.i-sanger.com)、R语言和AI作图工具绘制稀释曲线和堆积柱状图等。
2 结果与分析
2.1 微生物多样性分析
2.1.1 稀释曲线
应用稀释曲线分析比较测序数据量不同的样本中物种的丰富度,以说明样本的测序数据量是否合理[13]。7 个区域的7 个轮次共49 个样品的稀释曲线如图1所示。所有样品的序列数大于30 000,而且稀释度曲线趋于平台期,表明各样品测序数据量合理,测序深度满足测序和分析的要求,测序结果准确有效,可以充分反映样品的多样性。

图1 样品稀释曲线Fig.1 Rarefaction curves
2.1.2α多样性分析
α多样性是指一个特定区域或者生态系统内的多样性和群落的物种丰富度,常用Sobs指数、Shannon指数、Chao指数、覆盖率等评价数据结果[14]。其中,Sobs表示样本中观察到的物种数目;Shannon指数主要表示菌群多样性;Chao指数主要用于衡量物种的丰富度;覆盖率主要用于衡量测序深度。图2为各区域大曲样品的菌群多样性指数及其显著性分析(OTU水平)。

图2 各区域大曲菌群多样性指数及其显著性分析(OTU水平)Fig.2 Diversity indexes and significance analysis of bacterial community in Daqu from each brewing region at OTU Level
如图2A所示,在7 个区域的大曲样本中,各区域样品的Sobs指数差异显著,其中2区域的Sobs指数最高,即2区域观测到的物种数目高于其他区域;经t检验,1区域与2、3、4、7区域,2区域与6、7区域,3区域与7区域及4区域与7区域具有显著性差异(P<0.05,P<0.01),5区域和其他区域差异不显著。各区域的覆盖率均大于0.99,说明该信息足以揭示大多数样本的细菌菌群(图2B)。Shannon指数直观表明了各区域大曲细菌物种多样性,其中2区域的Shannon指数值最高,经t检验,2区域与1区域的大曲物种多样性具有显著性差异(P<0.01),其他区域无显著性差异(图2C),表明2区域的物种多样性高于其他区域。不同区域Chao指数存在差异,其中2区域的Chao指数最大,并与1、6和7区域具有显著性差异(P<0.05,P<0.01)(图2D),表明2区域大曲的物种丰富度较其他区域更高。此外,本研究同时针对此7 个区域的相同大曲样品进行了连续7轮次可培养细菌研究[7],通过对各区域大曲的可培养细菌数据统计发现,从1~7区域的可培养细菌菌群种类检出结果依次为21、25、21、24、24、23 种和20 种,由此表明,2区域大曲样品的可培养细菌种类高于其他区域,与高通量检测结果一致。
综上,运用α多样性分析结合可培养研究评价茅台镇的不同区域酱香型白酒酿造生产大曲的微生物多样性和物种丰富度。结果表明,茅台镇各主酿区域细菌多样性丰富,且不同区域细菌菌群结构多样性和物种丰富度均存在差异。
2.2 微生物菌群结构组成
2.2.1 细菌菌群门水平结构组成
为进一步确定各区域大曲具体的细菌菌群结构组成,将所有的OTU与数据库进行比对,选取置信度阈值,即相似度在97%以上的序列进行物种分类。在门水平上,各区域的细菌菌群结构组成如图3所示。
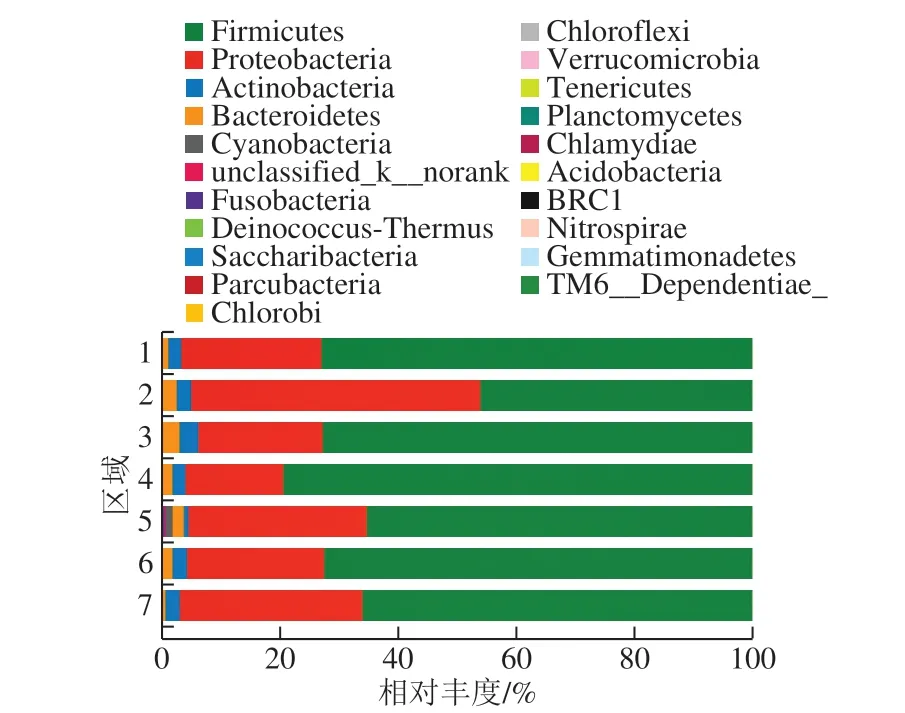
图3 各区域大曲细菌菌群结构(门水平)Fig.3 Bacterial community structure in Daqu from each brewing region at the phylum level
从茅台镇各主酿区的1~7区域酱香白酒酿造生产大曲中依次检出13、18、15、16、15、12 个和11 个门,共检出21 个门。7 个区域共有细菌门9 个,分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、Cyanobacteria、unclassified_k__norank、栖热菌门(Deinococcus-Thermus)、Saccharibacteria和梭杆菌门(Fusobacteria)。从各区域大曲细菌菌群结构可知(图3),茅台镇各主酿区大曲细菌以厚壁菌门、变形菌门、放线菌门和拟杆菌门为优势菌门,其中厚壁菌门和变形菌门为绝对优势菌门。戴奕杰等[15]从酱香白酒高温制曲、堆积发酵和窖池发酵中共检测出18 个细菌门,在细菌菌群数量及结构分布上均具有多样性,且优势菌门均为厚壁菌门、变形菌门、放线菌门和拟杆菌门;谭旭[16]从茅台镇赤水河水体中检出17 个细菌门,厚壁菌门、变形菌门、放线菌门和拟杆菌门为其水体中的优势细菌门类。文献查阅比较,本研究从茅台镇大曲中检出的细菌门类最为丰富,结合研究结果表明茅台镇酱香白酒产区整体微生物结构组成具有高度相似性。
由图3可知,1、3、4、5、6、7区域的大曲以厚壁菌门为第一绝对优势细菌门,其相对丰度高达64.99%~79.09%,以变形菌门为第二优势菌门,其相对丰度为16.47%~30.78%,二者相对丰度相差较大,相差值最小为34.96%(7区域),相差值最大可达62.63%(4区域);而2区域以变形菌门为第一绝对优势菌门,其相对丰度为48.96%,以厚壁菌门为第二绝对优势细菌门,其相对丰度为45.76%,二者相对丰度基本接近。郭敏[3]在研究传统和机械制曲过程的细菌群落结构过程时发现,厚壁菌门和变形菌门为其大曲的第一和第二优势菌门,厚壁菌门在制曲结束出房时相对丰度达到最大值(93.10%),相反,变形菌门在大曲入房时其相对丰度值最大(41.13%);本研究与其结论具有高度的一致性。然而,雷振河[17]采用高通量测序技术分析清香型白酒酿造微生物时发现,变形菌门和厚壁菌门仍然为其大曲中的优势细菌门,但其相对丰度之和低于30%;姚粟[18]在研究芝麻香型白酒高温大曲细菌菌群过程发现,变形菌门和厚壁菌门也是其大曲的优势细菌门,但其相对丰度之和低于25%。通过结合上述其他研究者和本研究结论可知,厚壁菌门和变形菌门不仅是酱香白酒酿造大曲中的优势微生物,也是其他白酒酿造用酒曲中的优势微生物,但酱香大曲在微生物组成上又有别于其他酒曲,是因为酱香白酒大曲优势微生物的种类和丰度远高于其他酒曲;而茅台镇各主酿区域大曲细菌菌群结构在门水平组成上无明显差异。
上述结果表明,茅台镇酱香型白酒高温大曲的细菌菌群在门水平上其数量及结构分布和组成上多样性特征明显,但其主导性细菌菌群基本一致。各区域优势菌门均为厚壁菌门、变形菌门、放线菌门和拟杆菌门。其中,厚壁菌门和变形菌门是其绝对优势微生物。进一步说明茅台镇主酿区域大曲微生物具有一定的共性和稳定性。
2.2.2 各区域细菌菌群结构的属水平组成
为更加深入揭示茅台镇各区域大曲的细菌菌群结构组成,对细菌菌群结构的属水平特征结构进行分析,并且将其平均相对丰度大于1%的细菌菌群结构组成进行分析,其结果如图4所示。

图4 各区域生产大曲细菌菌群结构(属水平)Fig.4 Bacterial community structure in Daqu from each brewing region at the genus level
从茅台镇1~7 个主酿区域生产大曲中依次检出272、354、314、302、320、255、228 个属,共检测出532 个属。从图4可知,在各区域丰度排前10 位的优势细菌属中,有6 个属在7 个区域中连续存在,分别是芽孢杆菌属(Bacillus)、慢生芽孢杆菌属(Lentibacillus)、克罗彭斯特菌属(K ro p p e n s t e d t i a)、泛生菌属(Pantoea)、大洋芽孢杆菌属(Oceanobacillus)和肠杆菌属(Enterobacter)。研究表明,芽孢杆菌属在多种香型白酒酿造过程中均有报道,是白酒发酵过程中主要的功能细菌菌属,可代谢产乙偶姻、4-甲基吡嗪等重要白酒风味物质[5],为大曲中关键核心微生物属;其他5 个细菌属在白酒酿造过程的具体功能尚未见报道,但其在茅台镇酿酒区域的出现范围广且丰度高,本课题组正在对其酿造功能等进行深入研究。
综上表明,在茅台镇各区域间,其主要核心菌属和优势菌属具有高度一致性,表明各区域间微生物存在一定的共性。在对此7 个区域的相同大曲样品进可培养细菌研究中发现,芽孢杆菌属不仅出现在大曲样品中,还出现在酿造环境样品样中[7];张亚丽[8]研究茅台镇空气微生物时,分离到了泛生菌属和肠杆菌属下的菌种;可见交错来往的地面环境和流动的空气环境是区域微生物互动的重要来源。另外,在研究酱香型白酒发酵酒醅细菌过程中发现,大洋芽孢杆菌属为其酒醅的核心微生物属[1,3];戴奕杰等[15]在研究酱香型白酒多样性时发现,肠杆菌属不仅存在于大曲中,还存在于糟醅中。由此可见,茅台镇各区域大曲通过自身发酵及其贮存,富集和网络环境的微生物,为后期酒醅的发酵提供了稳定的微生物来源基础,也使得茅台镇酱香白酒酿造具有了地域性特征。此外,本研究还发现,另外一些相对丰度大于1%的菌属具有重要的功能,为酱香白酒酿造提供了产酒增香的作用。如,魏斯氏菌属(Weissella)具有代谢产生乳酸、乙酸等有机酸类的功能[19],为白酒中重要风味物质的形成提供了前体,乳球菌属[20](Lactococcus)具有一定的氨肽酶活性和蛋白质水解力,乳杆菌属[21](Lactobacillus)在不同的发酵食品中能够贡献乙醇、乙酸、乳酸和其他重要风味物质,而这些物质可改变发酵过程中的生态环境,驱动菌群结构变化。另外,解硫胺素芽孢杆菌属[22](Aneurinibacillus)和鲁梅尔芽孢杆菌属[23](Rummeliibacillus)曾在四川浓香型白酒酿造窖泥和出窖糟醅中被检出,为好氧和兼性好氧菌,而本研究为首次在茅台镇酱香大曲中检出。同时,本研究还首次在酱香大曲中检出了摩根氏菌属(Morganella)、普劳斯氏菌属(Prauserella)、橄榄形菌属(Olivibacter)、库特氏菌属(Kurthia)、鲁梅尔芽孢杆菌属、两面神菌属(Janibacter)、巴尔通氏体属(Bartonella)、香味菌属(Myroides)、unclassified_o__Corynebacteriales和Parapusillimonas。
上述结果表明,茅台镇各酿造区域生产大曲中的细菌菌群种类丰富,为传统白酒酿造提供了产酒增香的功能作用,且在属水平上其核心细菌属和优势细菌属结构组成上具有高度的一致性,进一步说明茅台镇各区域间微生物具有良好的共性,为其微生态结构的稳定奠定了基础,也致使茅台镇具有产酱香白酒的整体优势。但实际生产中各区域酿酒质量却各有不同,因此,对各区域微生物的菌群结构差异分析,是揭示区域酿酒差异的重要着力点。
2.3 各区域微生物菌群结构差异
为进一步揭示茅台镇各区域细菌的菌群结构差异,针对细菌属水平进行ANOSIM分析、Adonis分析和主成分分析(principal component analysis,PCA),结果如表1、2和图5所示。

表1 组间相似性分析结果Table 1 Results of similarity analysis between groups
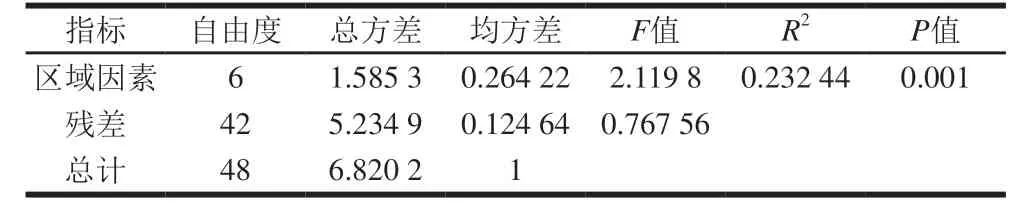
表2 Adonis结果Table 2 Adonis results
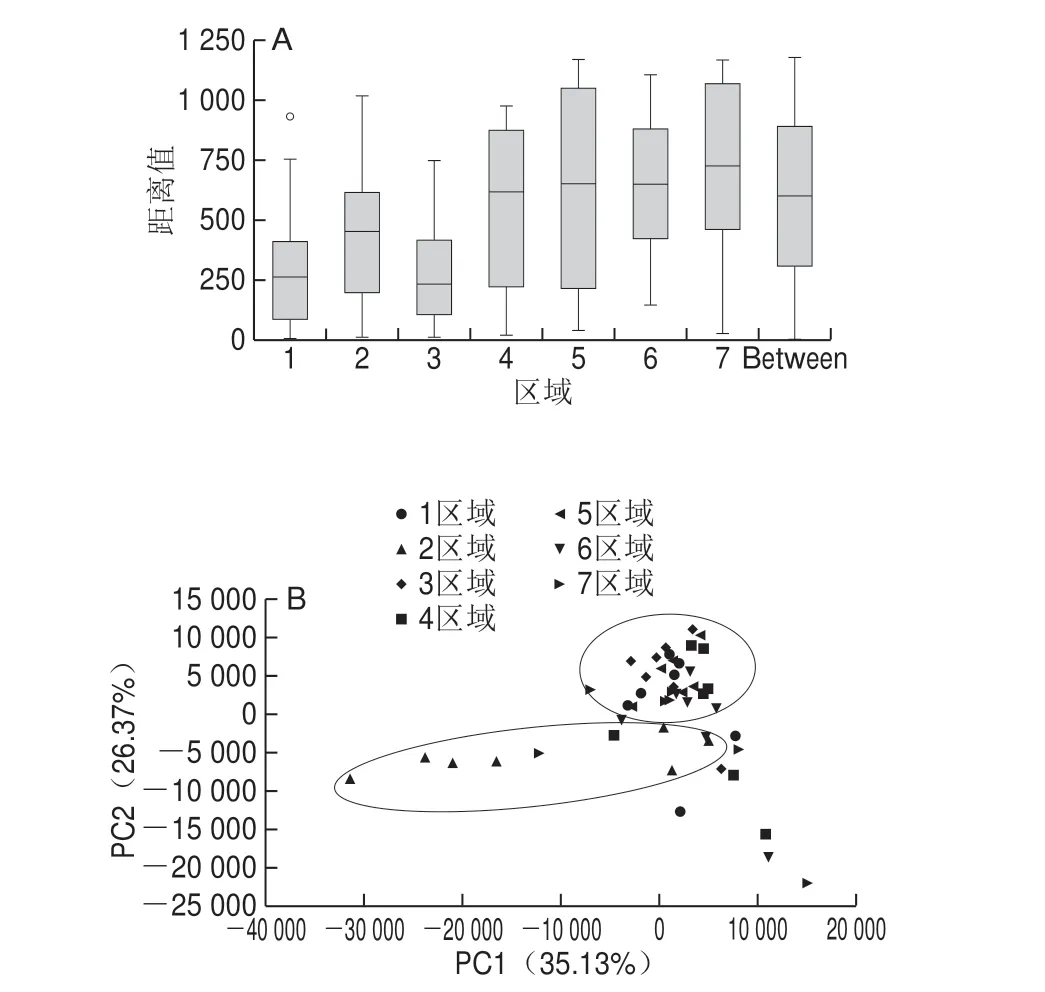
图5 各区域大曲细菌菌群差异性分析Fig.5 Analysis of differences in bacterial community structure in Daqu among brewing regions
由图5A可知,各区域内的各轮次大曲样品间的细菌菌群结构存在差异,且各区域轮次间的差异程度有所不同,结合表1、2分析,其Statistic值为0.162 6,P值为0.001,Adonis的结果中R2为0.232 44,P<0.05,表明各区域的组间微生物差异显著大于组内微生物差异,且本次差异分析结果可信度高。
为更加明确各组间细菌菌群的具体差异程度,对各区域进行PCA。如图5B所示,7 个区域基本可聚为2 类,1、3、4、5、6区和7区域聚为一类,2区域单独聚为一类。表明2区域的细菌菌群结构与其他区域有明显差异。其原因可能与2区域离集镇和市区较远,其微生物环境受人类活动影响较小,从而导致2区域细菌种类更为丰富,为大曲长期网络及驯化细菌菌群提供了基础。结合图3,分析各区域在细菌门水平上的具体差异可知,2区域的特有菌门(1 个)为TM6__Dependentiae_,5区域的特有菌门(2 个)分别为Parcubacteria和硝化螺旋菌门(Nitrospirae),其中硝化螺旋菌门对处理高强度有机废水具有关键作用[24],TM6__Dependentiae_和Parcubacteria功能作用尚未见报道;其他区域均无特有细菌门。在属水平上,如图4所示,当相对丰度大于1%时,各区域无特有菌属。
本研究通过对微生物多样性分析,可知茅台镇酿造区域的细菌存在多样性差异,但在分析各区域丰度较高且具有重要作用的菌属组成时,发现无显著差异,于是把各区域相对丰度大于0.1%的细菌属进行比较后发现,2区域特征性菌属(2 个)为克雷伯氏菌属(Klebsiella)和橄榄形菌属;3区域特征性菌属(1 个)为Anaerosalibacter;5区域特征性菌属(12 个)分别为Propionigenium、norank_c__Cyanobacteria、赤杆菌属(Erythrobacter)、席藻属(Phormidium)、unclassified_f__Rhodobacteraceae、Rubidimonas、unclassified_f__Erythrobacteraceae、Rubrivirga、厚皮藻属(Pleurocapsa)、Jannaschia、Lewinella和Loktanella;6区域有特征性菌属(7 个)分别为普氏菌属(Prevotella_9)、Apibacter、norank_f__Bacillaceae、norank_f__Enterobacteriaceae、Enterococcus、Sebaldella和norank_f__Bacteroidales_S24-7,其他区域无特有菌属。其中,克雷伯氏菌属具有产α-L-鼠李糖苷酶和植酸酶的功能,具有降解原料和发酵生香的作用[25-26];Propionigenium可在发酵代谢产生丙酸[27],增加白酒中酸的种类,丙酸呈现酸中带甜,少量可使酒体更柔和;赤杆菌属和席藻属具有降解物质的功能[28-30];Loktanella为产红色素海洋杆菌,发酵可产生天然红色素[31]。由此表明,丰度较小的菌属对白酒酿造仍具有一定的功能作用,而这些为各区域所特有的丰度较小的菌属极有可能是造成茅台镇各区域酱香型白酒酿造存在差异的重要原因。而2区域细菌菌群结构之所以有别于其他区域,一方面是其物种丰富度高于其他区域,另一方面则可能是更小丰度水平上存在有其他区域没有的功能菌群。
综上可知,茅台镇不同主酿区域细菌菌群结构组内差异小于组间差异,而组间差异的重要原因是由低丰度细菌功能菌群组成的不同所造成,进一步说明在以后研究中除丰度较大且出现频率较高的菌群值得关注外,低丰度的功能菌群也应是研究重点。
3 结 论
本研究通过高通量测序技术结合数理分析方法系统性研究了2018ü 2019年度茅台镇酱香型白酒不同酿造区域生产大曲中的细菌菌群结构特征,共检出细菌21 个门和532 个属。首次在酱香大曲中检出了解硫胺素芽孢杆菌属、鲁梅尔芽孢杆菌属、摩根氏菌属、普劳斯氏菌属、橄榄形菌属、库特氏菌属、两面神菌属、巴尔通氏体属、香味菌属、unclassified_o__Corynebacteriales和Parapusillimonas。研究发现,不同区域大曲中的细菌多样性丰富且存在差异,但各区域在丰度较高的优势细菌门、优势细菌属及核心细菌属的群落结构组成上具有高度的相似性。其优势细菌门为厚壁菌门、变形菌门、放线菌门和拟杆菌门,优势细菌属为慢生芽孢杆菌属、克罗彭斯特菌属、泛生菌属、大洋芽孢杆菌属和肠杆菌属,关键核心细菌属为芽孢杆菌属;区域间微生物存在良好的互动性和稳定性,使茅台镇有了稳定的微生态结构,成为产酱香型白酒最佳产地的重要原因之一。各区域内的不同轮次生产大曲中细菌菌群差异小于区域间菌群差异,而区域间的细菌菌群结构差异主要集中在丰度较小的功能菌群上。本研究在对相对丰度极大的细菌分析后,对相对丰度大于0.1%的细菌菌群仅进行了较为粗略的分析,因此,在本研究基础上后续工作将对相对丰度较小的菌群进行更加详细的系统性跟踪监测,进一步调查茅台镇不同主酿区更细致的微生态系统信息。本研究结果揭示了茅台镇不同酿造区域生产大曲中的细菌菌群结构,为后续相关研究提供了新的视角和基础,也为酱香型白酒生产工艺优化及生产选址提供了参考和指导。

