复合抗氧化剂对冻藏大黄花鱼片品质的影响
卿明民,陈 朋,臧静楠,祁腾达,谢政泽,尚宏丽
(锦州医科大学食品科学与工程学院,辽宁 锦州 121001)
大黄花鱼是我国传统四大海产之一,其肉质鲜美,深受广大消费者喜爱。鱼类的保鲜方法主要有低温保藏、气调保藏、化学和酶法保藏等,其主要机理是防止鱼体接触大量的微生物而发生腐败变质[1]。随着储藏时间的延长,鱼肉中含有的不饱和脂肪酸会分解,产生游离脂肪酸,对其品质和营养价值产生明显的影响[2]。脂肪氧化后的一些产物又能使蛋白质发生氧化变性[3]。蛋白质的变性会致使鱼肉中蛋白的乳化性、溶解度、蛋白疏水性和凝胶性改变,导致其原来特有的营养价值损失[4]。因此,有效地抑制冻藏过程中鱼肉的氧化,将对鱼肉品质的提升有着至关重要的作用。
抗氧化剂能够明显地抑制脂肪的氧化[5],而化学抗氧化剂的安全性备受质疑[6],天然抗氧化剂是目前的主要研究方向。付丽等[7]用不同浓度的茶多酚处理冻藏牛肉丸,发现0.5%的茶多酚对肉丸的抗氧化效果较好。赵艳芳等[8]利用天然抗氧化剂优化了鲐鱼的储藏加工条件。复合天然抗氧化剂的协同作用在抑制冻藏水产品的脂肪氧化方面效果明显,为了全面提升冻藏大黄花鱼品质,本研究选用VE、茶多酚和异抗坏血酸钠3 种抗氧化剂对冻藏大黄花鱼进行协同作用,利用响应面试验优选出复合抗氧化剂配方,用扫描电镜对复合抗氧化剂的效果进行验证,拟为抗氧化剂在大黄花鱼冷冻储藏加工中的应用提供理论支持。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
大黄花鱼每条规格为:(350±50)g,购于锦州市石桥子早市;水溶性VE、茶多酚、异抗坏血酸钠,食品级,均为河南瑞仁生物工程有限公司产品;考马斯亮蓝法蛋白含量测定试剂盒,上海语纯生物科技有限公司产品;2-硫代巴比妥酸、仲钼酸铵((NH4)6MO7O24·4H2O)、马来酸、三磷酸腺苷二钠(ATP)、Elon(硫酸-P甲胺酚)、浓硫酸、KH2PO4、HClO3、NaHSO3等试剂均为分析纯,国药集团试剂有限公司产品。
1.1.2 仪器与设备
TMS-PRO 质构仪,GL-21M 型高速冷冻离心机,FESEM JEOL 6700F 扫描电子显微镜(SEM),T18 基本型分散机。
1.2 方法
1.2.1 样品预处理
鲜活大黄花鱼放入装有冰块的保温箱,迅速运到实验室,去除鱼头、鱼鳞及内脏,用蒸馏水洗净后切片,每片约70 g,切片厚度约8 mm,长约80 mm,宽约40 mm。将切好的鱼片置于各抗氧化剂溶液中浸泡1 h,各抗氧化剂添加量见表1,将蒸馏水浸泡处理1 h的大黄花鱼肉设置为对照组(CK),以自封袋分装并迅速置于-20 ℃冰箱内,冻藏35 d 后,取出鱼片进行各项指标的测定。

表1 3 种天然抗氧化剂的添加量Table 1 Additions of three natural antioxidants
1.2.2 测定项目与方法
1.2.2.1 硬度
参考李鹏鹏等[9]的方法,在鱼肉冻藏35 d 后,采样于5 ℃的冷藏箱中,待鱼肉中心温度达到4 ℃时用质构仪进行硬度测定。测定参数:直径5 mm 的通用柱形探头P/5,下降速率3 mm/s,测试时速率1 mm/s,测试后返回速率1 mm/s,形变程度50%,测定时停留5 s,触发力5 g。运用质构仪搭载的配套数据处理软件进行数据采集。
1.2.2.2 持水性
取3 g 大黄花鱼肉,称取质量记为m1,用双层滤纸包裹,在4 ℃、5 000 r/min 条件下离心,称取离心后的滤纸质量为m2,鱼肉持水性(W)[10]计算公式为:
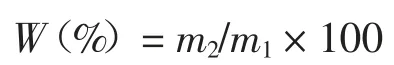
1.2.2.3 Ca2+-ATPase 活性
参考曹淑敏等[11]的方法,并稍作修改。按表2 进行反应体系配制,25 ℃水浴10 min,加入1 mL 15%三氯乙酸使反应终止,将所得反应液离心5 min(6 500 r/min,4 ℃),取上清液1mL 于试管,依次添加1.0mL 硫酸钼酸溶液(先将70 mL 浓硫酸加入434 mL 水中制成溶液,再称取12.5 g(NH4)6MO7O24·4H2O,0.5 mL Elon 试剂(3 g NaHSO3溶解于97 mL 水中,再加入1 g Elon 溶解),2.5 mL 蒸馏水,充分振荡,室温下45 min 发色后,在吸收波长640 nm 处测定吸光值A。然后将预先在100 ℃干燥1 h 后置于干燥器中干燥冷却的KH2PO4用5%HClO3溶解,配成0.5 mmol/L 的溶液作标准曲线。空白组在反应体系配制时,先加入TCA,再加入ATP 溶液,测得空白组吸光度值B。求出1 mg 蛋白质在1 min 内产生无机磷量。计算公式为:式中:X为Ca2+-ATPase 活性,μmol·(mg·min)-1;A为样品组产生磷酸量,μmol;B为空白对照产生磷酸量,μmol;t为反应所用时间,min;m为1 mL 反应液所含酶的质量,mg。
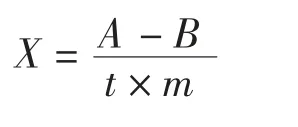

表2 Ca2+-ATPase 活性反应体系Table 2 Reaction medium for investigating activity of Ca2+-ATPase
1.2.2.4 硫代巴比妥酸值(TBARS 值)
参考Witte 等[12]的方法,略有修改。取10 g 搅碎均匀的冻藏鱼肉,加入低温三氯乙酸溶液40 mL(质量分数5%),均质1 min(转速13 800 r/min),静置30 min,过滤,用三氯乙酸溶液(质量分数5%)将所得滤液定容至50 mL。取5 mL 上清液于比色管,再加入5 mL 硫代巴比妥酸溶液(0.02 mol/L),封口,置于90 ℃恒温水浴中振荡40 min 后冷却至室温。以加入5 mL 蒸馏水为对照组,在538nm 处测定吸光度(A538)。

式中:A538为所测样品吸光度;V为样品体积,mL;M为丙二醛的分子量72.063;ε 为摩尔吸光系数156 000;1 为光程,cm;m为样品质量,g;1 000 为换算系数。
1.2.3 响应面试验设计
在单因素试验的基础上,选择茶多酚(A)、VE(B)、异抗坏血酸钠(C)为响应因子,以TBARS 值为响应值,选用Design Expert 8.0 设计响应面试验,试验因素水平见表3。
1.2.4 扫描电镜分析
将每组样品解剖纵切,取0.5 cm×0.5 cm×0.5 cm鱼背肉,样品放入pH 7.4 的2.5%戊二醛溶液中,于4 ℃冰箱冻藏12 h,磷酸缓冲液冲洗3 次,使用1%锇酸固定,将其置于4 ℃冰箱内再固定2 h,再用磷酸缓冲液冲洗3 次。经过50%~100%乙醇逐级脱水,醋酸异戊酯置换,常规临界干燥以及真空离子镀膜后用扫描电镜观察拍照。
1.2.5 数据处理
采用Origin 8.0 及Design Expert 8.0 和SPSS 19.0软件对数据进行统计分析,显著性水平设置为P<0.05,每组样品至少进行3 次平行试验。
2 结果与分析
2.1 硬度变化
硬度是评价鱼肉品质的重要指标,硬度过低会导致鱼肉口感不佳。由图1 可知,茶多酚添加量0.4%时,鱼肉硬度显著高于VE 和异抗坏血酸钠处理组(P<0.05),说明茶多酚能够有效抑制在冷冻环境下鱼肉硬度的下降,这可能是因为茶多酚所含的多羟基结构阻碍鱼肉脂肪氧化,进而延缓肌原纤维蛋白的变性,但随后鱼肉硬度呈下降趋势,表明茶多酚在一定条件下会起到促氧化作用,这与Jongberg 等[13]研究发现绿茶提取物在巯基氧化生成二硫键中有促氧化作用一致。随着VE 添加量增加,鱼肉硬度增长缓慢;而随着异抗坏血酸钠添加量的增加,鱼肉硬度增长不显著。

图1 不同添加量的抗氧化剂与大黄花鱼片硬度的关系Fig.1 Relationships between different concentrations of antioxidants and hardnesses of Larimichthys croceas fillets
2.2 持水性变化
由图2 可见,茶多酚添加量为0.4%时,鱼肉持水性最佳,且显著高于对照组(P<0.05),研究者Siddaiah等[14]和Farouk 等[15]指出鱼肉持水性的下降是由于蛋白质变性促使肌球蛋白和肌动蛋白结合增加,进而导致持水性下降,添加茶多酚后持水性有所提升,原因可能是茶多酚通过阻碍脂肪氧化来降低蛋白质变性程度,但添加量大于0.4%时,对应鱼肉持水性呈下降趋势,表明茶多酚的添加需要有一定限度。VE 添加量0.6%时的持水性与对照组差异不显著,VE 对持水性的提升作用可能与其对细胞膜修复作用有关。异抗坏血酸钠添加量为0.3%时,鱼肉持水性显著高于对照组(P<0.05)。
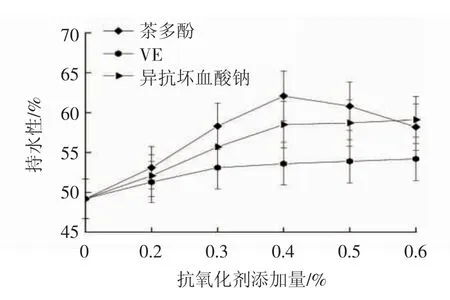
图2 不同添加量的抗氧化剂与大黄花鱼片持水性的关系Fig.2 Relationships between different concentrations of antioxidants and water holding capacities of Larimichthys croceas fillets
2.3 Ca2+-ATPase 活性变化
由图3 可知,茶多酚添加量为0.2%时,Ca2+-ATPase活性显著高于对照组(P<0.05),茶多酚添加量为0.4%时,Ca2+-ATPase 活性最高,其活性越低则鱼肉中肌原纤维蛋白的变性程度就越大[16],相关研究指出茶多酚在适宜浓度下能抑制黄花鱼片脂肪氧化[17],但随后曲线开始下降,其原因可能是高浓度茶多酚对蛋白酶起到一定抑制作用[18],降低了鱼肉的Ca2+-ATPase活性。VE 添加量为0.3%时,Ca2+-ATPase 活性显著高于对照组(P<0.05),随后上升趋势变缓,Saeed 等[19]将一定量的VE 加入到碎鱼肉中,发现其可提高鱼肉的肌原纤维蛋白Ca2+-ATPase 活性,但VE 添加量为0.2%时的Ca2+-ATPase 活性与对照组酶活相比无显著差异,可能是因为低浓度的VE 抑制脂肪氧化能力不强,导致脂肪氧化产物与肌原纤维蛋白之间作用未被有效阻止,蛋白变性程度继续增大,Ca2+-ATPase 活性降低。异抗坏血酸钠添加量为0.6%时,鱼肉的Ca2+-ATPase 活性最大,且显著高于对照组(P<0.05)。陈洪生等[20]认为,异抗坏血酸钠的抗氧化作用很强,可通过有效抑制脂肪氧化,减少脂肪氧化产物对肌原纤维蛋白产生的影响,从而提高Ca2+-ATPase 活性。
2.4 TBARS 值变化
由图4 可见,随着茶多酚添加量的增加,对应曲线呈现先迅速下降后缓慢上升的趋势,在添加量为0.4%时,鱼肉TBARS 值显著低于对照组(P<0.05),可能是因为茶多酚清除多元不饱和脂肪酸自由基、单线态氧[21-23],阻碍脂肪氧化所发生的链式反应,达到抗氧化作用,随后曲线上升趋势变缓,可能是因为茶多酚添加量过高对于某些抑制脂肪氧化的反应起到了反作用,导致抗氧化效果下降。VE 添加量为0.3%时,鱼肉的TBARS 值显著低于对照组(P<0.05),但添加量0.3%~0.6%之间无显著差异。异抗坏血酸钠添加量为0.4%时,鱼肉的TBARS 值显著低于添加量为0.2%时的TBARS 值(P<0.05),但添加量大于0.3%的各组之间无显著差异,说明异抗坏血酸钠为0.4%时,即能起到有效的抗氧化作用。
2.5 响应面试验结果
2.5.1 响应面试验方案及结果根据单因素试验结果,采用响应面法对复合抗氧化剂配比进行优化,试验方案及结果见表4。
2.5.2 回归模型的建立及方差分析
对表4 中的数据完成多元线性回归拟合,得到冻藏期间大黄花鱼片TBARS 值与各天然抗氧化剂用量的二次多项回归方程为:
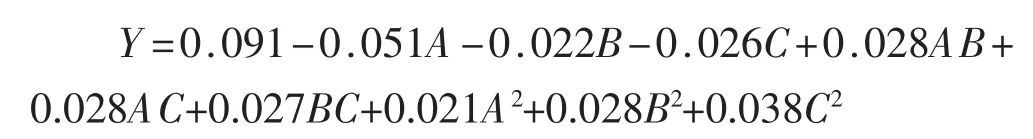

表4 响应面试验设计及结果Table 4 Response surface experimental design and results
系数绝对值的大小表示各响应因素对响应值TBARS 值的影响程度,其正、负代表影响方向[24],该多元线性回归方程的方差分析见表5。

表5 响应曲面二次回归模型的方差分析Table 5 Analysis of variance for the fitted response surface model
由表5 可知,模型项P值为0.001 2,小于0.01,说明该试验选用的模型极显著,方差的拟失项P值为0.107 2,大于0.05,不显著,表明回归模型拟合较好,该模型可用于试验结果的统计分析,R2=0.999 8,说明该模型的预测值与实测值之间有较好的相关性[25]。3 个因素中一次项A、C及二次项C2对响应值(TBARS 值)影响达极显著水平(P<0.01);一次项B、二次项B2及交互项AB、AC、BC对响应值(TBARS 值)的影响达显著水平(P<0.05);A2项对响应值影响不显著。这说明茶多酚、VE 及异抗坏血酸钠用量均显著影响冻藏大黄花鱼的TBARS 值。由F值可得,各因素对TBARS 值影响的主次顺序为:茶多酚>异抗坏血酸钠>VE,茶多酚与VE、茶多酚与异抗坏血酸钠、VE 与异抗坏血酸钠之间均存在协同增效作用,它们对TBARS 值的影响主次顺序为:茶多酚×VE>茶多酚×异抗坏血酸钠>VE×异抗坏血酸钠。
2.5.3 因素间的交互作用分析
为进一步研究各因素间的协同作用,通过回归方程来绘制茶多酚、VE、异抗坏血酸钠对TBARS 值影响的响应面图和等高线图(图5)。陡峭的响应曲面图代表响应值很大程度上受该因素的影响,反之影响不大[26],呈椭圆形的等高线图代表两个因素之间的相互作用强,反之则弱[27]。如图5 所示,从响应面图可以直观看出茶多酚对大黄花鱼的TBARS 值影响最大,其次是异抗坏血酸钠,VE 的影响最小;3 个等高线图均呈现一定程度的椭圆形,图5a2中等高线的椭圆形状最明显,表明茶多酚与VE 之间存在明显的交互效应;图5b2中等高线形状也呈椭圆,虽椭圆形状较图5a2弱一些,但也表明茶多酚与异抗坏血酸钠之间有明显的交互作用;图5c2中等高线呈现完整椭圆形,表明VE 与异抗坏血酸钠之间也存在交互作用。可见茶多酚、VE、异抗坏血酸钠3 种天然抗氧化剂两两之间存在交互作用,如将三者复合将对鱼肉品质提升有更优效果。

图5 各因素间的交互作用对大黄花鱼片TBARS 值影响的响应面图及等高线图Fig.5 Response surface graphs and contour maps showing the interactive effects of various factors on TBARS values of Larimichthys croceas fillets
2.5.4 复合抗氧化剂配比优化及验证性试验
根据回归模型分析可知,TBARS 值为0.0595mg/kg工艺最优条件为:茶多酚添加量0.40%,VE 添加量0.29%,异抗坏血酸钠添加量0.30%,做3 次平行试验TBARS 值为0.061 3 mg/kg,与理论值0.059 5 mg/kg接近。说明该模型能较好地预测实际TBARS 值。
2.6 扫描电镜结果分析
大黄花鱼在冻藏过程中表面三维结构的变化可以利用具有高分辨率扫描电子显微镜观察,其中鱼肉肌肉纤维结构变化是扫描电镜使用电子束扫描鱼肉样品的检测指标。如图6a 所示,新鲜大黄花鱼背肉的组织结构通过扫描电镜观察,肌肉排列整齐,肌肉组织保持明显和均匀的明暗相间的条纹结构,肌浆网结构完整,说明新鲜鱼肉的肌肉质地非常好,组织结构完整,未受到任何损伤。如图6b 所示,未添加抗氧化剂的冻藏35 d 的大黄花鱼组织结构通过扫描电镜观察可以看到,大黄花鱼背肉肌肉排列杂乱无章,肌肉组织明暗相间的条纹结构彻底消失,这说明未添加抗氧化剂冻藏35 d 的大黄花鱼肌肉组织结构受到了严重的破坏和损伤。如图6c 所示,添加最优组合抗氧化剂的冻藏35 d 的大黄花鱼组织结构通过扫描电镜观察可以看到,大黄花鱼背肉肌肉排列只有较小的变化,肌肉组织依然保持着较均匀的明暗相间的条纹结构,这说明添加了最优组合抗氧化剂的冻藏大黄花鱼肉组织结构只受到了较少破坏,复合抗氧化剂对冻藏大黄花鱼具有很好的保护效果,抑制了鱼肉品质变坏,对冷冻鱼肉的氧化变性起到了积极的抵抗作用。

图6 各组黄花鱼样品扫描电镜结果Fig.6 Scanning electron microscopy results of Larimichthys croceas in each group
3 结论
通过单因素试验确定茶多酚、VE 及异抗坏血酸钠的较优抗氧化浓度范围,在所选浓度范围中,以TBARS 值为响应值,对茶多酚、VE、异抗坏血酸钠进行响应面法优化抗氧化剂的复配,得到最优复合抗氧化剂配方为:茶多酚添加量0.40%,VE 添加量0.29%,异抗坏血酸钠添加量0.30%,此时TBARS 值为0.061 3 mg/kg。利用扫描电镜分析发现,大黄花鱼肉用该复合抗氧化剂溶液浸渍处理后,能明显减少其因冻藏引发的肌肉纤维结构损坏,且能有效抑制其因脂肪氧化引发的组织损伤,表明该复合抗氧化剂能有效提升大黄花鱼冻藏品质。

