新冠疫情下探讨湿热和紫外消毒对血药浓度检测的影响
陈和莉,陈 巧,刘 芳,戴 青,刘职瑞
(1.陆军军医大学第一附属医院 药剂科,重庆 400038;2.陆军特色医学中心图书馆,重庆 400042)
医务人员是救治新型冠状病毒(国际病毒分类委员会命名为SARS CoV 2)感染肺炎的主力军,但医务人员发生感染的情况不容乐观[1]。2020年2月29日,中国 世卫组织联合专家考察组发布报告称,全国476家医疗机构共有2 000多名医务人员感染新冠肺炎。因此,有效降低医务人员感染性职业暴露具有十分重要的现实意义。
在抗击新冠疫情的医务人员中,除了战斗在最前线的临床医师和护士外,深度参与诊疗活动的药师特别是治疗药物监测(therapeutic drug mo nitoring,TDM)检测人员同样面临着感染SARS CoV 2的风险[2]。国家卫健委印发的《新型冠状病毒肺炎诊疗方案(试行第七版)》明确指出,SARS CoV 2的主要传播途径为呼吸道飞沫和密切接触传播,此外在相对封闭的环境下长时间暴露于高浓度气溶胶也存在经气溶胶传播的可能。外周静脉血是TDM最常用到的生物样本,检测人员虽按规定采取了一定的个人防护措施,但若与感染者的血样直接接触或误吸入血样经涡旋或高速离心后产生的气溶胶[3]将极大地增加感染风险。传统的TDM通常采用直接测定的方式,并未对血样进行消毒,然而由于无症状感染者的存在,医院虽对就诊患者的流行病学史进行了初步筛查,但患者的血样仍可能含有达到传播水平的SARS CoV 2,因此有必要在TDM检测前对外周血进行消毒以减少检测人员的职业暴露。
目前研究显示,SARS CoV 2对热和紫外线敏感,56℃高温和紫外消毒30 min可将其有效灭活[4-5]。但热和紫外消毒是否影响血药浓度测定以及检测结果是否具有一致性尚不清楚,国内外也无相关报道。
鉴于此,本团队选取了TDM常测的6种药物(他克莫司、西罗莫司、环孢素、万古霉素、丙戊酸和霉酚酸)作为研究对象,系统考察了湿热和紫外消毒对血药浓度测定的影响,以期为疫情期间TDM检测提供参考。
1 实验材料
1.1 药品和试剂
他克莫司、西罗莫司、环孢素、万古霉素、丙戊酸和霉酚酸试剂盒 (批号分别为8R018UL M2、8S018UL M3、6R038UL M1、4W018UL M3、4G018UL M2、6R818UL M1),定标品(批号分别为8R109UL M2、8S109UL L2、6R119UL L1、4W109UL M1、4G109UL M1、6R929UL L1),他克莫司\西罗莫司 \环孢素全血复合物质控品(批号为73101、73102、73103),霉酚酸质控品(批号为6R696UL M1),他克莫司\西罗莫司样本处理液(批号:8S078UL M1),特异性环孢素样品处理液(批号:6R708UL M1)均购自美国西门子公司;万古霉素\丙戊酸复合质控品(批号为40381、40382、40383)购自美国Bio rad公司;甲醇(分析纯,批号为20170101)购自重庆川东化工集团有限公司。
1.2 仪器
Viva E全自动生化分析仪及Syva血药浓度检测系统(美国西门子);XW 80A涡旋混合仪(江苏其林贝尔);HC 2518高速离心机(安徽中科中佳);TDZ4 WS低速离心机(湖南湘智);HSG IIB 6电热恒温水浴锅(上海仪表);SW CJ 2FD超净工作台(江苏安泰)。
2 实验方法
2.1 样本采集和消毒
考察的6种药物的检测样本分为全血(他克莫司、西罗莫司和环孢素)和血浆(万古霉素、丙戊酸和霉酚酸)。采集150例(每种药物各25例)患者外周静脉血3~4 mL,置于EDTA K2抗凝管中,其中血浆在4 000 r·min-1下离心5 min后获得。全血/血浆样本用EP管均分3份后进行不同的处理,湿热组采用56℃水浴30 min消毒,紫外组置于超净工作台用紫外灯(254 nm,8 W)照射30min消毒,对照组不做消毒处理。
2.2 样本前处理
湿热组样本在前处理前确保已冷却至室温。全血处理方法:①他克莫司和西罗莫司:将全血涡旋混匀30 s,取200μL置于EP管中,依次加入200μL甲醇和50μL他克莫司/西罗莫司样本萃取液,涡旋振荡1 min,放置2 min使药物与样本萃取液充分反应,14 000 r·min-1离心5 min后取上清进样;② 环孢素:将全血涡旋混匀30 s,取100 μL置于EP管中,加入300μL特异性环孢霉素样本萃取液,涡旋振荡1 min,放置2 min使药物与样本萃取液充分反应,14 000 r·min-1离心5 min后取上清进样。
血浆处理方法:将各组血浆涡旋混匀后再进样。
鉴于EMIT法易受温湿度影响,将实验室温湿度控制在恒定范围:室温(23±2)℃,湿度(50±5)%;同时为保证数据的可靠性,同一种药物的测定试剂均为同一批次试剂。
2.3 标准曲线建立
全血样本取6份全血定标样品和3水平全血质控样品,血浆样本取6份标准定标液和3水平血浆质控样本,按 “2.2样本前处理”项下处理后上机测定,自动生成标准曲线,样本测定时随行质控。
2.4 数据处理
数据采用SPSS 17.0、GraphPad 6.0和Med Calc 19.1.7软件进行统计学分析。样本的正态性采用Kolmogorov Smirnov法检验,若服从正态分布,用配对t检验分析2种消毒组和对照组的差异,并用Pearson相关系数r评价相关性,当r<0 95时,认为相关性不强[6]。一致性分析采用Bland Altman法,以2种消毒组与对照组药物浓度的比值为纵轴、药物浓度的均数为横轴绘图,95%一致性界限(limits of agreement,LOA)用x±1.96 SD表示,当同时满足如下3个条件时:①图形中位于95%LOA范围内的点占到所有点的95%以上;②95%LOA在临床最大允许范围(0.85~1.15)内;③P>0.05[7],认为2种方法一致性较好。所有分析中P<0.05为差异,有统计学意义。
3 实验结果
3.1 标准曲线及质控结果
他克莫司、西罗莫司、环孢素、万古霉素、丙戊酸和霉酚酸定标样品的线性范围分别为:0~30 ng·mL-1、0~36 ng·mL-1、40~500 ng·mL-1、2~50μg·mL-1、0~150μg·mL-1和0~15μg·mL-1,随行质控值(低、中、高3个水平)、质控范围和平均值见表1。结果显示,6种药物各浓度水平QC样品的准确度平均在92.02%~112.06%,批内精密度在2.39%~9.53%,均符合有关生物样品分析方法验证的要求。
3.2 配对t检验
采用Kolmogorov Smirnov法检验对照组、湿热组、紫外组数据的正态性,3组数据P值均大于0 05,符合正态分布。2种消毒组和对照组间6种药物浓度的配对t检验分析结果显示(图1),消毒组中仅丙戊酸和霉酚酸的药物浓度与对照组有显著性差异(P<0.01)。
3.3 相关性考察
Pearson相关分析显示,2种消毒组和对照组间6种药物浓度有显著的相关性(r值均大于0 98,P值均小于0.001),线性回归方程及r值结果见图2。图中实线和虚线分别表示回归曲线和回归曲线的置信区间。
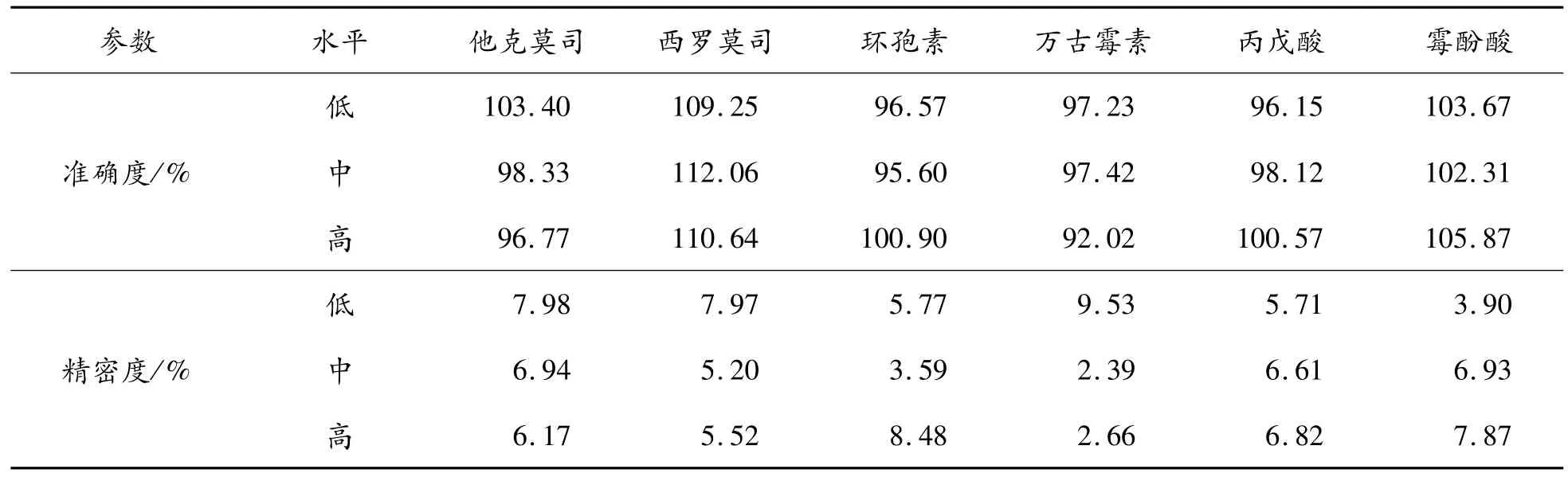
表1 6种药品的质控结果(n=3)
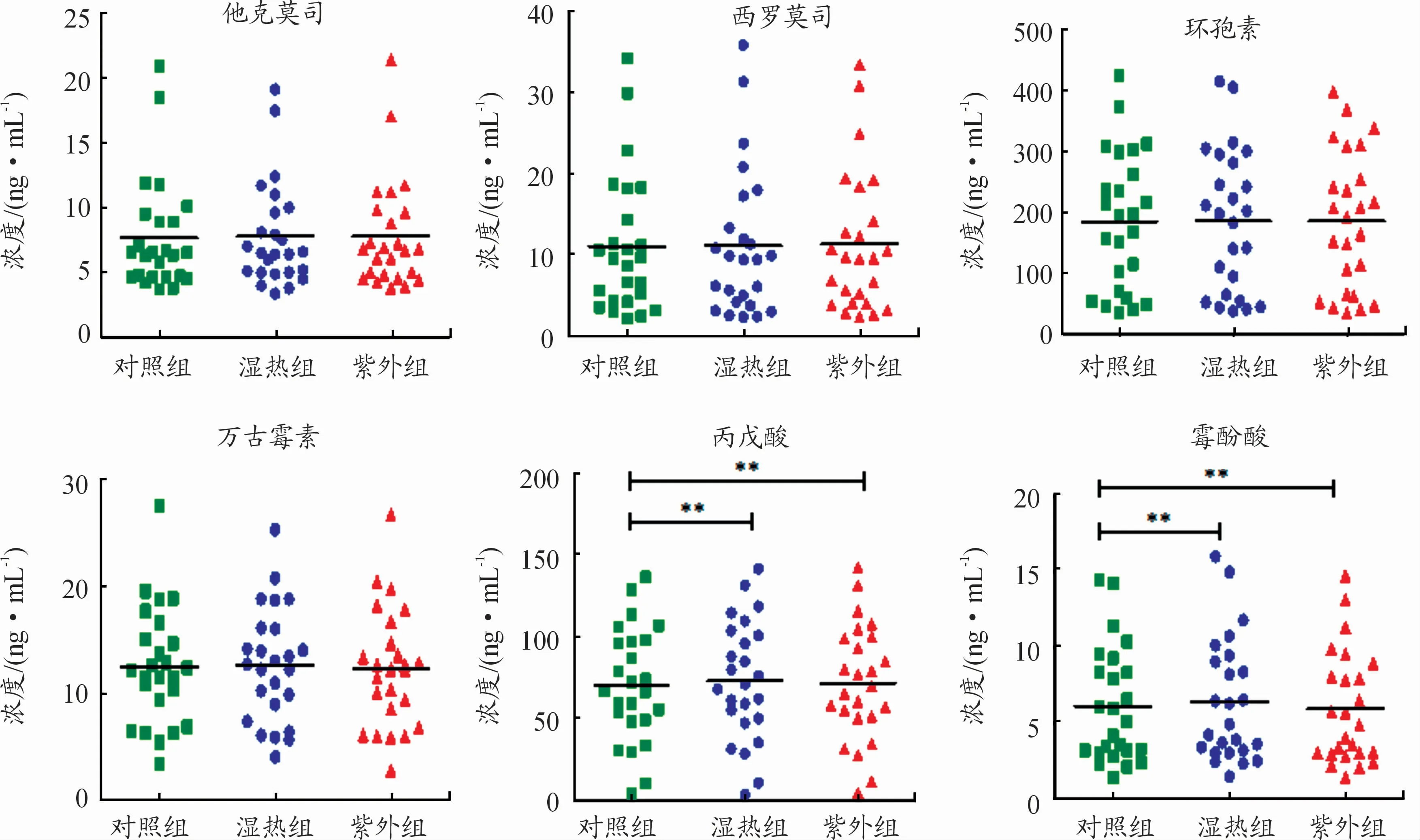
图1 不同组药物浓度的结果(n=25), P<0.01
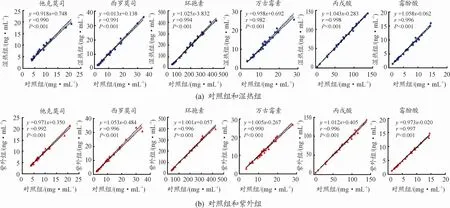
图2 消毒和未消毒处理组中药物浓度的相关性
3.4 Bland Altman一致性检验
以2种消毒组与对照组药物浓度的比值为纵轴、药物浓度的均数为横轴绘制Bland Altman散点图,如图3所示。Bland Altman方法结果见表2。由图3和表2的结果显示:①6种药物浓度比值的均值(图3蓝色实线)在0.97~1.05;② 他克莫司、西罗莫司、环孢素、万古霉素分布在比值为1的横轴(图3橙色虚线)两侧的数据点大致相当,但湿热组和对照组中丙戊酸和霉酚酸分别有12%(3/25)和24%(6/25)的点低于该横轴,紫外组和对照组中丙戊酸和霉酚酸分别有28%(7/25)的点低于和12%(3/25)的点高于该横轴;③ 湿热组和对照组中霉酚酸以及紫外组和对照组中丙戊酸仅有92%(23/25)的点在95%LOA范围以内,其余各组药物均有超过95%的点在95%LOA范围以内;④6种药物95%LOA值均在临床上最大允许范围(0.8~1.2)内;⑤ 除丙戊酸和霉酚酸外,他克莫司、西罗莫司、环孢素以及万古霉素的P值均大于0.05。
基于本次Bland Altman法设定的一致性判定标准,认为2种消毒组和对照组间他克莫司、西罗莫司、环孢素、万古霉素的浓度一致性良好,而湿热消毒会使丙戊酸和霉酚酸的检测值显著升高,紫外消毒会使丙戊酸的检测值显著升高、霉酚酸的检测值显著降低。
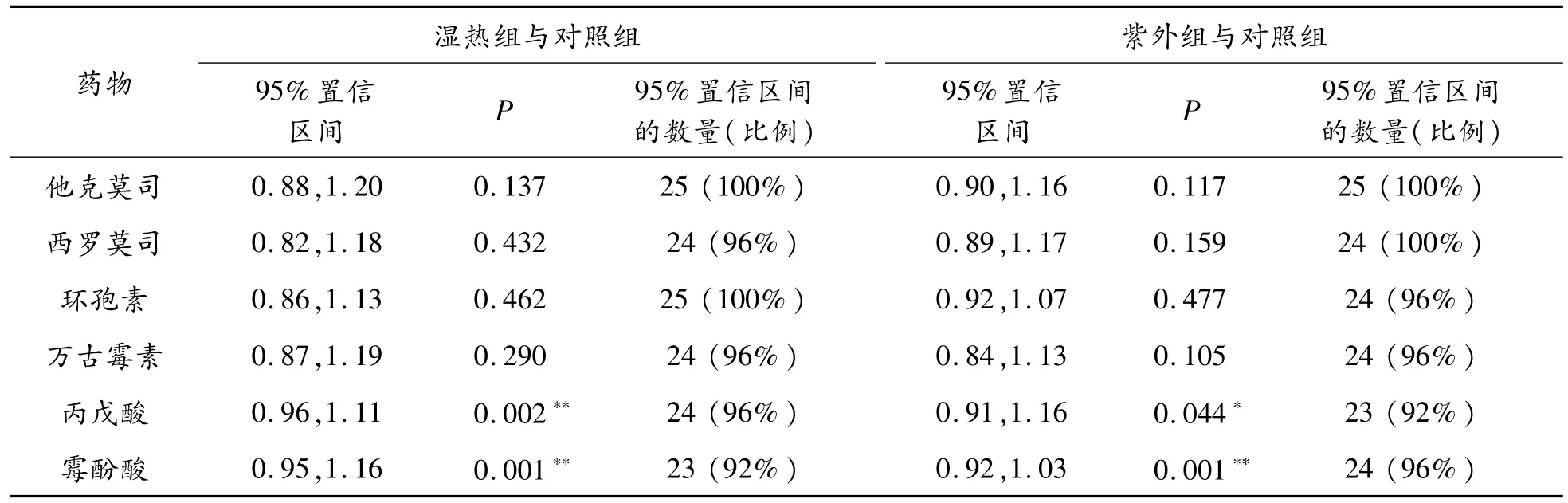
表2 Bland Altman方法结果
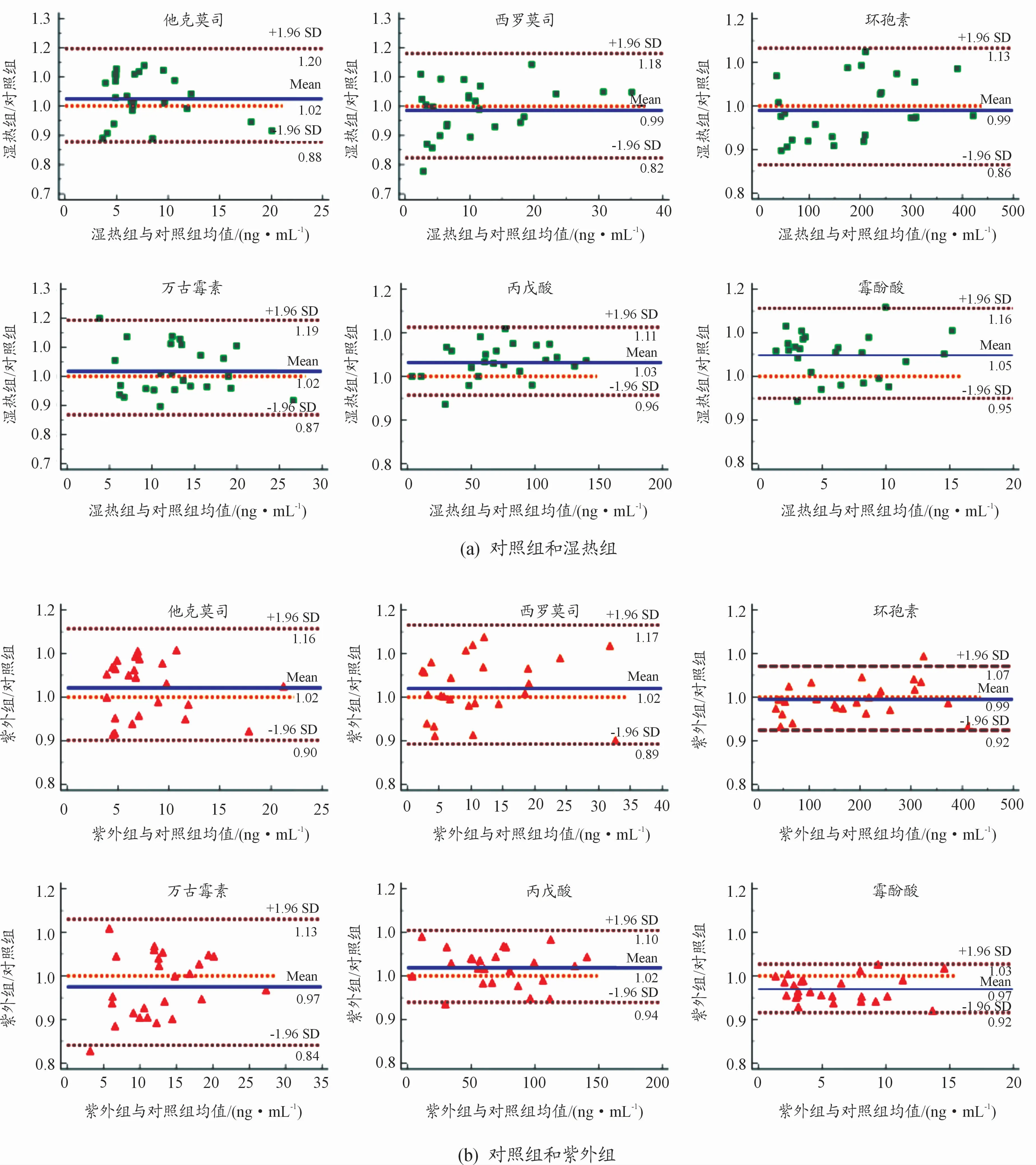
图3 不同处理组的比值与均值的Bland Altman散点图
4 结果与讨论
《新型冠状病毒肺炎诊疗方案(试行第七版)》明确指出,56℃30 min、紫外线或75%乙醇等脂溶性试剂可有效地灭活SARS CoV 2。在对生物样本进行消毒时,加入脂溶性试剂显然会严重影响检测结果,因此湿热和紫外消毒可能是目前比较适合血液样本消毒的方法。广东省药学会近期发布的《新型冠状病毒肺炎患者血药浓度检测技术指引》提及,湿热法不影响伏立康唑和万古霉素的检测,但未披露更详细的数据予以证实。因此,本研究选取了TDM常见的6种药物(他克莫司、西罗莫司、环孢素、万古霉素、丙戊酸和霉酚酸)和常用的检测方法(EMIT法),探讨湿热和紫外消毒与不处理后EMIT法测得药物浓度的差异和一致性。
本研究表明:在全血样本中,2种消毒处理组和对照组间他克莫司、西罗莫司、环孢素的浓度无显著性差异且一致性良好,原因可能是他克莫司、西罗莫司、环孢素进入血液后分别有高达99%、94.5%、70%的药物被红细胞摄取[8-10],并与免疫亲和素FKBP12(他克莫司、西罗莫司)以及亲环素cyclophilin A(环孢素)结合[11],而56℃水浴和紫外照射30 min不显著影响这些蛋白的稳定性,因此所检测的游离药物浓度未发生明显改变。
在血浆样本中,2种消毒处理对万古霉素的检测无显著影响,对丙戊酸和霉酚酸的检测有较显著的影响。该现象的出现可能是3种药物蛋白结合率的差异所致,万古霉素与血浆蛋白的结合能力适中(<50%)[12],而丙戊酸、霉酚酸与血浆蛋白的结合能力极强(分别为87% ~95% 和97 5%)[13-14]。有研究发现,50℃加热会使血浆蛋白发生明显变性[15],因此本研究使用的湿热消毒(56℃水浴,30 min)可能对血浆蛋白结合率高的药物影响更显著,导致万古霉素和丙戊酸或者霉酚酸受影响的程度截然不同。
在分析数据的过程中,使用了配对t检验、Pearson相关分析和Bland Altman分析3种统计学方法。配对t检验主要考察2组数据的集中位置是否相同,对随机误差不敏感;Pearson相关分析主要考察数据同步变化的方向与紧密程度,对系统误差的识别能力较差;而Bland Altman分析既考虑了随机误差和系统误差,还结合了专业意义进行判断,但存在高估系统误差的风险[16-17]。鉴于上述3种统计学方法性能各异,本研究在进行统计学分析时将其同时引入[18],以避免对结果的误判。
本研究尚存在一些局限性:①受时间限制,每种药物仅纳入了25个样本,浓度的集中和离散趋势可能不同于临床真实大样本,因此结果判定可能存在偏倚;② 只考察了TDM常用的EMIT法,其他免疫学检测法以及液相或液质联用检测法是否有影响仍待考察。
5 结论
本研究为医院TDM检测人员防控新冠病毒工作提供参考,在新冠病毒肺炎疫情尚未解除前,采用EMIT方法测定他克莫司、西罗莫司、环孢素、万古霉素的血药浓度时,可考虑先对血样标本采取湿热或紫外消毒灭活病毒后再进行处理、测定,以降低TDM检测人员的职业暴露风险。鉴于56℃水浴和紫外线照射30 min可有效灭活曾对人类健康造成严重威胁的SARS CoV和MERS CoV[4]。研究结果同样适用于这3种冠状病毒“大流行”期间TDM检测的血样消毒。

