氨气影响动物健康和生产性能的机理
崔 嘉,杨新宇,李 楠,陈宝江,2*
(1.河北农业大学动物科学技术学院,保定 071000;2.河北省牛羊胚胎技术创新中心,保定 071000)
氨气(NH3)是一种剧毒的环境污染物,被美国环境保护署(environmental protection agency, EPA)确认为环境应激源[1]。在不同国家和地区,工作人员8小时工作日和生活环境中氨的接触限值不同,例如法国接触限值为7 mg·m-3[2],欧盟为18 mg·m-3[3]。在集约化大型畜禽舍中,空气中氨气的浓度范围为1.4~60.9 mg ·m-3[4]。大气中的氨有助于微粒形成并降低空气能见度,影响人类健康和寿命[5]。Beker等[6]研究表明,长时间暴露于低至15.2 mg ·m-3的氨水平下,会对家禽健康产生负面影响。Reeb-Whitaker等[7]和郭艳等[8]研究表明,环境中高浓度的氨会增加器官和组织中的氨浓度,导致代谢紊乱、组织和器官受损,引发组织病变,降低动物的生长和生产性能。Zhang等[9]和 Yi等[10]研究还表明,高浓度的氨气会诱导基因和蛋白质表达的改变,这些基因和蛋白质与脂质代谢、细胞凋亡、细胞结构和生长、免疫反应及氧化应激有关。
1 氨气对呼吸系统的影响
氨气是一种常见空气污染物,是霾(PM2.5)的组成部分。Brautbar等[11]和George等[12]认为,氨气对人或动物的危害往往首先表现在呼吸道,尤其是上呼吸道区域,如鼻腔,它是氨气进入人和动物体内的第一途径。Beker等[6]和Zhang等[13]研究表明,高浓度氨气对鸡鼻腔和眼睛的损伤最显著。Jones等[14]研究发现,长期暴露于28 mg·m-3的氨气环境下,会影响猪的嗅觉灵敏度,并导致不可逆的干扰。除鼻腔外,随暴露时间的增加,氨气还会进一步危害气管、支气管、肺等下呼吸道组织。Wang等[15]和Perkins等[16]研究发现,氨气破坏气管黏膜纤毛和肺泡,导致支气管和气管水肿,上皮坏死,并在肺泡腔中发现由纤维蛋白、血液和大量炎性细胞组成的渗出液,表明接触氨气会损伤气管结构的完整性,损害免疫功能,并伴有更高的呼吸道气管炎风险。Phillips等[17]对支气管肺泡灌洗抽样分析表明,氨气通过增加巨噬细胞活性和中性粒细胞百分率诱导肺部炎症。
氨气主要通过以下3个途径影响呼吸系统:1)呼吸紊乱在氨气引起的呼吸毒性中起中心作用,造成严重的继发性影响,甚至可能导致死亡。氨气溶于水会转化为氢氧化铵,吸附于呼吸道黏液,增加黏液的pH,影响黏液在纤毛上的黏度和功能,腐蚀纤毛并使气管无法正常启动免疫反应[18-21]。暴露后气管纤毛排列紊乱[22],将捕获的细菌引向气囊和肺部并最终引起感染[13,22-24]。同时,呼吸道的形态和结构将发生一系列变化,包括平滑肌增生、肺纤维化、基底层增厚以及细胞组成改变,并伴有炎性细胞浸润,引起周围组织损伤甚至坏死[18]。Kim和Patterson[24]研究还表明,氨气胁迫会增加S100A家族的表达水平,S100A与EGFR结合会导致仔猪呼吸道黏液含量增加,阻塞呼吸道。2)氨气对动物最直接的损害是气管炎症反应,炎症损伤是气管氨气毒性损伤的标志[22]。Wang等[25]研究发现,氨气能促进嗜中性粒细胞分泌各种促炎因子(IL-1β和IL-6)和炎性小体(NLRP3、ASC和Caspase1)。Braissant等[26]和Royes等[27]研究表明,吸入体内的氨气以铵根离子的形式存在,会导致机体氧化应激。Shi等[28]和Singleton等[29]在气管中观察到细胞色素P450同工酶(CYP)和抗氧化酶mRNA表达上调和下调,CYP450酶系统中的CYP1C1,CYP2A1,CYP2C8和CYP17A1,FOXP3和HSP都在NH3的刺激下增加。CYP1B则促进ROS产生,加速Treg/Th1的失衡,并激活Th2和Th17的免疫反应,导致气管损伤发炎[28,30]。当鸡气管组织中的下游炎症基因暴露于NH3时,NF-κB被激活,炎症反应损伤加剧。3)高浓度的氨会影响有害细菌的定殖率,从而导致呼吸系统损害甚至肺炎。鼻腔微生物的构成可以反映整个呼吸道的菌群结构[31-32]。高浓度氨会影响有害细菌的定殖率,使有害细菌占主导地位。鼻腔菌群失衡会导致呼吸道黏膜免疫功能紊乱[15,33-34]。Lanaspa等[34]研究表明,猪舍中的氨气对猪鼻腔微生物群有直接影响,并与呼吸系统疾病密切相关。Hamilton等[35]研究发现,仔猪暴露于15.2 mg ·m-3氨气下,会引起萎缩性鼻炎,并使鼻腔中巴斯德芽孢杆菌显著增加。Maliselo和Nkonde[36]研究表明,高浓度氨引起的呼吸道黏膜损伤,增加了禽类对细菌性呼吸道感染的敏感性,尤其是大肠杆菌。莫拉氏菌和链球菌是肺炎患者肺组织中常见的致病菌[37]。Wang等[15]和Gutbier等[38]发现,莫拉菌和链球菌在暴露于19 mg ·m-3氨气的猪的鼻腔中显著增加,并且鼻腔中的莫拉菌能在呼吸过程中进入肺泡,从而引起肺部炎症并导致猪阻塞性肺炎。
2 氨气对神经系统的影响
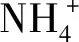
2.1 干扰大脑组织的能量代谢
氨可导致线粒体通透性转换孔(mPTP)开放程度加大,使其通透性增加,线粒体基质肿胀,氧化磷酸化不完全及 ATP 合成阻断[46-47],还会抑制三羧酸(TCA)循环中α-酮戊二酸脱氢酶和丙酮酸脱氢酶的活性[48]。Lindell和Jacobs[21]研究表明,进入大脑的NH3可通过摄入α-酮戊二酸、NADH和ATP来减少大脑组织中能量物质的产生,从而使大脑处于抑制状态。氨对脑组织中神经元、小胶质细胞和星形胶质细胞都具有很强的破坏作用[49],星形胶质细胞是氨毒性的主要靶标[46]。Jayakumar等[50]、Rangroo Thrane等[51]和Rama等[52]研究表明,高血氨对星形胶质细胞的神经毒性作用导致氧化代谢途径的改变,随后,糖酵解增加、脑乳酸水平升高、ATP生成减少。氨通过激活氨基酸的谷氨酸受体(N-甲基-达斯巴酸(NMDA))经脑能量代谢途径影响脊椎动物的中枢神经系统。这些受体负责控制突触可塑性和记忆功能。这些受体的激活导致神经元立即去极化和中枢神经系统内的细胞死亡。
2.2 引起大脑中神经递质的变化
NH3在谷氨酸合成酶催化下与谷氨酸(Glu)向谷氨酰胺转化是NH3在在脑组织的主要解毒途径,大脑将氨转化为谷氨酰胺的能力有限,高血氨导致大脑氨和谷氨酰胺升高,大脑功能异常,包括脑积水增多、离子运输和神经递质功能异常[53]。Ott等[54]研究发现,高血氨可导致大脑兴奋性神经递质(谷氨酸)过度减少,抑制性神经递质(谷氨酰胺)增多,引起中枢神经系统障碍,神经精神症状的严重程度与脑内氨解毒剂谷氨酰胺浓度呈正相关。Rama Rao和Norenberg[55]研究也表明,氨的毒性作用与谷氨酰胺的产生直接相关。NH3与谷氨酸生成的过多谷氨酰胺[56],在线粒体内降解回谷氨酸和氨,导致线粒体通透性转变,内部线粒体膜电位降低,从而干扰线粒体功能,ATP合成失败并产生额外的自由基[56-57]。
2.3 影响pH和电解质平衡
NH3和NH4+可以通过质膜的传播机制传播,并直接影响pH,这可能会影响神经细胞的功能。氨中毒时所引起的各种脑功能、代谢及结构改变有可能通过细胞内钙稳态失调机制实现[56]。氨会损害星形胶质细胞的钙信号传导而导致其功能异常,并且NH4+与K+具有相似的水合离子半径,会与K+竞争转运蛋白通道,直接影响膜电位,破坏K+动态平衡[58-61]。胞外氨和钾的快速增加引起γ-氨基丁酸(GABA)平衡电位的去极化转化,从而导致机体神经元抑制还原[60]。
3 氨气对繁殖性能的影响
氨在生殖活动中起着极其重要的作用。环境中高浓度的氨气会导致吸收到动物体内的氨增加,进而损害动物的生殖功能[62-64]。高浓度NH3会降低鸡只的产蛋量、繁殖性能和繁殖率, 且随着氨气浓度的升高,影响越显著[65]。前期研究表明,氨气浓度范围为23.4-200 mg ·m-3时,蛋鸡的产蛋率显著下降[66-68]。李振[69]也发现,蛋鸡产蛋性能随氨气浓度的升高而骤降。氨气环境下所产鸡蛋蛋白高度较低,蛋白pH和蛋白稠度较高,蛋形更大[70]。高浓度的氨气还会对胚胎发育造成危害[62],且显著降低大小鼠的产仔量、仔鼠的初生重、仔鼠的离乳率及胎次间隔[71]。高水平的氨对发育中的胚胎/胎儿有毒,这是由于:1)氨使谷氨酸脱离谷胱甘肽的合成而产生谷氨酰胺并造成氧化应激,从而降低卵巢中孕酮的产生和释放;2)氨与质子结合形成铵离子,从而增加细胞内pH;3)氨从尿素循环中吸取α-酮戊二酸形成谷氨酸,破坏其循环并降低了ATP的产生;4)氨导致的谷氨酰胺增加抑制了内皮细胞从精氨酸产生NO,从而减少了血流量(包括子宫胎盘血流量)和营养物质的输送,导致子宫分泌减弱以及缺氧。这些变化导致胚胎/胎儿存活、生长和发育受阻。
同时,NH3是可以与空气颗粒物结合的空气污染物[72]。许多研究表明,其可能对精子活力和雄性生育能力产生不利影响[73-79]。Pentikäinen等[80]研究表明,NH3可通过破坏精子发生,降低精子浓度20%~40%和使生育率降低20%~30%。另有研究表明,NH3可以降低公猪的精子活力[63,81-84]。高水平的氨对精子的运动有毒性,这是由于:1)血浆尿素氮和血氨水平升高会增加生殖道的pH,并降低精子的运动性和存活率[85];2)NH3会破坏睾丸中与内分泌有关的蛋白质,从而损害细胞膜完整性,扰乱能量平衡,抑制细胞生长,破坏氧化还原系统。
4 氨气对生长性能的影响
许多研究表明,高浓度氨直接危害家禽的呼吸道和免疫功能[86-87],影响家禽的健康和生长性能[88-91],导致多种疾病[22,92]。Yahav[89]和Sa等[93]将鸡舍氨浓度从0增加到75 mg·kg-1,结果显示,ADFI和ADG数值呈线性下降。Tao等[94]发现,暴露于氨气中,可使鸭体重和脾重量降低,并且随氨气浓度升高,损害加大。Miles等[90]研究表明,暴露于38 mg ·m-3和57 mg ·m-3氨浓度下的肉鸡42日 龄体重分别比0 mg ·m-3下的肉鸡降低6%和9%,并且57 mg ·m-3氨浓度下鸡的死亡率要高于0 mg ·m-3。其原因在于以下几个方面。
4.1 影响采食和活动
高浓度氨气会强烈刺激畜禽眼部和鼻腔的黏膜[8],引起动物眼睛红肿流泪,导致视力障碍,呼吸困难,影响其觅食和摄食,并随着NH3浓度的增加,摄取食物的频率和时间减少[95],行走和站立的时间增加[96],频繁的活动会增加维持能量的需求并减轻重量[97-98]。而且高浓度的氨影响脑神经中枢的pH[60],对呼吸活动产生明显抑制作用,减少能量需求,减少饲料摄入,影响生长和生产。
4.2 影响机体健康
前期试验表明,高浓度氨气可导致肺、肝、胸腺及卵巢等组织损伤[94,99]。氨暴露可通过激活细胞色素P450酶(CYP)诱导氧化应激[100-102],产生大量ROS,例如H2O2、OH-、O22-[103-104],导致抗氧化系统失调[105-107],引起炎症[105]。抑制与抗氧化剂相关基因(GPx和GST4)的表达并增加鸡胸腺中炎症相关基因(IL-1β,IL-6,IL-8和iNOS)的mRNA表达[99],导致不可逆的细胞损伤。氨气还会导致细胞凋亡,凋亡与疾病的发生直接相关[108]。Shah等[109]试验表明,暴露于氨气会显著增加肉仔鸡法氏囊凋亡细胞,并且凋亡相关基因(如Caspase3,Caspase9,Bcl-2和Bax)的mRNA和蛋白质表达显著改变。
4.3 影响肠道消化功能
肠道也是空气污染的目标器官,Dybdahl等[110]研究表明,暴露于柴油机排气颗粒会导致结肠黏膜中的DNA链断裂,凋亡和蛋白质氧化。高浓度氨会导致肝疾病,影响肠道免疫力和组织形态[9]。Zheng等[111]和Wang等[15]研究表明,NH3可破坏刷状缘的完整性,减少空肠的内表面积,导致空肠组织中微绒毛的异常缺乏和粘性聚集,并引起空肠组织中SLC(SLC7A9,SLC51A,SLC10A2,SLC26A3和SLC6A19)的异常表达。此外,Tao等[94]研究发现,氨会导致盲肠菌群在属水平发生变化,且随浓度和暴露时间的增加变化增大。肠道功能和内部异常环境必将影响营养物质的利用,从而降低生产性能[112]。
4.4 影响正常代谢
前期研究表明,暴露在高浓度的氨气环境中可改变肉鸡的体脂分布[113],影响脂肪合成与分解关键酶活性及其相关基因与蛋白质表达,影响脂肪代谢相关通路[114-115],从而调控机体脂代谢[116]。姜庆林等[117]试验表明,鸭 PARα信号途径在氨气应激状态下抑制机体脂代谢。Wang等[15]研究表明,随着氨浓度的增加,猪的脂肪和氨基酸代谢活动加强,但能量和碳水化合物代谢降低,这可能说明,在暴露于低水平氨气的猪中,脂肪和氨基酸比碳水化合物更优先利用。另外,环境氨气浓度过高必然导致机体血氨浓度异常,间接影响脑神经细胞和肌肉细胞的正常代谢,导致畜禽氨气中毒,使生物组织器官对氨的解毒活动加强。黏膜细胞更新,消耗大量由肠细胞供应的氨基酸,且能量需求远高于正常水平,导致原本用于生长的能量被利用,生长性能受到影响。
5 小 结
氨气是畜禽舍气体污染的主要来源,对畜禽的生产和生殖性能均有负面影响。但其机理研究尚不全面,且单面性强,需更深层次更系统的研究。今后,研究方向应围绕氨气对呼吸、神经、生殖系统及生产特性等方面的影响综合展开,并从分子机理方面探索其作用关键点。

