个体化营养支持联合药物治疗多囊卵巢综合征的研究
赖雪梅,黄金园,张海燕,钟 荧
0 引 言
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是以长期无排卵或稀发排卵、卵巢多囊性增大、高雄激素血症或高雄表现为主要特征的内分泌紊乱性疾病,好发于青春期及育龄期女性。该病不仅可引起闭经、不孕、雌激素依赖性肿瘤等症状,还可导致糖代谢、脂代谢异常以及心血管疾病风险上升[1-2]。目前临床尚未完全了解PCOS的发生机制,有研究认为,胰岛素抵抗、高胰岛素血症可能在PCOS的发生发展中扮演了重要角色[3],故目前临床治疗PCOS以炔雌醇环丙孕酮联合二甲双胍为主,并以调理月经、降雄激素及改善患者胰岛素抵抗状态为辅。大量报道显示,高代谢综合征的存在往往加剧PCOS患者不良饮食习惯,大量高脂、高糖食物的摄入,也使其代谢紊乱进一步恶化[4]。因此,营养指导有望在缓解PCOS患者病情中发挥重要作用。本研究选取156例PCOS患者,就个体化营养支持联合药物治疗的疗效进行病例干预对照分析,现报道如下。
1 资料与方法
1.1 研究对象将我院2017年4月至2018年4月收治的156例PCOS患者纳入本研究。纳入标准:①参照欧洲人类生殖与胚胎协会和美国生殖医学会荷兰鹿特丹专家会议制定的PCOS诊断标准(2003年版)明确PCOS诊断[5];②年龄19~40岁;③符合药物治疗适应证;④有妊娠及分娩意愿;⑤对本研究知情同意且自愿参与,配合度良好。排除标准:①合并其他导致雄性激素过多或不排卵的疾病;②合并生殖系统器质性疾病、心脑血管疾病、肝肾功能障碍、免疫功能疾病;③入组前3个月内有降压、降糖药物,或减肥药物、激素类药物、影响代谢类药物使用史。本研究经医院伦理委员会批准(批准号:L2017025),患者均签署知情同意书。采用随机数字表法将患者分别纳入个体化营养支持组(营养组)、对照组各78例,2组年龄、病程、文化程度等一般临床资料比较差异无统计学意义(P>0.05),有可比性,见表1。

表1 入组多囊卵巢综合征患者一般临床资料比较
1.2 治疗方案2组均接受药物治疗:于药物撤退性出血或月经来潮第5 天给予炔雌醇环丙孕酮片(拜耳医药保健有限公司广州分公司,国药准字J20100003,规格2 mg×21片)口服,每日1次,每次2 mg,持续21 d为1个疗程;下个疗程于药物撤退性出血或月经来潮第5天开始,治疗持续3个疗程;同期给予盐酸二甲双胍片(中美上海施贵宝制药有限公司,国药准字H20023370,规格0.5 g×20 s)口服,每日2次,每次0.5 g,餐前服用,治疗持续3个月,期间不停药。在上述治疗方案的基础上,给予营养组个体化营养支持。采用中国超重/肥胖医学营养治疗专家共识(2016版)中关于PCOS体重管理的推荐意见[6],以限能量平衡膳食(calorie restrict diet,CRD)为首选方案,且在限能量基础上给予高蛋白低碳水化合物饮食。每日摄入能量1000~1500 kcal,其中蛋白质供能占30%,碳水化合物供能占40%,脂肪供能占30%。具体计算公式为:①理想体重(kg)=21×身高2(m);②每日摄入能量(kcal)= 理想体重(kg)×25(kcal/kg)。由专业的营养医师对营养组每位患者给予个体化营养方案的计算和指导,打印营养报告,并交待患者填写膳食调查表,包括餐次、时间、食物种类(谷类、蔬菜、水果、鱼虾、蛋、奶等)、运动类型及时间等,记录1周的详细饮食品种和重量,1周后复诊,膳食调查表交由营养医师分析,确认无误后继续执行。若膳食摄入平衡不达标,交待患者继续记录后复诊、调整膳食方案并随访监督,直至达标为止。
1.3 观察指标对比2组患者治疗前、治疗6个月后的人体测量指标、生化指标(糖脂代谢、性激素)变化,以及治疗6个月后排卵率、妊娠率。其中,人体测量指标包括体质量指数(body mass index,BMI)、腰臀比及体脂率,使用MC/MES00-0042肌肉功能分析仪(北京迈达康医疗设备公司)测量。糖脂代谢指标包括空腹血糖(FPG)、胰岛素抵抗指数(HOMA-IR)及总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C),使用Synchron LX-20 全自动生化检测仪(美国Beckman Coulter公司)进行检测;性激素指标包括卵泡刺激素(FSH)、黄体生成素(LH)及睾酮(T),使用Centaur 全自动化学发光免疫分析仪(美国Bayer公司)检测,检测时点为治疗前、治疗6个月后,检测状态为晨起空腹、月经期第3 天。排卵率、妊娠率判定参照《孕产超声诊断学》[7],妊娠率以宫内妊娠计。
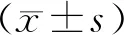
2 结 果
2.1 人体测量指标变化比较2组治疗6个月后BMI、体脂率均较治疗前下降,营养组治疗6个月后BMI、体脂率低于对照组同期水平,差异均有统计学意义(P<0.05),2组治疗前后腰臀比均未见明显变化(P>0.05)。见表2。
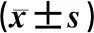
表2 入组多囊卵巢综合征患者人体测量指标变化比较
2.2 糖脂代谢变化比较2组治疗6个月后FPG、HOMA-IR均较治疗前下降,HDL-C均较治疗前升高,营养组治疗6个月后FPG、HOMA-IR低于对照组,HDL-C高于对照组同期水平,差异均有统计学意义(P<0.05),2组治疗前后TC、TG、LDL-C均未见明显变化(P>0.05)。见表3。
2.3 性激素变化比较2组治疗6个月后LH、T均较治疗前下降,营养组治疗6个月后LH、T低于对照组同期水平,差异有统计学意义(P<0.05);2组治疗前后FSH均未见明显变化(P>0.05)。见表4。
2.4 排卵率及妊娠率比较营养组治疗6个月后排卵率(65.38%)、妊娠率(57.69%)均高于对照组(51.28%、44.87%),差异均有统计学意义(P<0.05)。
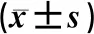
表3 入组多囊卵巢综合征患者糖脂代谢指标变化比较
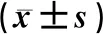
表4 入组多囊卵巢综合征患者性激素变化比较
3 讨 论
作为一种多因性临床多态性综合征,PCOS患者临床症状以内分泌和代谢紊乱所致雄激素增多、胰岛素抵抗增强、继发高胰岛素血症为主,目前临床治疗PCOS的方案以药物治疗为主,原则在于改善内分泌和代谢紊乱症状[8]。炔雌醇环丙孕酮是一种口服避孕药,也被用于女性雄激素依赖性疾病如痤疮、雄激素性脱发、轻型多毛症的治疗,近年来在PCOS的治疗中也得到了广泛应用[9-10]。
本研究对照组接受炔雌醇环丙孕酮联合二甲双胍治疗,治疗6个月后,患者BMI、体脂率较治疗前下降,主要得益于二甲双胍高效抑制肝脏葡萄糖生产能力的机制[11],故其FPG、HOMA-IR亦有所下降。另外,有研究显示,炔雌醇环丙孕酮联合二甲双胍能够有效调节机体脂质代谢[12],本研究对照组治疗后HDL-C较治疗前升高,印证了上述结论。同时,炔雌醇环丙孕酮的应用也使得患者LH、T明显改善,这对于改善患者PCOS临床症状、提高排卵率及妊娠率也有着积极意义。
随着临床对PCOS发病机制认识的逐渐深入,越来越多的学者开始强调药物治疗以外综合管理的必要性[13-14]。鉴于PCOS所引发的高代谢综合征,与患者的肥胖密切相关,据报道,较同龄正常女性而言,PCOS患者肥胖发生率升高30%~60%[15]。因此,在PCOS的综合管理中,营养支持尤为重要。本研究采取个体化营养支持方案,在营养师的指导下,根据PCOS患者BMI、能量消耗、运动状态、饮食数量及频率设定合理膳食方案,并嘱患者仔细填写膳食日记表,一方面能够保证膳食方案的科学性,另一方面也能提高患者按方案饮食的合理性。得益于个体化营养指导的实施,营养组BMI、体脂率下降更为明显,且糖脂代谢紊乱得到良好纠正,显现出该方案的积极临床价值。既往研究认为,良好的生活习惯对于调节内分泌紊乱状态也有着重要作用[16-17]。本研究结果示,营养组接受个体化营养指导6个月后,其LH、T较对照组改善更为明显,在印证上述结论的同时,亦显现出合理营养膳食在调节内分泌方面药物无法替代的作用。随着患者体质状态、糖脂代谢及激素水平的改善,营养组患者排卵率、妊娠率均较对照组有了显著提高,为患者预后质量的改善及妊娠意愿的达成奠定了坚实的基础。除此之外,有研究发现,均衡的营养状态对于加速机体新陈代谢、减少药物蓄积所致不良反应亦有着积极作用[18],故个体化营养指导的意义不仅仅在于改变患者不良生活习惯,还可全方位改善其身体状态,保证治疗效果的最优化。
综上所述,个体化营养支持联合药物治疗,对于改善PCOS患者体质、糖脂代谢、性激素水平,以及提高排卵率、妊娠率均有着积极意义,值得临床广泛推广应用。

