正负离子切换扫描质谱成像分析方法及其整体动物体内代谢应用研究
黄建鹏,张 锦,刘 丹,高杉杉,张瑞萍,贺玖明
(中国医学科学院,北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050)
质谱成像(MSI)技术以质谱的高特异性、高选择性和高灵敏度特点,以及可获得的化学分子空间分布信息,成为生物学的研究前沿,特别是在医学、生命科学和研发等领域显示出重大应用前景[1-8]。该技术无需特殊的化学标记,通过非靶向质谱分析,不仅可同时获得生物体中上千个分子的结构及相对含量信息,还能提供分子空间分布及其动态变化[9-10],为理解生命活动或药物作用的分子机制提供了直观准确的分析手段。
早期的质谱成像可通过基质辅助激光解吸飞行时间质谱(MALDI-TOF MS)和二次离子质谱(SIMS)技术实现。其中,MALDI-TOF MSI可对多肽、蛋白质、糖类、脂质类等生物分子进行成像。近年来随着技术的不断进步,MALDI-TOF MSI的检出限已达10-18mol水平,空间分辨率优化到数个微米的水平[1-2,6]。但该技术需要添加基质,且不同结构类型的分析物对基质具有不同选择性和离子化响应效率,从而导致该技术对小分子代谢物的检测受到一定限制。SIMS成像技术在真空下操作,空间分辨率可达数百个纳米[9],由于能量较大,难以获得完整的代谢物等生物分子的信息。
近年来,随着美国普渡大学 Cooks等开发出解吸电喷雾离子化(DESI)技术,样品在敞开环境下,无需复杂前处理的离子化新技术的研究成为质谱领域最受关注的前沿方向之一,为质谱成像技术提供了新的契机[4],并较好地解决了生物组织样本中代谢物的微区分布特征分析难题。DESI-MSI对生物组织中脂质类化合物和低分子量代谢物的成像分析效果好,已被用于脑、乳腺、胃肠道等不同类型肿瘤组织中代谢物的化学组成分析[10-13]。斯坦福大学的研究人员采用DESI-MSI成像技术结合组织病理信息,通过表征脂肪酸、甘油磷脂酰肌醇、甘油磷脂酰丝氨酸、硫酸脑苷酯等脂类代谢物的组成,实现了不同类型神经胶质瘤的区分[14-15]。
我国对质谱成像技术的研发和相关仪器设备的研制也日益重视,在质谱成像分析领域取得了大量突破性进展。如空气动力辅助离子源[16]、等离子体辅助多波长激光解吸附离子源[17]、敞开式表面辅助激光解吸附离子源[18]、激光喷雾电离源[19]等均可进行质谱成像分析。本研究团队经过十余年的协作攻关,自主研发出新型的敞开式空气动力辅助解吸电喷雾离子化(AFADESI)技术[16]及其免标记、便捷、高灵敏和适用于定量分析的质谱分子成像技术[20-23]。随着AFADESI-MSI技术的不断改进和发展,成功实现了生物组织中1 500多个、涵盖多种代谢物的高灵敏、高覆盖质谱成像分析[24]。与此同时,将AFADESI-MSI技术与代谢组学方法相结合,创建了空间分辨代谢组学分析新方法,并成功应用于体内药物原位表征与作用机制、肿瘤生物标志物的原位筛查及免标记分子病理诊断的研究[25-27]。
在动物各组织器官的空间分辨代谢组学研究中,一般采用正负离子模式分别扫描两张相邻切片的方式获得更多代谢物信息[24,28-29]。但此方法不仅增加了样品的消耗量,而且将样品分析时间延长了1倍。为了提高空间分辨代谢组学的研究效率,本研究基于AFADESI技术对喷雾电压和质谱仪数据采集方式进行调整优化,开发了一种正负离子化模式切换扫描的质谱成像方法,可用于各种类型代谢物空间分布信息的同时采集。
1 实验部分
1.1 仪器与试剂
大鼠肝组织切片采用冷冻切片机(CM1860 XP,Leica Biosystems)制备,小鼠整体动物切片采用冷冻切片机(CM3600 XP,Leica Biosystems)制备,组织切片采用AFADESI成像平台及控制软件(本课题组自主研发)和Q-Orbitrap高分辨质谱仪(Q-Exactive,Thermo Fisher Scientific)进行成像分析;喷雾溶剂采用乙腈(HPLC,Thermo Fisher Scientific公司)和纯净水(杭州娃哈哈食品有限公司)配制;动物采用乙醚(分析纯,中国北京化工厂)麻醉后处死。
1.2 样品制备
动物实验获得本单位动物福利伦理委员会的审批,并遵守相关管理规定。8周龄雄性BALB/C小鼠,体重16.0~18.0 g,购自中国食品药品检定研究院(大兴),许可证号:SCXK(京):2017-0005。采用高浓度的乙醚麻醉处死小鼠,并置于-80 ℃超低温冰箱储存。以3%(g/100 mL)的羧甲基纤维素钠包埋,置于-80 ℃超低温冰箱中冷冻成型,转移至CM3600 XP冷冻切片机约1 h。设定切片厚度参数为25 μm,固定于载玻片上,置于-80 ℃超低温冰箱保存。质谱成像分析前,组织切片依次在-20 ℃真空干燥器内干燥2 h,室温干燥2 h。SD雌性大鼠,体重180~200 g(北京维通利华实验动物技术有限公司)。采用高浓度的乙醚麻醉处死大鼠,立即取出大鼠肝组织,置于模具中,放入-80 ℃超低温冰箱迅速冷冻保存。切片前转移至CM1860 XP冷冻切片机中,切制20 μm肝组织切片,将切片吸附在正电荷防脱载玻片上,保存于-80 ℃超低温冰箱,质谱成像分析前,在-20 ℃冷冻干燥1 h,在室温下干燥2 h后备用。
1.3 仪器条件
正负离子化模式分别进行的质谱成像分析的喷雾电压分别设置为±7 000 V,正负离子化模式切换同时扫描质谱成像分析的喷雾电压设置为0 V或交流5 000 V,其他参数相同。解吸和离子化采用同轴的高压气体雾化液体形成带电喷雾液滴,作用在样品表面,喷雾毛细管内径为100 μm,外径为200 μm,外部鞘气管内径为300 μm,喷雾气压力为0.7 MPa,喷雾溶剂选择乙腈-水(8∶2,体积比),流速设置为10 μL/min。AFADESI抽气流速为45 L/min。成像扫描采用线扫描,成像装置移动平台的X轴移动速度为0.35 mm/s,Y轴移动步长为0.5 mm。质谱参数设置为毛细管温度350 ℃,扫描方式为PositiveFull Scan和/或NegativeFull Scan,扫描质量范围设置为m/z76~1 000 Da,AGC time 100 ms,AGC target 5 e6,分辨率(Resolution)为70 000。
1.4 数据处理
使用Q-Exactive型质谱仪配套的Xcalibur 3.0软件进行仪器控制和数据采集,并将数据从“.raw”格式转化为“.cdf”格式。采用自主研发的MassImager质谱成像软件进行图像重构和背景扣除,结合相邻切片的H&E染色图选定小鼠不同器官区域,提取器官区域的正负离子质谱数据,并以二维数据矩阵(m/z-Intensity)的形式保存为.txt格式文件。将不同器官的质谱数据文件(.txt)导入MarkerView 1.2.1(AB SCIEX,美国)软件中实现峰提取和峰对齐,最后将其导出为多维数据矩阵,并保存为.xlsx格式数据文件。用内源性代谢物正负离子质谱数据矩阵构建OPLS-DA模型,获得不同器官代谢物的OPLS-DA得分图。对内源性代谢物数据进行t检验,筛查P值小于0.05的差异代谢物。设置代谢物可能的准分子离子加合形式([M+H]+、[M+Na]+、[M+K]+、[M-H]-、[M+Cl]-等),以小于5 ppm的质量误差搜索数据库,如:HMDB(http://hmdb.ca/)、LIPID MAPS(http://www.lipidmaps.org/)等,对代谢物进行标注。
2 结果与讨论
2.1 喷雾电压对离子化率的影响
将AFADESI-MSI的正负离子化模式切换同时扫描和单极性分别扫描模式,对代谢物成像分析检测的离子化效率进行比较。设置不同的扫描采集模式,用相邻的大鼠肝组织切片进行AFADESI-MSI分析,得到的代谢物质谱轮廓和离子强度结果(见图1),可以看出正负离子切换同时扫描模式未显著降低代谢物成像检测的覆盖度和灵敏度,且对肝组织中代谢物的成像效果和分辨率影响也不明显。由此表明进行组织样品成像分析时可以将质谱仪的扫描模式设置为正负切换扫描模式,以便同时检测到样品的正离子和负离子质谱成像图。
为了摸索同时正/负离子化样品的离子源参数,设置AFADESI离子源的喷雾电压分别为5 000 V直流电压、-5 000 V直流电压、5 000 V交流电压和不加电压。在这4种离子源条件下,对肝组织切片进行成像分析,得到的代谢物离子总数结果如图2所示。检测代谢物离子总数最多的是分别施加正、负直流电压的AFADESI离子源搭配相应单极性扫描模式的质谱仪。无电压的AFADESI离子源搭配正负切换扫描模式,检出的代谢物离子总数与施加直流电压的AFADESI离子源搭配正负切换扫描模式的质谱仪相近。而施加交流电压的AFADESI离子源搭配单极性扫描模式的质谱仪检出的代谢物离子数量最少。本研究开发的正负离子切换扫描质谱成像方法是将组织样本中的代谢物同时解吸和离子化后(不一定实现正负电荷分离),进入质谱质量分析器进行“正负离子切换”扫描,分别获得正负离子的质谱图。

图1 相邻肝组织在单极性扫描模式(A.负离子;B.正离子)和正负离子切换扫描模式(C.负离子;D.正离子)下检测的AFADESI-MSI质谱图和成像结果Fig.1 Mass spectra and MSI images of adjacent liver tissues under unipolar scan mode(A.negative;B.positive) and positive/negative ion-switching scan mode(C.negative;D.positive) by AFADESI
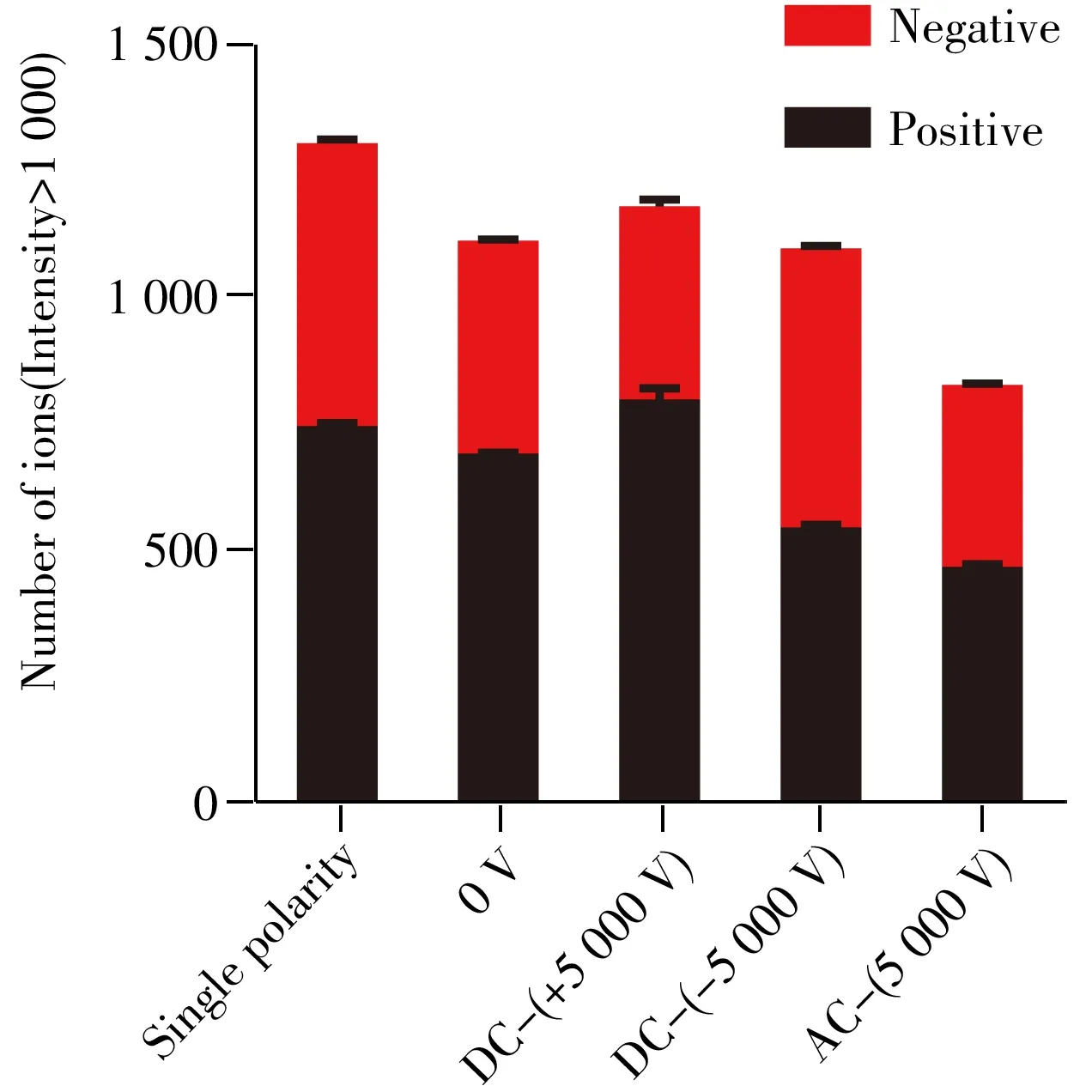
图2 不同喷雾电压和扫描模式下质谱成像检出的代谢物总数Fig.2 Total number of metabolites detected by MS imaging under different spray voltages and scan modes
2.2 稳定性考察
选择3个相邻肝组织切片作为样品,用正负离子切换扫描质谱成像方法进行代谢物检测,代谢物成像结果见图3。氯化钠、葡萄糖、谷氨酸、黄嘌呤、亚精胺、甜菜碱、缬氨酸等8个内源性代谢物(4个正离子代谢物和4个负离子代谢物)在3个肝组织切片中响应强度的相对标准偏差(RSD)均小于15%。此结果表明正负离子切换扫描质谱成像方法的稳定性良好,适用于开展生物组织中代谢物的成像分布研究。
2.3 整体动物体内代谢组学分析应用
用正负离子切换扫描质谱成像方法对BALB/C小鼠的整体切片进行成像分析。根据相邻切片的光学图在 MassImager 软件中与质谱成像图匹配后,选定小鼠的脑、肾、肝、肺和脾器官区域,获得器官区域任意6个像素点的代谢物轮廓,实现峰对齐后,将其导出为多维数据矩阵。经OPLS-DA建模分析后,获得的结果如图4所示。在正负离子切换扫描模式下,脑、肾、肝、肺和脾器官的内源性代谢物均具有明显的聚类和分组趋势,体现了内源性代谢物种类及含量分布与组织器官具有相关性和特异性。体内的内源性代谢物负责各组织器官生理功能的维持与调节,因此,不同生理功能组织器官中的代谢物种类和含量也千差万别。对代谢物的空间分布特征的表征,可以深入理解组织器官的功能及其中的分子代谢过程和分子机制[24]。对5组器官的内源性代谢物的质谱强度数据进行t检验,筛选出组织器官特异性的差异代谢物(P值<0.05),其中正离子差异代谢物149个,负离子差异代谢物182个。典型的组织器官差异代谢物成像结果展示了内源性代谢物的精准空间分布和显著的器官浓度差异(见图5)。上述研究结果表明,通过质谱成像对代谢物进行高通量检测分析,能直观呈现代谢物在不同组织器官中的浓度(质谱强度),可寻找具有特异性空间(组织器官)分布的差异代谢物。

图3 相邻肝组织切片代谢物的正负离子切换扫描质谱成像图Fig.3 Images of metabolites in adjacent liver sections was obtained by AFADESI-MSI with positive/negative ion-switching scan
根据内源性代谢物的精确质量数,对代谢物进行标注,获得的部分结果如图5所示。小鼠体内器官特异性代谢物有:脱氧胞苷(Deoxycytidine)、磷脂酰胆碱类代谢物PC-32∶1和PC O-38∶6、黄嘌呤核苷(Xanthosine)、N-乙酰基-L-天冬氨酸、磷脂酰甘油类代谢物PG 32∶1等。小鼠体内分布较为广泛的内源性代谢物有:甜菜碱(Betaine)、谷氨酰胺(Glutamine)、黄嘌呤(Xanthine)等。其中谷氨酰胺在正负离子同时被检测和成像,说明正负离子切换扫描质谱成像方法可以将代谢物同时正负离子化,极大地提高了代谢物的离子化效率。另外,大部分的内源性代谢物在成像分析过程中容易离子化为单极性离子(正离子或负离子)。上述结果表明,正负离子切换扫描质谱成像方法可同时检测正负离子,扩展了单一样品一次质谱成像分析对内源性代谢物的检测范围。
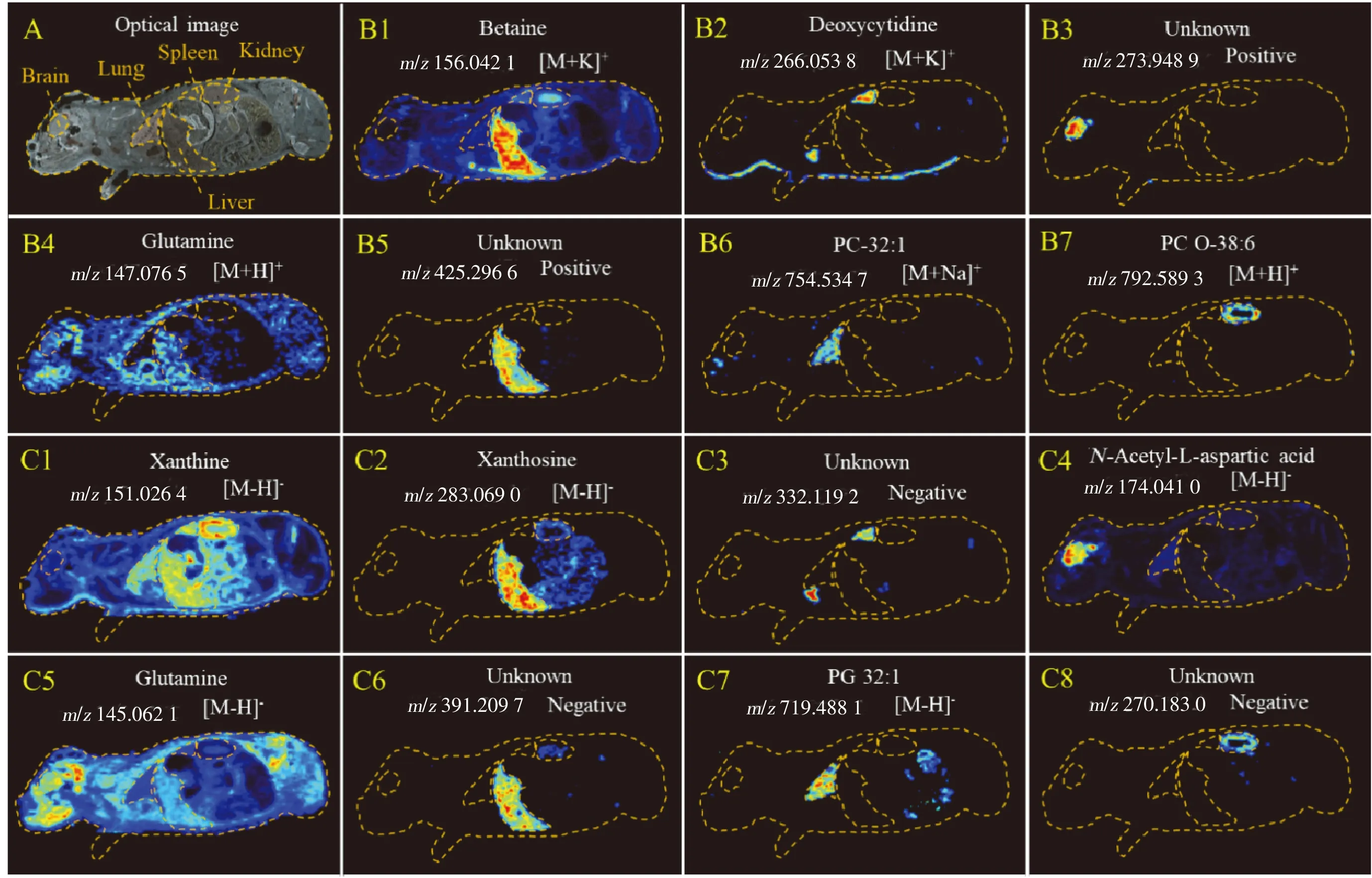
图5 整体动物内源性代谢物的正负离子切换扫描质谱成像图Fig.5 Positive/negative ion-switching scan MS imaging of endogenous metabolites in whole-body animalsA.optical image(光学图像);B.imaging of positive ion metabolites(正离子代谢物成像);C.imaging of negative ion metabolites(负离子代谢物成像)
3 结 论
本研究采用AFADESI技术开发了正负离子切换扫描的质谱成像分析方法,并通过对肝组织和小鼠整体切片的成像分析验证了该方法。应用不同喷雾电压和离子化模式对肝组织进行成像分析,测得的代谢物质谱数据和成像结果差异表明,正负离子切换扫描质谱成像方法对代谢物的覆盖范围宽,单个切片成像检测代谢物种类更多。利用正负离子切换扫描质谱成像方法对3份相邻肝组织切片进行成像分析,计算得到8种内源性代谢物质谱强度的RSD均小于15%,表明正负离子扫描质谱成像方法稳定可靠。小鼠整体切片的质谱成像分析结果和质谱成像数据OPLS-DA得分图,呈现了正负离子切换扫描质谱成像方法获得的内源性代谢物的精准空间分布和显著的器官浓度差异。综上所述,正负离子切换扫描质谱成像方法能够高效、安全、稳定、精准地检测更多种类的代谢物,是整体动物各组织器官空间分辨代谢组学研究的有力工具。

