基于PI3K-Akt-mTOR信号通路探讨葛根素对大鼠神经病理性疼痛的影响
吕 婧,黎镇赐,马化鑫,刘 维,郭静文
(广东省广州市第一人民医院,广东 广州 510180)
神经病理性疼痛是一种由于中枢或者外周神经系统受损以及功能失调而引发的疼痛,其主要病理特征包括自发性疼痛、痛觉过敏和超敏等,严重影响患者的生活质量[1]。相关研究报道神经病理性疼痛的发病率高达8.0%,在我国约有9 000万神经病理性疼痛患者[2]。但是,由于神经病理性疼痛发病机制尚不明确,目前该病的临床治疗主要依赖于阿片类镇痛药物,但是该类药物具有强烈的成瘾性,患者极易形成药物依赖,并且阿片类药物具有恶心、呕吐、幻觉等不良反应[3]。葛根素是从中草药葛根中提取的黄酮类化合物,其具有扩张冠状动脉、降血压、抗血栓形成以及提高免疫功能等药理活性[4]。吴越等[5]研究发现葛根素对于大鼠背根神经节神经病理性疼痛具有明显的镇痛作用。但是对于葛根素镇痛作用的机制研究目前报道较少。因此本研究拟采用坐骨神经结扎慢性损伤的方法构建大鼠神经病理性疼痛模型,探讨葛根素对神经病理性疼痛的镇痛作用及其相关的作用机制。
1 实验材料和方法
1.1实验动物 健康SD大鼠40只,6周龄,体质量180~220 g,购买于北京维通利华实验动物技术有限公司,动物合格证号:SYXK(京)2017-0033。饲养于本院动物实验中心,饲养室保持良好通风,饲养环境温度为(25±2)℃,湿度(50±10)%,12 h 循环光照。
1.2实验试剂与仪器 葛根素注射液,山东方明药业集团股份有限公司,批号:1304127;PI3K抑制剂wortmannin,上海翊圣生物科技有限公司;3%的戊巴比妥钠,上海榕柏生物技术有限公司; ECL Plus 超敏发光液、RPMI1640培养基、考马斯亮蓝试剂,北京索莱宝公司;TRIzol试剂盒,invitrogen公司;BCA蛋白浓度测定试剂盒,上海碧云天生物技术有限公司;RIPA 裂解液I、PI3K一抗、Akt一抗、mTOR一抗以及β-actin一抗,英国Abcam公司;山羊血清以及辣根过氧化物酶标记的二抗,北京中杉金桥生物技术有限公司。Von Frey test 触觉测量套件,天津仪数科技有限公司; 热刺痛仪,济南益延科技发展有限公司; 冷热板测痛仪,上海豫研科学仪器有限公司;倒置显微镜(日本 OLYMPUS);高速离心机( Eppendorf,德国);紫外分光光度计、多功能酶标仪( Thermo,美国);冷冻冷藏两用冰箱(Siemens,德国);ABI 7500实时荧光定量PCR仪(ABI,美国);转膜仪以及电泳仪(北京六一仪器厂)。
1.3动物建模、分组及给药 取24只大鼠,参照王东辉等[6]方法建立慢性坐骨神经压迫损伤大鼠模型:腹腔注射3%的戊巴比妥钠麻醉大鼠后,右侧卧位固定,暴露并分离右侧后肢坐骨神经的主干,用3.0丝线由近心端向远心端依次每隔1 mm轻度结扎,结扎力度以见神经外鞘膜稍微受压为宜,打结时可见肢体轻微抽搐,结扎大鼠坐骨神经可见其左侧后爪内敛,后爪轻度外翻和跛行。在手术后腹腔注射200 mg/kg氨苄青霉素以预防感染。另取8只SD大鼠作为假手术组,在同样的时间点进行钝性分离暴露坐骨神经但不进行结扎。术后第8天,将造模成功的24只大鼠随机分为模型组、葛根素组、PI3K抑制剂组,每组8只。葛根素组给予葛根素注射液100 mg/kg腹腔注射,PI3K抑制剂组给予wortmannin 5 mg /kg腹腔注射,假手术组和模型组给予等量的生理盐水腹腔注射,均每天1次,连续1周。
1.4机械刺激缩足反射阈值的测定 腹腔注射1周后,将大鼠置于0.5 cm×0.5 cm网格孔径的铁丝网上,并罩上透明有机玻璃箱(20 cm×12 cm×20 cm) 来限定活动区域,大鼠适应15 min后,测定大鼠机械刺激缩足反射阈值。具体测定方法:采用不同弯折力的 Von Frey Filaments纤维丝分别刺激大鼠足底皮肤,维持6 s左右,每次刺激时间间隔必须控制大于15 s,下次刺激在上次刺激引起的反射行为消失后方可进行,每次刺激后观察大鼠反应,当大鼠表现出明显的抖足、舔足或者缩足动作时,则为阳性反应,否则为无反应,此外纤维丝弯折大于90°,大鼠仍无缩足反应,同样视为无反应。弯折力最大为15 g,超过15 g按15 g记录,每只大鼠折力值即为机械缩足反射阈值。
1.5热缩足反射潜伏期的测定 同1.4方法,采用相同的透明玻璃箱来限定大鼠活动范围,并在箱底放置厚度约为3 mm厚的玻璃板,待大鼠适应15 min后,采用热刺痛仪光源照射大鼠足底,从打开光源开始计时至大鼠出现抬足或缩足行为的时间记为缩足反射潜伏期。设定光照时间最长为15 s,为了避免实验过程中大鼠烫伤,实验将热刺激光源温度设定为30 ℃,两次测定时间间隔至少15 min,每只大鼠连续测定3次取平均值。
1.6冷缩足反射阈值测定 同1.4方法,采用相同的透明有机玻璃箱限定大鼠活动范围,并在箱底放置温度为4 ℃的冷玻璃板,待大鼠适应3 min后,观察大鼠结扎后肢在5 min内抖足、舔足或者缩足次数,记为冷缩足反射阈值。
1.7脊髓组织切片HE染色及TUNEL凋亡细胞检测 在末次腹腔注射24 h后,采用3%的戊巴比妥钠腹腔注射麻醉大鼠,开胸并用100 mL生理盐水、200 mL 4%的多聚甲醛分别经心脏灌注,取L4~6段脊髓,置于4%的多聚甲醛固定24 h,采用常规石蜡包埋并切片,将切片严格按照HE染色步骤进行染色。此外,姜切片进行TUNEL凋亡细胞检测:将石蜡切片脱蜡,3%的H2O2孵育15 min,采用PBS洗涤3次,抗原微波修复后加入蛋白酶K孵育20 min,PBS洗涤3次后加入40 μL TUNEL液,4 ℃湿盒孵育过夜;第2天加入40 μL POD转化剂,37 ℃湿盒孵育30 min,PBS洗涤,加入DAB显色并采用苏木素染色,PBS冲洗,脱水并封片,镜下观察拍照,记录细胞凋亡情况。
1.8脊髓组织PI3K-Akt-mTOR信号通路相关蛋白表达Western blot检测 收集各组大鼠脊髓组织加入RIPA裂解15 min,离心3 min,收集离心管上清。采用BCA法测定提取蛋白的浓度。将蛋白样品置于100 ℃水浴变性5 min,每个样品上样20 g蛋白,采用SDS-PAGE电泳,转膜,之后在室温条件下用5% 脱脂奶粉封闭 1 h,加入稀释的PI3K一抗(1∶1000)、Akt一抗(1∶500)、mTOR一抗(1∶1 000)、β-actin一抗(1∶1 500),4 ℃摇床过夜孵育。第2天采用TBST缓冲液洗PVDF膜3次,每次30 min,加入HRP标记的IgG,孵育45 min后ECL显影拍照,并采用Image J 软件分析条带的灰度,各目的条带灰度与相应的β-actin条带灰度之间比值作为蛋白相对表达量。
1.9统计学方法 采用SPSS 22.0软件以及GraphPad Prism 5对获得的实验数据进行分析,组间数据两两比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1各组大鼠行为学情况 模型组大鼠的机械刺激缩足反射阈值和热缩足反射潜伏期均显著低于假手术组(P均<0.05), 冷缩足反射阈值显著高于假手术组(P<0.05);葛根素组和PI3K抑制剂组大鼠的机械刺激缩足反射阈值和热缩足反射潜伏期均显著高于模型组(P均<0.05),冷缩足反射阈值均显著低于模型组(P均<0.05),葛根素组和PI3K抑制剂组各指标比较差异均无统计学意义(P均>0.05)。见图1。
2.2各组大鼠脊髓组织HE染色表现 与假手术组比较,模型组大鼠脊髓组织细胞形态受损严重;与模型组比较,葛根素组和PI3K抑制剂组PI3K抑制剂组大鼠脊髓组织细胞受损程度明显减轻,葛根素组与PI3K抑制剂组受损程度相似。见图2。

图1 各组大鼠机械刺激缩足反射阈值、热缩足反射潜伏期、冷缩足反射阈值
2.3各组大鼠脊髓组织细胞凋亡情况 假手术组、模型组、葛根素组、PI3K抑制剂组大鼠脊髓组织细胞凋亡率分别为7.28%,42.39%,23.54%,22.32%。模型组大鼠脊髓组织细胞凋亡率显著高于假手术组(P<0.05),葛根素组和PI3K抑制剂组均显著低于模型组(P均<0.05),葛根素组与抑制剂组比较差异无统计学意义(P>0.05)。见图3。
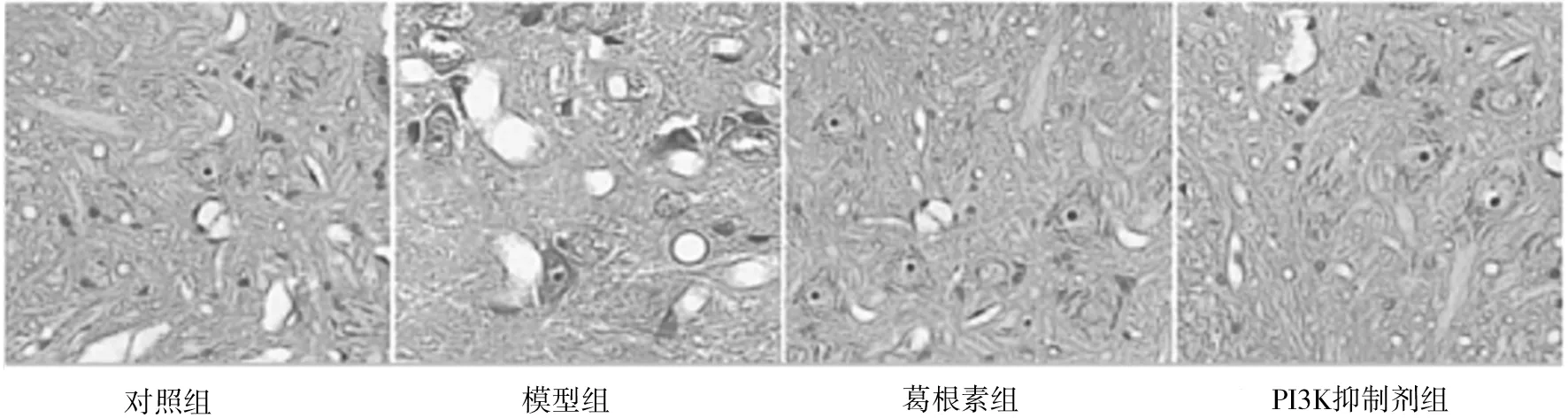
图2 各组大鼠脊髓组织HE染色细胞形态(×200)
2.4各组大鼠脊髓组织中PI3K-Akt-mTOR信号
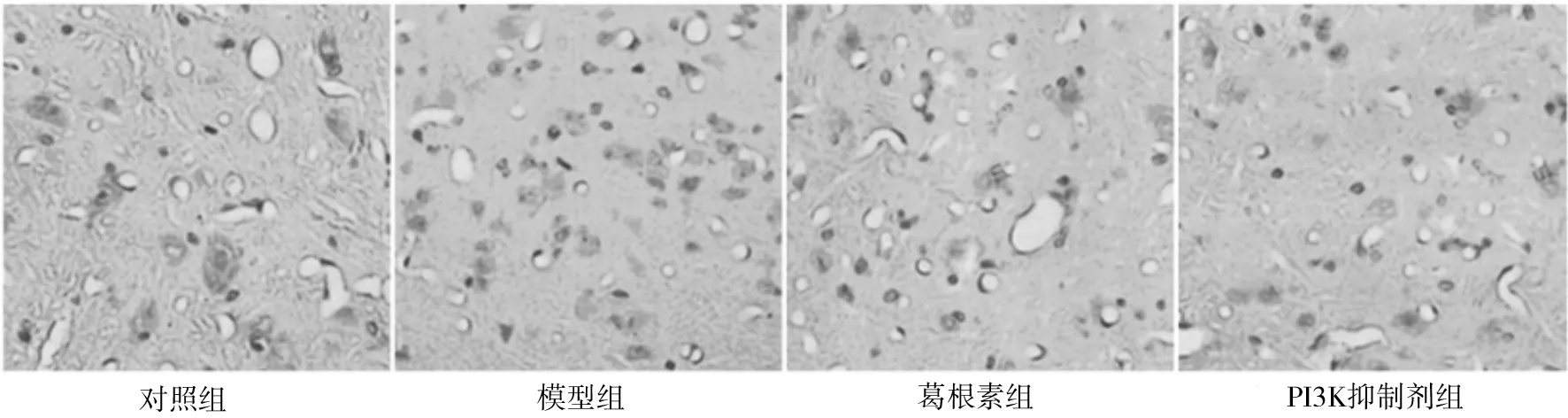
图3 各组大鼠脊髓组织细胞凋亡TUNEL染色表现(×200)
通路相关蛋白表达情况 模型组大鼠脊髓组织中PI3K、Akt、mTOR蛋白表达水平均显著高于假手术组(P均<0.05),葛根素组和PI3K抑制剂组均显著低于模型组(P均<0.05),葛根素组与抑制剂组比较差异均无统计学意义(P均>0.05)。见图4。
3 讨 论

图4 各组大鼠脊髓组织中PI3K、Akt、mTOR蛋白表达情况
神经性病理疼痛发病机制复杂,临床主要应用阿片类镇痛药、抗抑郁药等治疗,然而这些药物对于神经病理性疼痛的治疗靶向性低,具有严重的成瘾性且有诸多不良反应[7-8],故寻求积极有效的治疗手段迫在眉睫。葛根素是从传统中药葛根中提取的,主要成分为黄酮类物质,具有抗氧化应激以及神经保护等作用[9]。罗静华等[10]研究表明,葛根素对于神经病理性疼痛小鼠具有镇痛作用。段美婷等[11]报道葛根素与阿片类药物联用可增强神经病理性疼痛的镇痛效果。本实验结果显示,葛根素组和PI3K抑制剂组大鼠的机械刺激缩足反射阈值和热缩足反射潜伏期均显著高于模型组,冷缩足反射阈值均显著低于模型组,证实葛根素对神经病理性疼痛有显著镇痛作用,与上述研究结果相符。
PI3K由1个110 kD的催化亚基p110和1个85 kD的调节亚基p85共同构成,具有蛋白激酶及磷脂激酶的双重活性,因此P13K可被蛋白酪氨酸激酶受体激活,也可被Ras蛋白激活[12]。PI3K被激活后会使3,4-二磷酸磷脂酰肌醇(PIP2)转变为3,4,5-三磷酸磷脂酰肌醇(PIP3),PIP3 作为第二信使可以与细胞内的Akt蛋白结合,Akt获得相应的催化活性并进行下一步的信号转导[13]。激活的 Akt 由细胞膜转移到细胞质或细胞核内,进而继续靶向调控下游信号分子如mTOR[14]、NF-kB[15]等。mTOR广泛存在于各种细胞中, mTOR作为PI3K-Akt信号通路的下游信号分子,参与了神经病理性疼痛、炎性痛以及癌痛过程中神经突触的形成及疼痛信号的传导[16-17]。柯昌斌等[18]研究发现,糖尿病神经病理性疼痛大鼠PI3K、Akt信号通路相关因子表达水平明显升高,给予PI3K抑制剂之后,PI3K和Akt表达水平显著降低,大鼠的疼痛症状得到明显缓解,提示该通路与大鼠神经病理性疼痛的发生密切相关。Zhang等[19]研究发现在脊髓损伤后PI3K以及Akt的表达量显著增高。Wang等[20]研究发现通过脊髓内注射PI3K抑制剂可以降低脊髓损伤所引起的机械痛以及热痛过敏。本实验结果显示,模型组大鼠脊髓组织中PI3K、Akt、mTOR蛋白表达水平均明显高于假手术组,而葛根素组大鼠脊髓组织中PI3K、Akt、mTOR蛋白表达水平均明显低于模型组,证明葛根素可能通过下调 PI3K-Akt 通路中PI3K、Akt蛋白表达进而下调下游激酶mTOR的表达,从而发挥对大鼠神经病理性疼痛的镇痛作用。
综上所述,葛根素对大鼠慢性坐骨神经压迫损伤神经病理性疼痛有良好的镇痛作用,机制可能与抑制PI3K-Akt-mTOR通路蛋白的表达有关。然而神经病理性疼痛发病原因多样,因此对于葛根素发挥镇痛作用的具体机制仍需进一步研究。
利益冲突:所有作者均声明不存在利益冲突。

