巨噬细胞外泌体通过抑制自噬诱导高血糖对肾小球足细胞的损伤作用
饶超峰,薛笑楠,朱明英,罗富里
肾小球足细胞损伤与糖尿病肾病(diabetic nephropathy,DN)的发生发展密切相关[1-2]。最近发现,肾小球足细胞增殖和蛋白尿与自噬抑制有关[3]。有研究表明,链脲佐菌素(Streptozocin,STZ)诱导的糖尿病小鼠足细胞自噬不足,并伴有大量蛋白尿;而在基础代谢条件下,足细胞中高水平的自噬与细胞内稳态正相关[4]。然而,高糖(high glucose,HG)环境如何介导肾小球足细胞自噬尚不清楚。以往研究表明,HG 环境通过激活核因子(NF)-κB 信号通路,产生大量的促炎介质,如转化生长因子-β1、单核细胞趋化蛋白-1、肿瘤坏死因子(TNF)-α 和白细胞介素(IL)-1β,促进巨噬细胞迁移和活化,进而导致肾脏损伤[5]。这些发现强调了HG 在巨噬细胞活化中的作用。巨噬细胞具有招募免疫细胞的能力,其在DN进展过程中起着中心作用,但是在糖尿病状态下巨噬细胞和足细胞之间的通讯机制尚有待阐明。外泌体(Exosomes,Exos)是一类大小为30~120 nm的小膜泡,在细胞间通讯和相关免疫细胞激活中发挥作用[5]。Exos 具有改变靶细胞表型和功能的能力[5]。巨噬细胞来源的Exos 可以诱导靶细胞活化和分化[6]。最近研究观察到,HG诱导的巨噬细胞Exos通过NF-κB 信号途径激活巨噬细胞并诱导炎症反应[7]。但HG诱导的巨噬细胞Exos是否与DN足细胞损伤有关尚未明确。鉴于此,本研究观察HG处理的Raw264.7 巨噬细胞来源的Exos 对足细胞的损伤作用,并探讨其作用机制是否与抑制足细胞自噬相关。
1 材料与方法
1.1 主要材料及仪器 小鼠巨噬细胞系Raw264.7和原代足细胞购自中国科学院细胞库。DMEM 培养基、RPMI 1640 培养基、胎牛血清购自美国Gibco 公司;青霉素、链霉素、氯喹、雷帕霉素、绿色亲脂荧光染料PKH67 购自美国Sigma 公司;外泌体提取试剂ExoQuick-TC、EXOCET Exosome 定量试剂盒购自美国System Biosciences 公司;Phalloidin-iFluor 594 试剂、兔抗Nephrin 抗体、兔抗LC3B、Calnexin、p62、p-mTOR、mTOR单克隆抗体购自英国Abcam公司;CD63、CD9、GAPDH单克隆抗体和HRP 标记的山羊抗兔IgG 二抗购自美国Cell Signaling Technology 公司;Pierce®BCA 蛋白检测试剂盒购自美国Thermo公司。H-7700透射电子显微镜(TEM)购自日本Hitachi 公司;激光扫描共聚焦显微镜购自德国Carl Zeiss 公司;NOVA 超显微切片机购自瑞典Pharmacia LKB 公司;Tanon 5200 Multi全自动化学发光/荧光图像分析系统购自上海天能科技有限公司;Safire2酶标仪购自瑞士TECAN公司。
1.2 细胞培养和实验分组 小鼠巨噬细胞系Raw264.7和原代足细胞分别接种在含有10%胎牛血清、100 U/mL青霉素和100 g/L 链霉素的低葡萄糖DMEM 培养基或RPMI 1640 培养基中。细胞于37 ℃、5%CO2、饱和湿度培养箱中常规培养,当细胞融合度达70%~80%时,更换新的培养基,完成一次细胞传代。取对数生长期细胞用于实验。(1)将Raw264.7 细胞分别用正常葡萄糖(NG;5.5 mmol/L 葡萄糖+24.5 mmol/L 甘露醇)组和高糖(HG;30 mmol/L 葡萄糖)处理48 h,探讨HG 对Raw264.7 细胞释放Exos 的影响。(2)原代足细胞用HG 提取不同剂量的Exos(0、7、14、28、56、112 mg/L)处理,对照组加入等量溶媒,探讨高糖外泌体(HG-Exos)对足细胞存活、自噬的影响。(3)原代足细胞用HG-Exos(28 mg/L)处理不同时间(0、6、12、24、48、72、96 h),对照组加入等量溶媒,探讨HGExos对足细胞存活的影响。(4)将原代足细胞分为6组:对照组(加入100 μL PBS)、HG-Exos组(加入100 μL 28 mg/L HGExos)、氯喹(自噬抑制剂,CQ)组(加入100 μL 10 μmol/L CQ)、HG-Exos+氯喹组(加入100 μL 28 mg/L HG-Exos 和100 μL 10 μmol/L CQ)、雷帕霉素(自噬诱导剂,Rapamycin)组(加入100 μL 100 μg/L Rapamycin)、HG-Exos+雷帕霉素组(加 入100 μL 28 mg/L HG-Exos 和100 μL 100 μg/L Rapamycin),探讨HG-Exos诱导的细胞毒性是否会受到自噬调节剂的影响。
1.3 Exos 提取及TEM 观察 将NG 组和HG 组Raw264.7 细胞按1×106/mL 接种于培养皿中,培养24 h,收集细胞,并以3 000×g离心15 min以去除细胞和细胞碎片。将3.3 mL外泌体提取试剂ExoQuick-TC 加到10.0 mL 上清液中,并将混合物在4 ℃冷藏过夜(至少12 h)。然后1 500×g离心30 min,取上清液,再通过1 500×g离心5 min将剩余的ExoQuick-TC 溶液离心去除。使用EXOCET Exosome 定量试剂盒定量Exos。将纯化的Exos 沉淀物在无菌PBS中稀释,并将10 μL悬浮液在室温下置于铜网上2 min。然后将Exos 用2%磷钨酸染色5 min,并用2%戊二醛固定5 min,然后用PBS 洗涤3 次。用H-7700 TEM观察。
1.4 Exos 在原代足细胞的内化 采用绿色亲脂荧光染料PKH67 标记HG 组Raw264.7 源Exos(HG-Exos)。然后,将标记PKH67 的Exos 与原代足细胞共培养24 h,4%多聚甲醛固定10 min,1%牛血清白蛋白封闭1.5 h。随后,在PBS 中用50 mg/L Phalloidin-iFluor 594 试剂染色在室温下染色足细胞40 min。最后用DAPI染色,用激光扫描共聚焦显微镜对原代足细胞进行检测和拍照。
1.5 TEM观察自噬体 将按1.2中(2)、(4)的分组处理足细胞以2×105/孔接种在96 孔板中,将足细胞用4%戊二醛固定12 h,再用1%OsO4固定2 h,梯度乙醇(体积分数50%、70%、90%)脱水,70%醋酸铀染色6 h,乙醇脱水,环氧树脂包埋3 h,将样品置于60 ℃烘箱中48 h,并进行切片,厚度70 nm。最后用2%(W/V)醋酸铀和柠檬酸铅对样品进行染色,用TEM观察自噬体。
1.6 CCK-8法测定HG-Exos 对细胞活力的影响 将足细胞以2×105/孔接种在96孔板中,按1.2中(2)、(3)的分组处理足细胞,每孔加入10 μL CCK-8溶液,继续孵育1 h。然后使用Safire2 酶标仪通过测量450 nm 的光密度(OD)确定细胞活力。计算公式:细胞活力(%)=[OD(加药)-OD(空白)]/[OD(对照)-OD(空白)]×100%。
1.7 Western blot 检测自噬相关蛋白的表达 取足细胞或Exos,加入RIPA蛋白裂解液提取总蛋白质,混匀后冰上裂解15 min。在4 ℃以12 000×g 离心20 min,收集上清液。用Pierce®BCA 蛋白检测试剂盒检测蛋白质浓度。将蛋白质样品(50 μg)加载在12%聚丙烯酰胺凝胶上,然后电泳转移到PVDF 膜上。用5%脱脂奶粉封闭PVDF 膜,与抗Calnexin(1∶1 000)、抗CD63(1∶1 000)、抗CD9(1∶1 000)、抗LC3B(1∶2 000)、抗Nephrin(1∶2 000)、抗Beclin 1(1∶2 000)、抗p62(1∶2 000)、抗p-mTOR(1∶2 000)、抗mTOR(1∶2 000)和GAPDH(1∶15 000)的一抗于4 ℃孵育过夜。次日,在室温下与HRP标记的山羊抗兔IgG二抗(1∶5 000)孵育2 h。最后用Tanon 5200 Multi全自动化学发光成像分析系统发光显影。
1.8 统计学方法 采用SPSS 21.0软件进行数据分析。计量资料以均数±标准差(±s)表示,2组间比较采用独立样本t检验;多组间比较采用单因素方差分析,组间多重比较行Bonferroni校正法。以P<0.05为差异有统计学意义。
2 结果
2.1 HG处理的Raw264.7细胞分泌Exos特征 TEM显示,Raw264.7 细胞分泌的Exos 呈圆形的膜囊泡,直径为30~100 nm,且NG 组和HG 组的Raw264.7 细胞分离出Exos 在形态学上无明显差异,见图1。Western blot结果显示,提取的Exos均表达特征性外泌体标志物CD63 和CD9,而不表达内质网标志物Calnexin(常与细胞碎片有关),分离的Exos 未被细胞污染,见图2。HG组Raw264.7细胞释放的Exos数量(5.88±0.31)×108显著多于NG 组的(1.84±0.26)×108(n=3,t=3.146,P<0.05)。在TEM下观察到HG组PKH67 标记的Exos 位于足细胞的核周区中,表明Exos可以内化到足细胞中,见图3。

Fig.1 The Exos extracted from RAW264.7 cells observed by TEM(×150 000)图1 TEM观察Raw264.7细胞提取的Exos(×150 000)
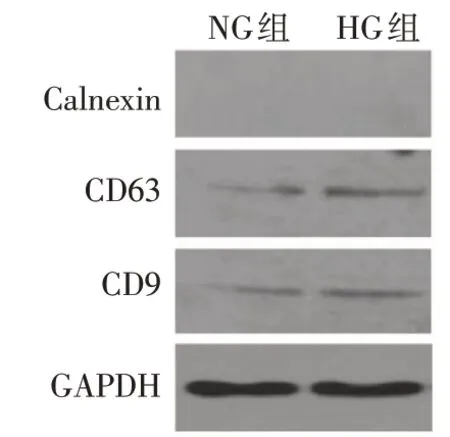
Fig.2 The expressions of Calnexin,CD9 and CD63 detected by Western blot assay图2 Western blot检测Exos蛋白标志物Calnexin、CD9和CD63的表达
2.2 HG-Exos 诱导足细胞损伤的剂量和时间依赖性 足细胞活性在HG-Exos刺激后随剂量和时间的增加而降低。当HG-Exos剂量≥7 mg/L时HG-Exos组细胞活力均低于对照组(P<0.05),当HG-Exos 剂量为28 mg/L时,细胞活力下降至51.8%±4.0%,见表1,将7 mg/L、14 mg/L 和28 mg/L 作为后续的干预剂量。当作用时间≥12 h时,HG-Exos组细胞活力均低于对照组,当HG-Exos作用时间为48 h时,细胞存活率下降至52.3%±3.4%,见表2,将48 h作为后续干预时间。
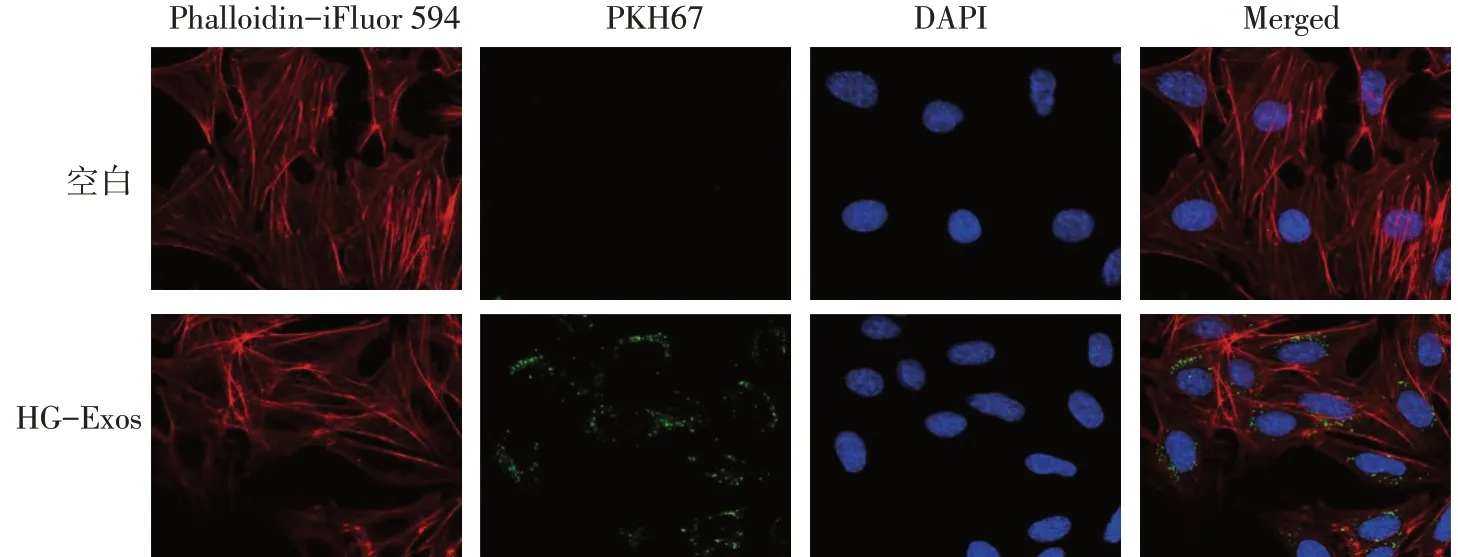
Fig.3 Exos secreted by Raw264.7 cells were internalized by podocytes(immunofluorescence staining,×500;Scale=50 μm)图3 Raw264.7细胞分泌Exos被足细胞内化(免疫荧光染色,×500;比例尺=50 μm)
Tab.1 The cell viability of podocytes at different concentrations of HG-Exos determined by CCK-8 method表1 2组经CCK-8法测定不同HG-Exos剂量干预后足细胞的细胞活力 (n=3,%,±s)
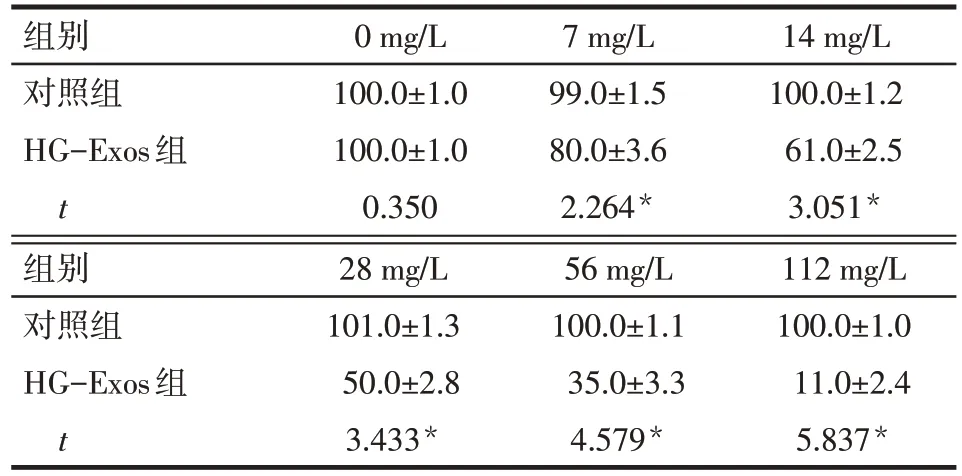
Tab.1 The cell viability of podocytes at different concentrations of HG-Exos determined by CCK-8 method表1 2组经CCK-8法测定不同HG-Exos剂量干预后足细胞的细胞活力 (n=3,%,±s)
*P<0.05
组别对照组HG-Exos组t 0 mg/L 100.0±1.0 100.0±1.0 0.350 7 mg/L 99.0±1.5 80.0±3.6 2.264*14 mg/L 100.0±1.2 61.0±2.5 3.051*组别对照组HG-Exos组t 28 mg/L 101.0±1.3 50.0±2.8 3.433*56 mg/L 100.0±1.1 35.0±3.3 4.579*112 mg/L 100.0±1.0 11.0±2.4 5.837*
Tab.2 The cell viability of podocytes exposed to HGExos at different time points determined by CCK-8 method图2 2组经CCK-8法测定不同HG-Exos干预时间后足细胞的细胞活力 (n=3,%,±s)
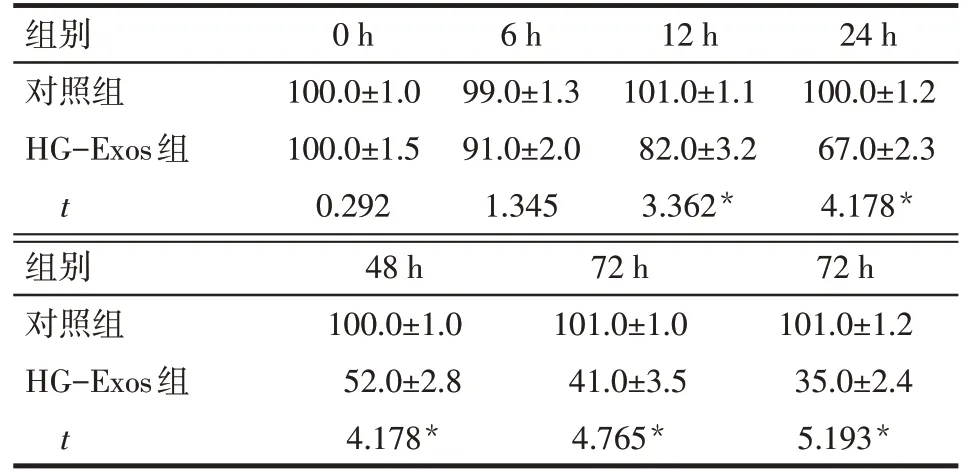
Tab.2 The cell viability of podocytes exposed to HGExos at different time points determined by CCK-8 method图2 2组经CCK-8法测定不同HG-Exos干预时间后足细胞的细胞活力 (n=3,%,±s)
*P<0.05
组别对照组HG-Exos组t 0 h 100.0±1.0 100.0±1.5 0.292 6 h 99.0±1.3 91.0±2.0 1.345 12 h 101.0±1.1 82.0±3.2 3.362*24 h 100.0±1.2 67.0±2.3 4.178*组别对照组HG-Exos组t 48 h 100.0±1.0 52.0±2.8 4.178*72 h 101.0±1.0 41.0±3.5 4.765*72 h 101.0±1.2 35.0±2.4 5.193*
2.3 HG-Exos 通过抑制自噬诱导足细胞损伤 Western blot 结果显示,与0 mg/L HG-Exos 组比较,7 mg/L、14 mg/L 和28 mg/L HG-Exos 组足细胞中Nephrin、Beclin 1、LC3B 蛋白表达水平均明显降低(P<0.05),见图4。TEM 显示,与0 mg/L HG-Exos组(7.7±1.0)比较,7 mg/L(5.4±0.8)、14 mg/L(3.8±0.7)和28 mg/L(1.8±0.4)HG-Exos 组含有双层膜结构的自噬小体数量均显著减少(F=32.163,P<0.05),见图5。
2.4 自噬对HG-Exos 细胞毒性的影响 Western blot 结果显示,HG-Exos 组、氯喹组、HG-Exos+氯喹组Nephrin、Beclin 1、LC3B蛋白表达水平均明显低于对照组(均P<0.05);雷帕霉素组、HG-Exos+雷帕霉素组Nephrin、Beclin 1、LC3B蛋白表达水平明显高于HG-Exos 组、氯喹组和HG-Exos+氯喹组(P<0.05);HG-Exos 组、氯喹组和HG-Exos+氯喹组Nephrin、Beclin 1、LC3B 蛋白表达水平差异均无统计学意义(P>0.05),见图6。TEM显示,各组间自噬体数量差异有统计学意义(F=95.092,P<0.05)。HG-Exos 组(1.60±0.45)、氯喹组(1.51±0.42)、HG-Exos+氯喹组(0.84±0.24)自噬体数量明显少于对照组(7.22±1.34),雷帕霉素组(11.16±1.03)、HG-Exos+雷帕霉素组(6.96±0.87)自噬体数量明显多于HG-Exos 组、氯喹组和HG-Exos+氯喹组(P<0.05);HG-Exos 组、氯喹组和HG-Exos+氯喹组自噬体数量差异均无统计学意义(P>0.05),见图7。
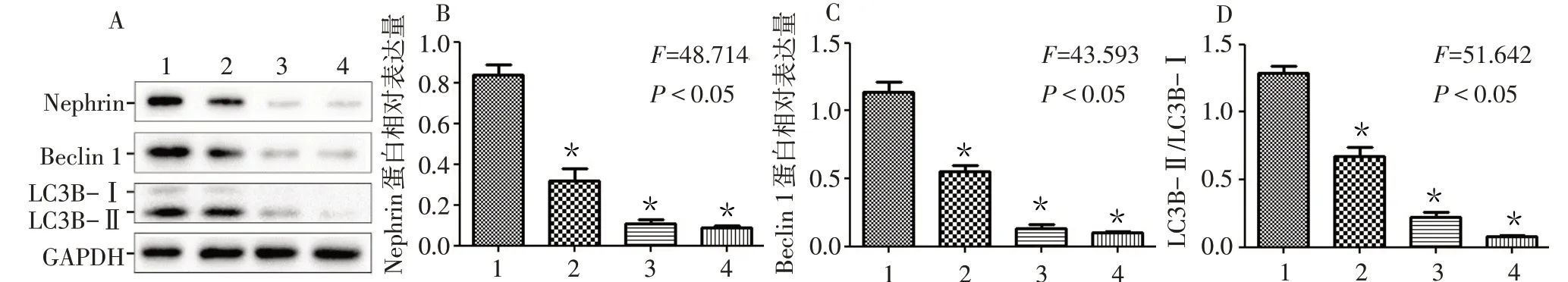
Fig.4 Effects of different concentrations of HG-Exos on the expressions of LC3B,Beclin 1 and Nephrin autophagy related proteins in podocytes detected by Western blot assay图4 Western blot检测不同剂量HG-Exos对足细胞中Nephrin、Beclin 1、LC3B蛋白表达的影响

Fig.5 Effects of different concentrations of HG-Exos on autophagy detected by transmission electron microscope (×60 000)图5 TEM观察不同剂量HG-Exos对自噬小体的影响(×60 000)

Fig.6 The effects of chloroquine,rapamycin and HG-Exos on the expressions of LC3B,Beclin 1 and Nephrin autophagy related proteins in podocytes detected by Western blot assay图6 Western blot检测6组足细胞中Nephrin、Beclin 1、LC3B蛋白的表达
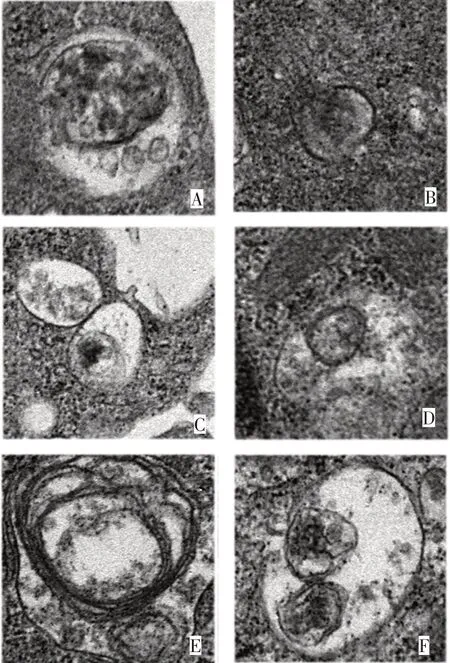
Fig.7 The effects of chloroquine,rapamycin and HG-Exos on autophagy detected by transmission electron microscope(×60 000)图7 TEM观察氯喹、雷帕霉素和HG-Exos对自噬体的影响(×60 000)
3 讨论
巨噬细胞是体内外介导肾脏炎症反应最重要的免疫细胞之一[8]。有研究显示,糖尿病小鼠肾脏巨噬细胞的活化与高血糖、糖化血红蛋白、蛋白尿、肾小球和肾小管损伤程度呈正相关[9-10]。此外,糖尿病大鼠模型实验证实了巨噬细胞诱导的信号传导与肾损伤严重程度密切相关[11]。但是,在糖尿病状态下巨噬细胞和肾小球足细胞之间的通讯机制尚有待阐明。近年来,越来越多的证据表明,在生理和病理条件下,Exos可以将功能分子转移到靶细胞上,并充当细胞间联系的介质[12]。本研究结果显示,HG处理的Raw264.7细胞产生的Exos数量明显多于NG处理的Raw264.7细胞,且HG-Exos 可以剂量和时间依赖的方式降低足细胞的细胞活力;此外,与对照组相比,HG-Exos 降低了足细胞中Beclin 1、LC3B蛋白表达水平,并减少了自噬小体数量,提示HG-Exos具有通过减少自噬而损伤足细胞的能力。以上结果表明在糖尿病中,Exos 介导巨噬细胞与足细胞的相互作用,参与DN的发病机制。足细胞是位于肾小球基底膜的高度分化的细胞,参与维持肾小球滤过屏障,所有形式的肾病综合征均以足细胞异常为特征[13]。足细胞狭缝横隔膜控制着肾小球滤过屏障的结构和功能。由狭缝横隔膜表达的Nephrin 蛋白对滤过屏障的完整性具有重要作用,其可作为足细胞的标志物,并已被证实与蛋白尿有关[14]。本研究结果显示,7 mg/L、14 mg/L和28 mg/L HG-Exos刺激后,Nephrin蛋白表达水平明显低于0 mg/L HG-Exos 组,提示HG-Exos刺激后足细胞出现损伤迹象。
自噬是一种高度保守的溶酶体途径,参与受损细胞器的清除。自噬失调导致多种疾病的发病,包括癌症、神经变性、心脏病和某些肾脏疾病[15]。近年来研究表明,足细胞中自噬的激活可能是预防DN进展的潜在治疗选择[16-17]。以往研究证明了可通过增强自噬水平对HG 诱导的细胞损伤发挥保护作用[18]。Beclin 1和LC3B是调节自噬体膜的必需蛋白质。LC3B-Ⅱ/LC3B-Ⅰ比值与自噬体数目呈正相关。上调Beclin 1、LC3B 蛋白表达可减轻HG-Exos对足细胞的损伤。据报道,抑制自噬与足细胞去分化有关,自噬缺陷促进足细胞损伤[19]。本研究结果显示,与对照组相比,HG-Exos刺激可以剂量依赖的方式导致自噬体数量减少,提示HG-Exos 的剂量上调与自噬的下调有关,从而导致足细胞损伤。为了进一步研究HG-Exos对自噬介导的足细胞损伤的抑制作用,采用自噬抑制剂氯喹或mTOR 抑制剂雷帕霉素与HG-Exos 进行联合处理。结果显示,HGExos+雷帕霉素组Nephrin、Beclin 1、LC3B 蛋白表达水平以及自噬体数量明显高于HG-Exos 组,提示雷帕霉素可减弱HG-Exos 的细胞毒性。因此,再次验证HG-Exos通过降低足细胞内的自噬水平诱导细胞损伤。
综上所述,HG 诱导的巨噬细胞Exos 可以剂量和时间依赖性地降低细胞活力和增加足细胞损伤。此外,HG 诱导的巨噬细胞Exos 能有效地降低足细胞自噬,诱导足细胞损伤,雷帕霉素联合治疗可挽救足细胞损伤。本研究为HG诱导的巨噬细胞Exos引起肾损伤提供了一个新的治疗靶点,但尚需进一步阐明参与自噬激活的特定分子机制和信号途径。

