人乳头瘤病毒DNA基因分型和E6/E7 mRNA检测在宫颈癌筛查中的临床价值
陆 璐,成 建
1江苏卫生健康职业学院生化教研室,江苏 南京 211800;2南京医科大学附属妇产医院产前诊断中心,江苏 南京 210004
宫颈癌是妇科常见的恶性肿瘤之一,发病率在我国女性恶性肿瘤中位居第二。宫颈癌的发生、发展与人乳头瘤病毒(human papillomavirus,HPV)的感染密切相关[1]。不同的HPV亚型具有不同的致病性。目前已分离出HPV 亚型120 余种,其中常见高危型有18种。临床上常用的HPV DNA 基因分型检测能反映宫颈上皮细胞的病毒种类和载量,但对病毒的活动程度无法知晓。研究发现,高危型HPV E6/E7 mRNA可反映致癌基因E6/E7的活动度,其过度表达是宫颈癌及癌前病变发生的关键[2]。本研究通过比较HPV DNA基因分型检测和HPV E6/E7 mRNA 检测结果,评估两种方法在宫颈癌早期筛查中的诊断价值。
1 对象和方法
1.1 对象
选取2018年1月1日—12月31日在南京医科大学附属妇产医院妇科、宫颈科、妇女保健门诊就诊,并自愿接受宫颈部位HPV DNA 基因分型检测及HPV E6/E7 mRNA 检测的女性,年龄18~88 岁。其中,接受HPV DNA 基因分型检测的样本共29 081 例,接受E6/E7 mRNA 检测的样本共22 562例。本研究经医院伦理委员会批准,所有被检者均知情同意。
1.2 方法
1.2.1 标本采集
标本使用专用HPV 采样刷,由门诊医生取宫颈脱落细胞储存于有专用细胞保存液的取样管中,4 ℃冰箱保存,1 周内检测。
1.2.2 HPV DNA分型检测
使用亚能生物技术(深圳)有限公司生产的人乳头瘤病毒(HPV)基因分型检测试剂盒及人乳头瘤病毒分型基因芯片检测系统,对23种HPV基因型进行检测,其中包括18 种高危型(HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV53、HPV56、HPV58、HPV59、HPV66、HPV68、HPV73、HPV83、HPV82)和5种低危型(HPV6、HPV11、HPV42、HPV43、HPV81)。检测过程严格按照试剂盒及检测系统说明书进行,包括标本DNA 提取、聚合酶链反应(polymerase chain reac⁃tion,PCR)、导流杂交。根据芯片上HPV 基因型分布的相应位点进行判读。
1.2.3 HPV E6/E7 mRNA检测
使用美国豪洛捷公司(Hologic)研发的Aptima HPV(14种高危亚型)试剂盒、Aptima HPV 16、HPV 18/45 分型检测试剂盒及Panther一体化检测平台进行HPV E6/E7 mRNA 检测。检测过程分为两个步骤,第一步:使用Aptima HPV(14 种高危亚型)试剂盒对14 种高危型(HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56、HPV58、HPV59、HPV66、HPV68)E6/E7 mRNA 进行检测;第二步:使用Aptima HPV 16、HPV18/45 分型检测试剂盒对第一步检测结果阳性的样本进行HPV16、HPV18/45分型检测。检测操作过程严格按照试剂盒及检测系统说明书进行(该检测过程为全自动、一体化过程,仅需将检测试剂、样本放入后机器运行检测程序即可)。检测结果判读:系统自动读出“阴性、HPV 16型阳性、HPV 18/45型阳性、其他阳性”4种结果。
1.3 统计学方法
应用SPSS16.0软件进行统计分析,以百分率作为HPV 感染的统计描述。两样本间率的比较采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 两种检测方法检测结果分析
在接受HPV DNA 基因分型检测的29 081 例样本中,共检出阳性例数8 602 例,HPV 阳性率为29.57%(8 602/29 081),其中高危型阳性例数7 425例,高危型阳性率为25.53%,占86.32%(7 425/8 602)。检测的23 种HPV 亚型均有检出,高危型HPV 感染前5 名依次为HPV52、HPV16、HPV53、HPV58、HPV51,占阳性例数百分比分别为22.13%(1 904/8 602)、14.32%(1 232/8 602)、13.22%(1 137/8 602)、10.63%(914/8 602)、9.13%(785/8 602)。在接受E6/E7 mRNA 检测的22 562 例样本中,共检出阳性病例2 840 例,高危型阳性率为12.59%(2 840/22 562),其中HPV16 阳性患者557 例,占19.61%(557/2 840),HPV18/45 阳性患者198 例,占6.97%(198/2 840),其他类型阳性患者2 091例,占73.63%(2 091/2 840)。具体检测结果见表1。
2.2 不同年龄段高危型阳性率比较
采用HPV DNA 基因分型和E6/E7 mRNA 检测结果按不同年龄段分组,各组检测例数和高危型阳性例数详见表2。HPV DNA 基因分型检测,高危型阳性率最高峰出现在<25 岁年龄段;HPV E6/E7 mRNA检测,高危型阳性率排名前二的分别是≥65岁年龄段、55~<65岁年龄段。卡方检验结果显示,两种检测方法中,在不同年龄段间高危型阳性率的差异均有统计学意义(P<0.05);但各年龄段间两两比较,两种检测方法中,55~<65岁年龄段与≥65岁年龄段间高危型阳性率差异均无统计学意义(P>0.05)。
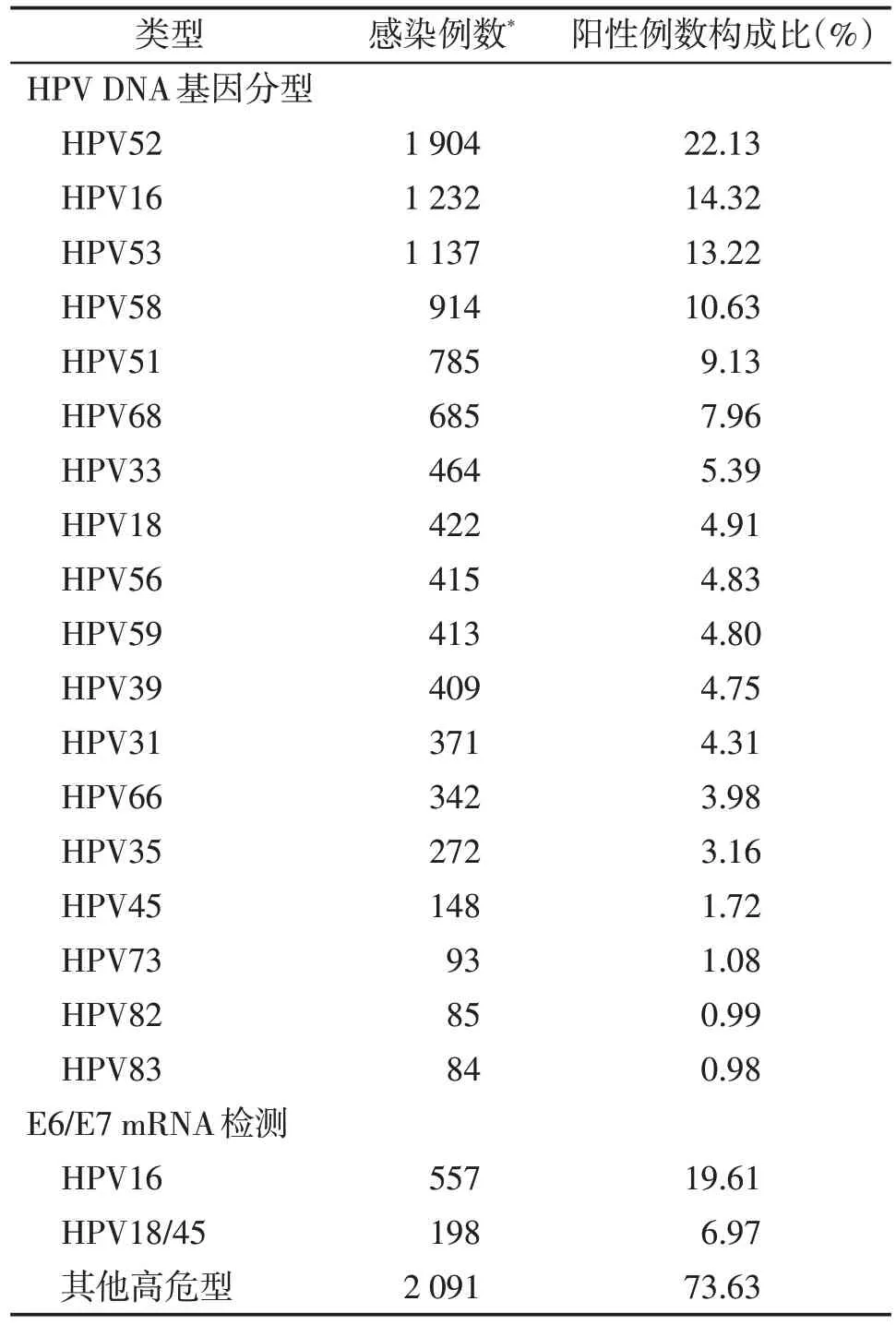
表1 两种检测方法检测结果一览表
2.3 不同年龄段两种检测方法HPV16、HPV18/45阳性率比较
不同年龄段,两种检测方法的HPV16、HPV18/45阳性例数见表3。卡方检验结果显示,除55~<65岁年龄段、≥65岁年龄段,其余年龄段两种检测方法检测的HPV16、HPV18/45阳性率差异均有统计学意义(P<0.05)。
3 讨论
HPV是一组无包膜的小DNA病毒,属乳头瘤病毒科。持续高危型HPV 感染是导致宫颈癌的主要原因,其分型检测在宫颈癌筛查中具有举足轻重的作用[3]。
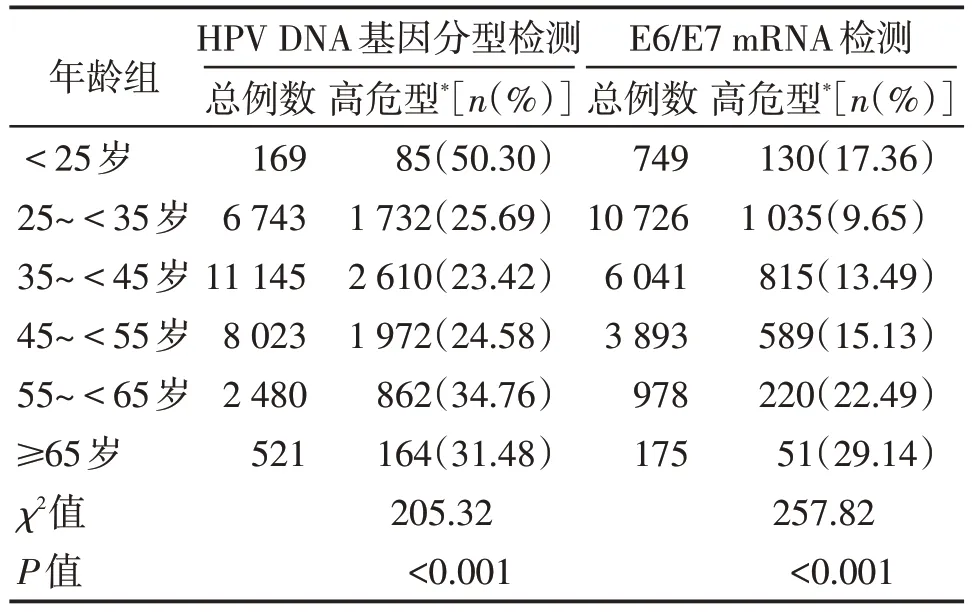
表2 不同年龄段高危型阳性率比较
在本研究中,HPV DNA分型检测结果显示,阳性构成比排名前五的亚型分别为HPV52(22.13%)、HPV16(14.32%)、HPV53(13.22%)、HPV58(10.63%)、HPV51(9.12%)。尽管在世界范围内,高危型HPV基 因 型 排 序 是HPV16、HPV18、HPV31、HPV58、HPV52,但多项研究数据显示,亚洲地区HPV58、HPV52的阳性率超过HPV18[4-5]。然而,对宫颈癌患者的研究显示,HPV16和HPV18依然是最常见的感染亚型[6]。相较于HPV16、HPV18,其他高危型HPV的致癌风险相对较低。女性一生中感染HPV 的概率高达80%,其中90%的感染是一过性的,2~3年可被自身免疫清除。这就导致HPV DNA 基因分型检测在实际应用中假阳性率偏高,由此可能导致不必要的阴道镜检查,加重患者的心理压力和经济负担。因此,寻找敏感度较好且更特异的HPV检测方法是目前研究的热点。
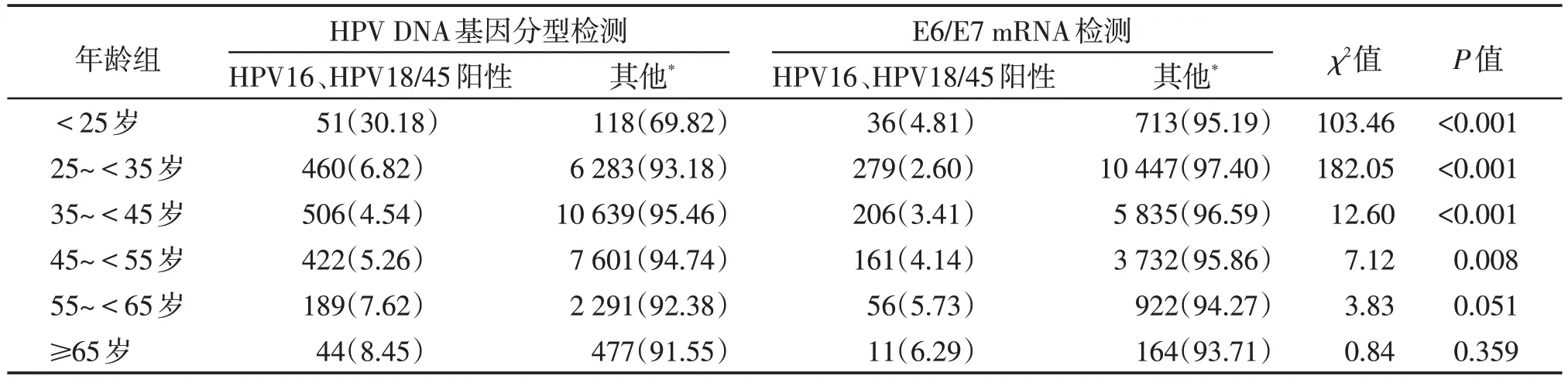
表3 不同年龄段中两种检测方法HPV16、18/45阳性率比较 [n(%)]
Aptima HPV E6/E7 mRNA检测作为一种宫颈癌前病变早期筛查的新技术,能有效评估宫颈上皮细胞因E6/E7 癌基因表达导致的病变程度[7]。高危型HPV 持续感染基底层细胞后,病毒E6/E7 癌基因的表达水平会受细胞分化程度和患者免疫水平的影响。HPV E6/E7 mRNA 的表达是宫颈癌发生发展的重要因素[8]。E6/E7 mRNA 检测相比DNA检测,前者能更加精准地发现具有临床重要性的感染[9]。本研究中妇女宫颈高危型HPV E6/E7 mRNA 阳性者所占比例为12.59%(2 840/22 562),低于HPV DNA 基因分型检测的高危型阳性率25.53%(7 425/29 081)。
为了更客观地比较两种检测方法阳性率的差异,本研究对这两种检测方法都包含的3 种型别(HPV16、HPV18/45)阳性率分年龄段比较。卡方检验结果显示,除55~<65 岁年龄段、≥65 岁年龄段,其余年龄段两种检测方法中HPV16、HPV18/45 阳性率的差异均有统计学意义(P<0.05)。这可能是因为HPV DNA 分型检测是对宿主细胞内游离状态与整合状态的HPV DNA 进行检测,特异性相对较低。而HPV E6/E7 mRNA 仅检测整合状态的病毒RNA 片段,大大减少“假阳性”出现的概率。但在55~<65 岁、≥65岁两个年龄段,这两种检测方法中HPV16、HPV18/45 阳性率差异无统计学意义,这可能与机体清除率下降、持续性感染率增高有关。同时提示,在这两个年龄段,两种方法的筛查效率相近。
本研究按照年龄对样本进行分段,不同年龄段之间,两种检测方法中高危型阳性率的分布差异均有统计学意义(P<0.05),说明按这种年龄段分组的研究方法有一定的临床意义。
在接受HPV DNA基因分型检测的标本中,高危型阳性率最高峰出现在<25 岁年龄段(50.30%),与浙江、上海的报道相似[10-11]。这可能与本研究中25 岁以下年龄段就诊的女性性生活开始早、性伴侣多有关。而HPV E6/E7 mRNA检测中<25年龄段HPV16、HPV18/45 阳性率明显低于HPV DNA 分型检测。这提示该年龄段女性机体有着良好的病毒清除能力,大部分病例仅为一过性感染。因此,对于<25岁年轻女性,不推荐进行HPV筛查。同时,在经济条件允许的情况下,可考虑尽早接种HPV疫苗。
在接受高危型HPV E6/E7 mRNA 检测的标本中,高危型阳性率排名前二的分别是≥65岁年龄段、55~<65 岁年龄段。这虽然与HPV DNA 分型检测的年龄分布模式不尽相同有关,但两种检测方法的结果提示这两个年龄段妇女HPV 感染率高、E6/E7阳性率高。这可能与这两个年龄段妇女体内激素水平低、波动大,易引起免疫功能失调导致病毒的再活动有关[12]。该年龄人群普遍已绝经,宫颈上皮萎缩后以中层及外底层细胞为主,细胞学检查的假阳性率比较高。因此单独进行HPV 筛查在这两个年龄段有着重要的临床意义。
此外,值得一提的是,各年龄段间两两比较,两种检测方法中,55~<65 岁年龄段与≥65 岁年龄段间高危型阳性率差异均无统计学意义(P>0.05)。这就提示我们,在后续的研究中可以将这两个年龄段合并研究。
HPV E6/E7 蛋白的表达是HPV 病毒活跃的信号。与HPV DNA基因分型检测相比,E6/E7 mRNA检测能有效剔除HPV 一过性感染造成的假阳性结果,提高筛查效率,减少过度诊断和治疗。但是,目前HPV E6/E7 mRNA 检测阳性只是一个定性结果,国内外对其定量检测的最佳诊断临界点尚存在一定争议[13],其与宫颈病变严重程度的相关性也仍需深入探讨。本次研究只对两种筛查方法进行了简单对比,二者的临床应用价值的比较还有待进一步加强。

