伊立替康联合X线照射对人结肠癌细胞增殖和凋亡的影响
席栋宾,张怀霞,徐玉珩,刘 毅,张延英
1酒泉市人民医院胃肠外科,甘肃 酒泉 735000;2甘肃中医药大学实验动物中心,甘肃 兰州 730000
结直肠癌是世界上最常见的癌症之一,也是与癌症相关死亡的第二大原因[1]。近年来,尽管发达国家的结直肠癌发病率已开始下降,但发展中国家的结直肠癌发病率仍保持急剧上升的态势[2]。外科手术是目前结直肠癌的主要治疗手段,但术后往往因发生转移或复发而影响预后[3-4]。远处转移是导致结直肠癌患者死亡的主要原因,肝脏是结直肠癌患者最常见的转移位点[1]。辅助放化疗可以降低术后复发率和转移率、提高患者的长期生存率。伊立替康(CPT⁃11)是一种选择性拓扑异构酶Ⅰ抑制剂,临床上广泛应用于肿瘤治疗,包括转移性结直肠癌复发患者以及恶化病例的治疗。有研究报道,CPT⁃11 可抑制食管癌EC109 细胞增殖并具有放射增敏作用[5],而有关伊立替康联合X 线的联合应用对人结肠癌细胞系HCT⁃116的作用研究尚未曾报道,故本实验研究CPT⁃11 对人结肠癌细胞系体外增殖以及放射敏感性的影响。
1 材料和方法
1.1 材料
HCT⁃116 细胞购自中国科学院上海细胞所,CPT⁃11、二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)、普通RIPA 裂解液和AO 染色液均购自北京索莱宝科技有限公司,RPMI 1640 培养基和胎牛血清购自美国Gibco 公司,兔抗p53、p21 及内参GAP⁃DH 抗体购自美国Immunoway公司;CO2恒温培养箱购自美国Thermo Forma公司,酶标仪购自美国BIO⁃RAD公司,全自动蛋白质印迹定量分析系统购自美国Protein Simple 公司,荧光显微镜购自日本奥林巴斯公司。
1.2 方法
1.2.1 HCT⁃116细胞的体外培养及传代
HCT⁃116 细胞培养于含10%灭活胎牛血清的RPMI 1640 培养基中,加入100 U/mL 青霉素和100 μg/mL 链霉素,于37 ℃、5%CO2的饱和湿度培养箱中传代培养。用倒置显微镜观察细胞生长状况,每3 d传代1 次,选对数生长期细胞进行实验。
1.2.2 MTT实验
常规消化对数期细胞后,用含10%胎牛血清的RPMI 1640培养液配制单细胞悬液,以每孔2 000个细胞密度接种到96孔板,每孔体积为200 μL。贴壁后,用不同浓度CPT⁃11(10、20、30、40、50 μg/mL)作用24 h 或单次不同剂量X 线(3、6、9、12、15 Gy)照射,每个剂量组3个复孔。继续培养48 h,每孔加入20 μL MTT 溶液,继续孵育4 h,终止培养。每孔加150 μL DMSO 并振荡10 min。在酶标仪490 nm 波长处测定各孔吸光度值。细胞增殖抑制率=(1-实验组吸光度/对照组吸光度)×100%。
1.2.3 克隆形成实验
常规消化对数期细胞后,用含10%胎牛血清的RPMI 1640培养液配制单细胞悬液,以每孔1 000个细胞密度接种到6 孔板,每孔体积为200 μL。贴壁后,6 Gy X线照射(照射组)或预先用10 μg/mL浓度CPT⁃11 作用24 h 后联合6 Gy X 线照射(联合处理组),继续培养10 d 后,加入5 mL 甲醇固定10 min。加入适量0.1% 结晶紫染色15 min,在显微镜下计数大于50个细胞的克隆数。计算公式为:克隆形成率=(克隆形成平均数/接种细胞数)×100%。实验重复3次。
1.2.4 蛋白提取和全自动蛋白表达定量分析
常规收集3 组细胞,并用预冷PBS 洗1 遍,每瓶细胞加入200 μL RIPA 裂解液于冰上裂解10 min。将裂解后的样品12 000g离心5 min,取上清,BCA法测蛋白浓度。按照Wes 标准流程上机检测,终浓度为1 mg/mL。
1.2.5 AO/EB实验
常规消化对数期细胞后,接种到6 孔板。贴壁后,6 Gy X线照射(照射组)或预先用10 μg/mL浓度CPT⁃11 作用24 h 后联合6 Gy X 线照射(联合处理组)。继续培养24 h后,加入5 mL甲醇固定10 min。加入AO/EB 工作液,室温避光染色20 min,倒置荧光显微镜下计数并拍照。吖啶橙可透过正常细胞膜,故细胞核呈绿色荧光;对于凋亡细胞,因染色质固缩或断裂形成凋亡小体,表现为黄绿色荧光。
1.3 统计学方法
应用SPSS 22.0 统计软件对数据进行统计分析,计量资料用均数±标准差()表示,多组比较采用单因素方差分析,两组细胞增殖率比较采用广义线性模型分析,以剂量作为自变量,试验组别作为分组因素,剂量和组别的乘积作为交互因素,对不同试验组别得到的两条直线的斜率进行比较,若交互项有统计学意义,说明自变量剂量对结果变量细胞增殖率的影响在不同组别中有差异。以P<0.05为差异有统计学意义。
2 结果
2.1 CPT⁃11对HCT⁃116细胞增殖的抑制作用
采用MTT 法检测10~50 μg/mL 的CPT⁃11 作用HCT⁃116 细胞后的增殖情况,结果显示在此范围内呈剂量依赖性抑制细胞增殖(图1)。根据以往的研究,CPT⁃11对HCT⁃116细胞的IC20为9.64 μg/mL,为避免CPT⁃11 的毒性作用,本实验选择10 μg/mL 进行后续研究。
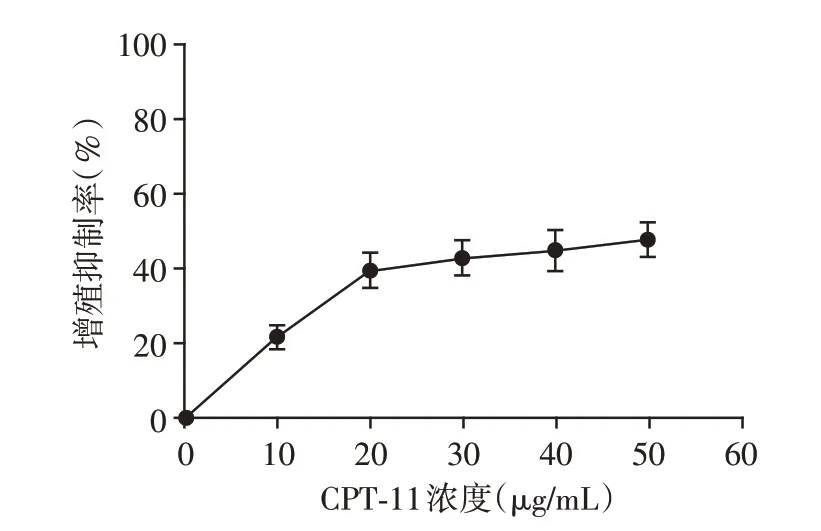
图1 不同浓度CPT⁃11对HCT⁃116细胞增殖的抑制作用Figure 1 Inhibitory effect of different concentrations of CPT⁃11 on proliferation of HCT⁃116 cells
2.2 单次不同剂量X 线照射对HCT⁃116 细胞增殖的影响
对于经10 μg/mL CPT⁃11 预处理24 h 的HCT⁃116 细胞和对照HCT⁃116 细胞分别给予3、6、9、12、15 Gy X线照射,恢复24 h后,采用MTT法检测细胞增殖情况,发现联合处理组增殖抑制率大于照射组,差异有统计学意义(F=55.34,P<0.001)。随着照射剂量的增加,联合处理组的增殖抑制作用更加明显,差异有统计学意义(P<0.05,图2)。
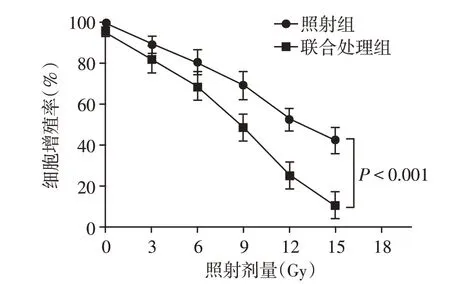
图2 不同剂量X线照射对HCT⁃116细胞增殖的影响Figure 2 Effect of different doses of X⁃ray irradiation on proliferation of HCT⁃116 cells
2.3 CPT⁃11 联合X 线照射对HCT⁃116 细胞克隆形成的影响
通过克隆形成实验,检测对照组、照射组和联合处理组集落形成情况,结果与对照组相比,照射组和联合处理组的集落形成数量都明显减少,差异有统计学意义(P<0.01);且联合处理组的集落形成数量少于照射组(P<0.05,图3)。
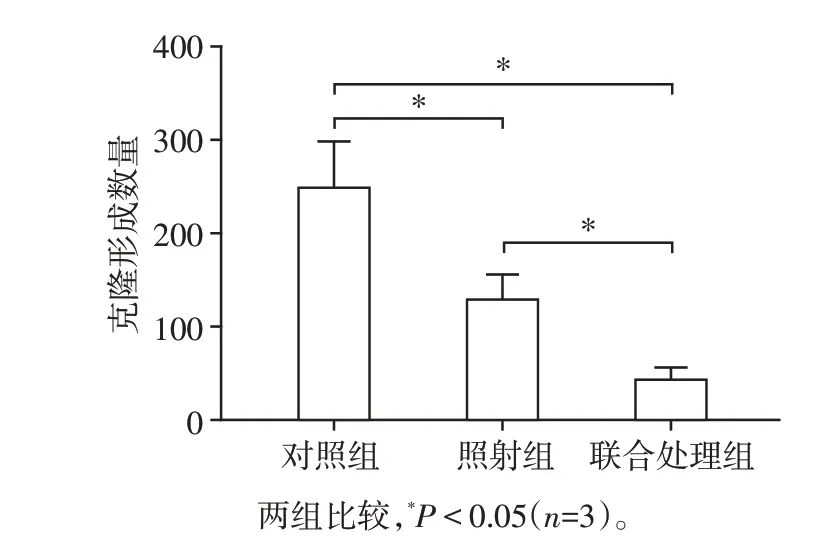
图3 CPT⁃11联合X线照射对HCT⁃116细胞克隆形成的影响Figure 3 Effect of CPT⁃11 combined with X⁃ray irradia⁃tion on colony formation of HCT⁃116 cells
2.4 CPT⁃11 联合X 线照射对HCT⁃116 细胞凋亡的影响
与对照组相比,照射组和联合处理组的凋亡率均升高,差异有统计学意义(P<0.05),且联合处理组的凋亡率更高,明显大于照射组(P<0.05,图4)。
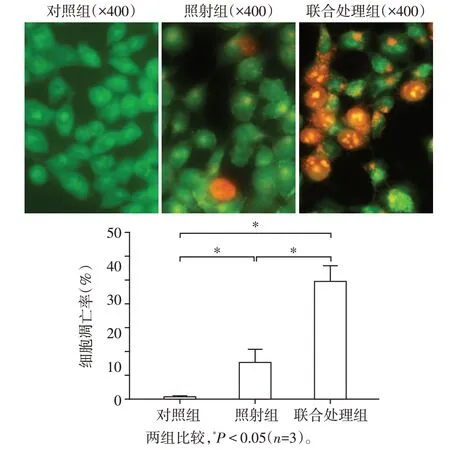
图4 CPT⁃11联合X线照射对HCT⁃116细胞凋亡的影响Figure 4 Effect of CPT⁃11 combined with X⁃ray irradia⁃tion on apoptosis of HCT⁃116 cells
2.5 CPT⁃11联合X线照射对HCT⁃116细胞p21、p53表达的影响
X线照射后,恢复6 h,与对照组相比,照射组和联合处理组的p21 和p53 蛋白均升高,差异有统计学意义(P<0.05),且联合处理组的p21 和p53 蛋白水平高于照射组(P<0.05,图5)。
3 讨论
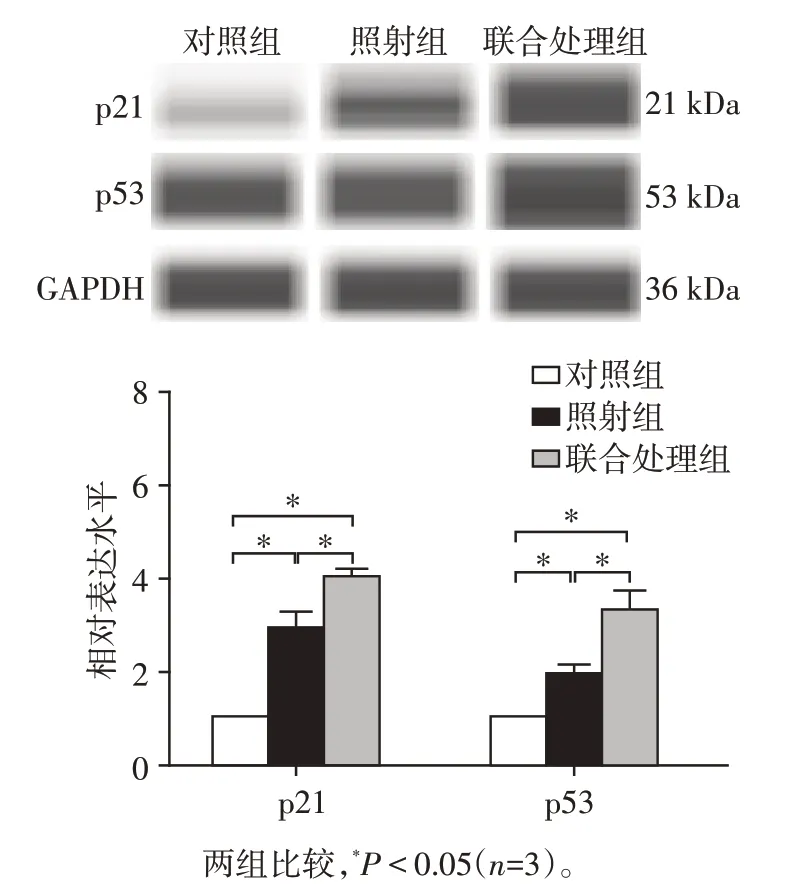
图5 CPT⁃11 联合X 线照射对HCT⁃116 细胞p21、p53 表达的影响Figure 5 Effect of CPT⁃11 combined with X⁃ray irradia⁃tion on the expression of p21 and p53 in HCT⁃116 cells
CPT⁃11 是喜树碱(camptothecin,CPT)的一种水溶性半合成衍生物。因为CPT⁃11 的广泛抗肿瘤活性,临床上用于肺癌、胃癌、卵巢癌和淋巴癌等多种肿瘤的治疗[6]。在DNA复制以及转录过程中,其通过与拓扑异构酶⁃1(Topo⁃1)结合,共同形成DNA Topo⁃1复合物。在此过程中,CPT⁃11及活性代谢产物(SN⁃38)可以通过与该复合物结合,从而阻断DNA 复制而达到抗肿瘤作用[7-8]。目前,CPT⁃11已获批用于转移性结直肠癌的辅助治疗,而以往的多项研究也发现其联合放疗时能增加放疗效果[5,9-11]。在伊立替康联合放疗治疗小细胞肺癌脑转移患者的报道中,其可显著降低患者的病死率,改善患者的生存状况[11],并且该治疗方法的有效性和安全性均较高,可有效提高疾病控制率,减少不良反应,提高患者的耐受程度。此外,CPT⁃11可有效抑制放疗早期宫颈癌细胞的增殖,提高放疗诱导的癌细胞凋亡率,结果显示宫颈肿瘤50%消退时间明显缩短,肿瘤体积缩小[9]。大多数放疗增敏剂的作用机制是,通过抑制细胞增殖并诱导凋亡来增强放射线对细胞的杀伤作用,故本研究进一步探讨CPT⁃11联合X 线照射对人结肠癌细胞HCT⁃116 增殖和凋亡的影响。
CPT⁃11 的主要不良反应是骨髓抑制和胃肠道不良反应,呈剂量依赖性,严重的腹泻反应限制了其临床应用。本研究结果显示,在10~50 μg/mL 范围内,CPT⁃11呈浓度依赖的方式抑制HCT⁃116细胞增殖,与以往研究报道一致。为进一步研究CPT⁃11联合X 线照射对HCT⁃116 细胞的放疗增敏效果,本研究选择10 μg/mL的CPT⁃11处理,约为CTP⁃11 对HCT⁃116 细胞的IC20浓度,毒性较轻。在MTT 实验和克隆形成实验中,与对照组和照射组相比,联合处理组增殖率明显提高,且随着照射剂量的增加,联合处理组的增殖抑制作用更加明显。CPT⁃11 在较低浓度下即具有增殖抑制和放射增敏作用,提示其临床应用中可采用低浓度CPT⁃11 联合X 线照射来提高结直肠癌的治疗效果,既可以减轻不良反应,还可以减轻患者负担、提高生存率。
放射治疗引起肿瘤细胞DNA 损伤进一步引起凋亡,是肿瘤治疗的基本策略。为进一步研究CPT⁃11 联合X 线照射对HCT⁃116 细胞凋亡的影响,AO/EB染色结果显示联合处理组细胞凋亡率显著提高,Western blot 检测其p21和p53蛋白水平也高于照射组,进一步提示应用CPT⁃11可增加HCT⁃116对X线照射的敏感性,诱导其凋亡。p53 是细胞内重要的抑癌基因,广泛参与DNA 损伤修复、细胞周期调控和凋亡等过程,对维持基因组的完整性和稳定性至关重要[12]。本研究中,HCT⁃116 细胞接受电离辐射及CPT⁃11处理后时,p53 能被迅速激活进而促进多种重要下游靶基因如p21 的激活,从而促进凋亡的发生。
综上所述,CPT⁃11 可抑制食管癌HCT⁃116细胞增殖并具有放射增敏作用,同时诱导凋亡,为临床上结肠癌的治疗提供一定的理论基础。

