新生儿先天性梅毒诊断准确性的回顾性分析
陈 豪 吴叶娟 包 涵 陈一欢 胡 勇 龚小慧 魏 东
上海市儿童医院 上海交通大学附属儿童医院新生儿科(上海 200062)
目前先天性梅毒(congenital syphilis,CS)的诊断仍具挑战性[1],给临床管理带来了混乱和困惑。成人梅毒可通过血清学实验得到明确诊断,而采用血清学检验诊断CS 有一定难度。这主要是由于母源性ⅠgG可跨胎盘至胎儿,所以对于<15 月龄的婴幼儿,血清学实验的诊断价值有限[2]。临床上需综合评估母亲疾病史、新生儿临床症状、影像资料以及血清学等证据。目前全世界尚没有统一CS 管理指南,不同组织推荐指南采用的诊断标准也不尽相同。比如美国疾病控制与预防中心(American Centers for Disease Control and Prevention,CDC) 性传播疾病管理指南(2015)[3]/2015美国儿科学会(American Academy of Pediatrics,AAP)感染委员会报告[4](以下称美国指南)纳入了4项指标,而2014年欧洲梅毒管理指南[5](以下称欧洲指南)和国家卫健委2015年版预防艾滋病、梅毒和乙肝母婴传播工作实施方案(以下称中国方案)[6]分别纳入了7项和3 项指标。现通过临床资料回顾分析,比较上述三种标准诊断CS的一致性情况,对统一CS诊断标准的必要性进行探索
1 对象与方法
1.1 研究对象
收集2016年1月—2020年2月入住上海交通大学附属儿童医院新生儿科,母孕前或孕期确诊梅毒感染的新生儿的临床资料,共85例,包括足月儿和早产儿。符合美国指南[3-4]、欧洲指南[5]或中国方案[6]等三个标准中任一标准的确诊/高度疑似和疑似病例归入CS,共40例。85例患儿均完成梅毒螺旋体(Treponema pallidum,Tp)和非Tp 抗体(包括母亲)、四肢长骨摄片[3]、听力、眼底和头颅影像学检查,40 例CS 患儿完成了脑脊液性病研究实验室实验(venereal disease research laboratory test,VDRL)检查。
1.2 方法
1.2.1 美国指南[3-4]共纳入了临床表现、病原检查、血清学检查(ⅠgG)以及母亲治疗情况等4 项指标(表1)。确诊或高度疑似病例需满足以下任意一项指标:①Tp抗体阳性,非Tp抗体较母体有4倍以上升高;②与CS 一致的阳性体征(非免疫性水肿、黄疸、肝脾肿大、鼻炎、皮疹、肢体假性瘫痪);③损害部位或体液暗视野显微镜发现梅毒螺旋体,或PCR发现梅毒螺旋体核酸。疑似诊断符合以下标准:新生儿无阳性梅毒体征、非TP抗体滴度不超过4倍母体滴度以及母体孕期不规范治疗。本研究将该标准中CS可能性小(母体孕期发现Tp抗体阳性,既往无梅毒感染史,患儿无阳性梅毒体征,非TP抗体滴度不超过4倍母体滴度,母体孕期规范治疗)和不可能(母体孕前有梅毒感染史,孕期Tp 抗体阳性,患儿无阳性梅毒体征,非TP 抗体滴度不超过4倍母体滴度,母体孕期规范治疗)的病例视为正常新生儿。
1.2.2 欧洲指南[5]共纳入了临床表现、病原检查、长骨摄片、脑脊液、血清学检查(ⅠgG和ⅠgM)以及母亲治疗情况等7 项指标(表1)。确诊病例需具有证实病原体证据,包括来自损伤部位、脐带、胎盘或病理组织的标本暗视野显微镜、荧光抗体或其他特殊染色证实Tp以及PCR证实Tp核酸阳性。疑似诊断需满足新生儿血清Tp 抗体阳性,具备以下任一项:①CS 阳性体征(持续鼻炎、扁平湿疣、骨炎、骨膜炎、骨软骨炎、腹水、皮肤黏膜损害、肝炎、肝脾肿大、肾小球肾炎、溶血性贫血);②长骨X线CS证据;③脑脊液VDRL阳性;④Tp 抗体或非Tp 抗体较母体4 倍以上升高;⑤Tp-ⅠgM阳性;⑥母体感染孕期未治疗或不规范治疗。
1.2.3 中国方案[6]共纳入了病原检查和血清学检查(ⅠgG和ⅠgM)等3项指标(表1)。确诊病例需满足以下任意一项指标:①儿童的皮肤黏膜损害或组织标本暗视野显微镜(或镀银染色)检测到Tp;②Tp-ⅠgM抗体检测阳性;③出生时非Tp抗体结果阳性,滴度≥母亲滴度的4倍,且Tp抗体阳性。
1.2.4 CS长骨摄片[7]双侧对称性多处受累,股骨、肱骨和胫骨最常波及。包括干骺端透亮带、对称的局部矿质丢失、胫骨干骺端中部骨质破坏、干骺端齿状线、新骨形成的骨干骨膜炎、密度增加和稀疏的不规 则区。排除新生儿佝偻病和早产儿代谢性骨病。
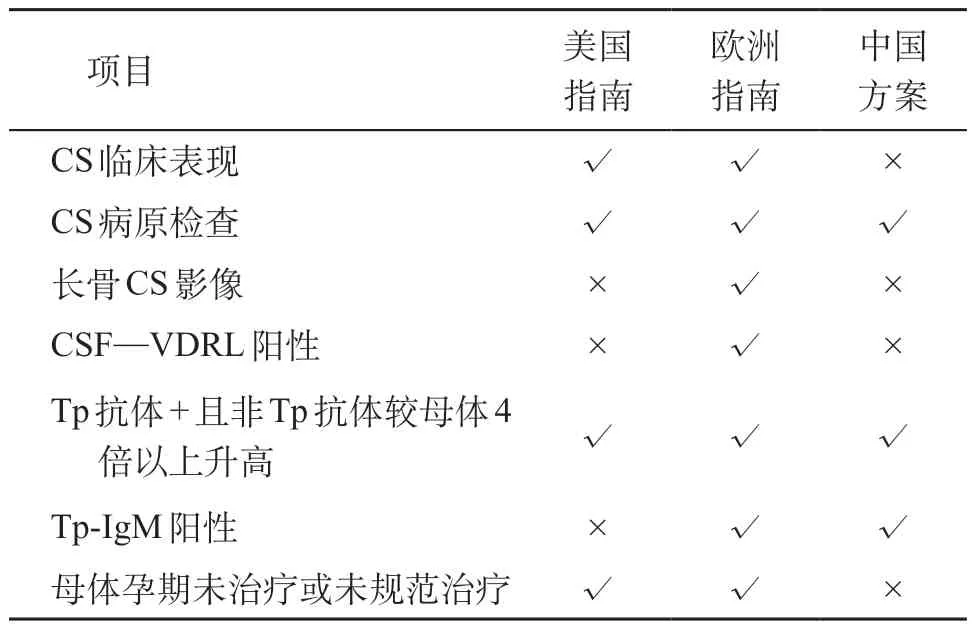
表1 三种CS诊断方案纳入指标
1.2.5 CS 新生儿血清学检测 Tp抗体阳性且非Tp抗体较母体升高4 倍以上;或Tp 抗体阳性且非Tp 抗体阳性(若母体非Tp 抗体阴性),或Tp-ⅠgM 阳性。见表1。
1.2.6 研究方案 因确诊/高度疑似与疑似病例的临床治疗策略相同,将二者均归入CS。对美国指南、欧洲指南和中国方案三者诊断一致性进行比 较。
1.2.7 CS治疗 根据美国指南[3-4],确诊/高度疑似和疑似病例,青霉素钠治疗2周(第一周每次5万U/kg,每12 小时1 次,第二周改为每次5 万U/kg,每8 小时1次)。可能性小和不可能的病例治疗方案为苄星青霉素5万U/kg,肌注1次。
1.3 统计学分析
采用SPSS 25.0统计软件进行数据处理。非正态分布计量资料以中位数(四分位数间距)表示。计数资料以例数(百分比)表示,组间比较采用χ2检验。计算加权κ 值,对诊断结果两两之间一致性进行检验;加权κ值<0.2为较差,0.21~0.40为一般,0.41~0.6为中等,0.61~0.8为较强,0.81~1.00为强。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
母孕期或孕期确诊梅毒感染的新生儿共85 例,女47例、男38例;入院时中位年龄2(1~5.78)小时,中位出生体质量3 120(2 920~3 597.5)g,中位胎龄39.14(37.71~40.07)周。
2.2 各标准诊断结果及一致性分析
美国指南诊断CS 32 例,欧洲指南诊断40 例,中国方案诊断15例,三个标准共诊断确诊/高度疑似以及疑似病例40 例,见表2。美国指南和中国方案诊断病例均包含于欧洲指南诊断病例,美国指南和国家方案诊断病例重复例数为14例(图1)。未发现合并有细菌、真菌和病毒所致的中枢感染,未发现有新生儿佝偻病和早产儿代谢性骨病患儿。

表2 美国指南、欧洲指南和中国方案一致性比较 (n)

图1 三种标准诊断病例数重复情况
美国指南、欧洲指南和中国方案诊断病例数两两一致性比较发现,美国指南与欧洲指南、美国指南与中国方案一致性较强,加权κ 值分别为0.611 和0.705,而欧洲指南与中国方案一致性一般,加权κ值0.304。见表2。
2.3 各诊断指标组合在患儿中分布
所有患儿Tp 抗体均阳性,共85 例,非Tp 抗体较母体4 倍以上升高14 例(16.47%),长骨影像学异常11例(12.94%),Tp-ⅠgM阳性2例(2.35%),脑脊液VDRL 阳性1 例(1.18%),母孕期规范治疗62 例(72.94%),不规范治疗23 例(27.06%)。上述5 项指标在不同的患儿存在不同的组合。Tp 抗体阳性+母孕期不规范治疗+其他指标阴性比例最高,达15例(17.64%),Tp 抗体阳性+非Tp 抗体滴度较母体4 倍以上升高+其他指标阴性第二达11 例(12.94%,母体孕期规范治疗9 例,不规范仅2 例),Tp 抗体阳性+长骨X线异常+其他指标阴性第三达10例(11.76%,母孕期规范治疗7 例,不规范治疗3 例)。少见的组合为Tp 抗体阳性+非Tp 抗体滴度较母体4 倍以上升高+Tp-ⅠgM 阳性1 例(1.18%,母孕期不规范治疗),Tp 抗体阳性+非Tp 抗体滴度较母体4 倍以上升高+VDRL阳性1例(1.18%,母孕期不规范治疗),Tp抗体阳性+非Tp抗体滴度较母体4倍以上升高+长骨X 线异常1 例(1.18%,母孕期不规范治疗),Tp 抗体阳性+Tp-ⅠgM 阳性1 例(1.18%,母孕期规范治疗)。见表3。入院后均无皮肤损害渗出 等典型梅毒体征,均未行暗视野显微镜检查和PCR检测。
具有Tp 抗体阳性和长骨影像学(远端高密度6例,低密度1 例,皮质增厚1 例,皮质欠光滑2 例)两项阳性指标符合欧洲指南的10 例CS 病例中,10 例均未被中国方案纳入诊断;其中7 例因母亲孕前或孕期接受规范治疗未被美国指南诊断,其余仅3 例因母孕期不规范治疗为美国指南诊断。Tp 试验阳性+Tp-ⅠgM 阳性1例未被美国指南诊断,均为其他两个标准诊断。Tp试验阳性+其他指标阴性仅母孕期不规范治疗15例未被中国方案诊断,均为其他两个标准诊断。

表3 各诊断指标组合在患儿中的分布情况
母孕期规范治疗62例,其所生新生儿发生CS 17例;不规范治疗23例,其所生新生儿均发生CS。
3 讨论
CS 流行有上升趋势[8-10],2018 年美国每10 万活产新生儿有33.1 例,较2017 年增加39.7%,较2014年增加185.3%[9]。我国CS 流行也呈上升趋势。2000年CS报告病例数为468例,报告发病率为2.63/10万活产数;2009 年报告病例数为10 757 例,报告发病率为60.81/10 万活产数;2013 年报告病例数为10 032例,报告发病率为69.9/10万活产数[10]。孕期发生的CS如不予规范治疗会产生高达80%的严重不良结局[2],未经治疗的孕早期梅毒,婴儿感染的风险达70%~100%,以及近1/3胎儿发生死产[5]。未治疗的CS婴儿,不论早期有无症状,常在2年后出现晚期梅毒的表现,可累及中枢神经系统、骨、关节、牙齿、眼和皮肤[4]。一些宫内CS 感染甚至出生后数年才出现症状,如角膜基质炎(5~20年)、第八对脑神经耳聋(10~40 年)、哈钦森牙、前额隆起、桑葚磨牙、鞍鼻、口周皮肤皲裂和克拉顿关节[4]。新生儿期及时发现CS并规范治疗,可阻止其发展为晚期梅毒[4]。
目前全世界尚无统一的CS 管理指南,不同组织推荐指南采用的诊断标准也不尽相同[1,3-6],给临床工作带来了极大的困惑。本研究发现,三个标准的诊断结果的一致性并不很强。美国指南未将单纯长骨X线异常7例、单纯Tp-ⅠgM阳性1例纳入诊断。欧洲指南纳入诊断的单纯长骨X线异常患儿仅有3例因母孕期不规范治疗为美国指南所诊断。中国方案未将单纯长骨X线异常10例、所有检查正常单纯母孕期不规范治疗的15 例纳入诊断。非Tp 试验滴度较母4 倍以上升高同时脑脊液 VDRL阳性1例,欧洲指南中将这种情况诊断为疑似CS,而在美国CDC 监测系统中将这种情况定义为神经性梅毒,并归入确诊CS[9,11],诊断为神经梅毒,但CDC监测系统强调其主要用于流行病监测,不推荐用于临床诊断[9,11]。
长骨X 线异常是早期CS 常见表现,可以是CS唯一表现[12-13],常出现在出生时或生后数周。X 线异常包括双侧对称性多处受累,股骨、肱骨和胫骨最常波及,包括干骺端透亮带、对称的局部矿质丢失和胫骨干骺端中部骨质破坏、干骺端齿状线、新骨形成的骨干骨膜炎、密度增加和稀疏的不规则区,严重者导致病理性骨折或疼痛,出现肢体假麻痹[7]。本研究中有10 例以长骨X 线改变为唯一表现,主要为长骨远端密度增高、皮质增厚、皮质欠光滑和低密度,未见上文所述中的其他改变。CS 也可无长骨X 线异常,研究发现有明显临床表现的CS 中长骨X 线异常只有60%~80%[12-13]。本研究中长骨X 线异常仅占12.94%。
ⅠgM抗体出现较早,在感染后第2周即可测出,可在抗梅毒治疗后随Tp 抗原消失而消失。如再感染或复发时ⅠgM 又可出现。而ⅠgG 在梅毒感染的第4 周开始产生[14]。ⅠgM 不通过胎盘,在新生儿血液中阳性通常用于证实胎儿时期的许多病原感染,但作为CS 诊断指标,其灵敏度和特异度均不够[3]。Tp-ⅠgM以前被美国CDC 用于CS 诊断,但因缺乏灵敏度[15-16],已被美国CDC 弃用[3]。但欧洲指南[5]和中国方案[6]仍采纳Tp-ⅠgM作为诊断标准。本研究仅发现2例(2.35%)Tp-ⅠgM阳性,敏感性较差。另外,母分娩时非Tp试验阴性并不能排除CS可能性,尽管这种情况少见[4],本研究发现1 例母非Tp 试验阴性,但新生儿非Tp 试验阳性,故仍将其归入CS。纵观上述三个标准,均未将这种情况纳入考虑。
即使母孕期规范治疗也不能完全防止其所生新生儿发生CS[8]。相关研究发现314例CS新生儿母亲接受了一次或以上产前检查,43例孕妇(13.7%)在孕期接受了正规治疗但其新生儿仍发生了CS[8]。在本研究中有62例孕期或孕前规范治疗,但其所生新生儿仍有17 例发生CS。这可能与孕期复发或再感染未及时发现有关[17]。
因为母孕期梅毒感染病史的不确定性,新生儿CS常缺乏症状和体征,而且CS 延迟诊断或误诊可能出现严重后果,所以新生儿CS 诊断和治疗遵循安全第一的原则[18]。只有将三个标准结合起来,才能兼顾到安全第一原则。美国指南以Tp和非TP滴度作为主要的确诊或高度疑似诊断标准,以母孕期是否规范治疗作为疑似诊断标准,操作简单,临床实用性强。中国方案没有考虑母亲未接受规范治疗的因素,这些母亲所生新生儿有发生CS的风险。欧洲指南比较全面,但确诊只有暗视野显微镜、特殊染色或PCR核酸检测阳性,临床不易开展。本研究显示欧洲指南诊断出CS病例最多,更符合安全第一原则。所以在临床工作中,以欧洲指南为基础,结合多种标准综合判断诊断新生儿CS可能更加合理。临床上制定统一的CS 标准非常必要。

