不同高原海拔地区动脉导管未闭儿童肺动脉压力特点
张 兴 苏忠剑 刘洪玉 肖 颖 郑 楠 闵杰青 张瑜华 李 斌
昆明市儿童医院心血管病内科(云南昆明 650034)
动脉导管未闭(patent ductus arteriosus,PDA)是儿童常见先天性心脏病之一,随着超声心动图技术的发展,“沉默型”PDA检出率升高,儿童PDA的发病率高达约1/500,约占儿童先天性心脏病的12%~15%[1]。云南省地处云贵高原,大部分地区海拔1 000~4 200 m,其中大部分居民均生活在2 000米以上,具有低气压、低氧含量的大气环境中,其大气压约70~90 kPa,氧分压约15~18 kPa。研究证实,长期暴露于高海拔地区,可使儿童PDA发病率明显增加,并可引起儿童肺血管收缩,肺动脉高压等病理改变[2]。目前,心导管检查术被公认为肺动脉血流动力学评估、肺动脉高压诊断的金标准[3]。因此,本研究利用心导管检查技术,运用COOK 5F心脏介入指引导管,LLC PX260压力传感器测量居住于云南省不同高原海拔地区单纯PDA 儿童的肺动脉收缩压(pulmonary artery systolic pressure,PASP)、肺动脉舒张压(pulmonary artery diastolic pressure,PADP)、肺动脉平均压(mean pulmonary artery pressure,mPAP),分析不同海拔地区不同管径PDA 儿童肺动脉压力(pulmonary artery pressure,PAP)特点,探讨高原大气环境对儿童PAP的影响。
1 对象与方法
1.1 研究对象
研究对象选自于2016年1月至2019年8月在昆明市儿童医院接受介入心导管检查及PAP 测定的PDA患儿。入选标准:①年龄0.5~14周岁;②出生并生活在云南省地区;③降主动脉造影显示PDA 最窄径线≤5 mm。剔除标准:①合并有其他心血管畸形儿童;②合并有呼吸、血液、肾脏等其他系统疾病儿童;③肺动脉高压与PDA病理生理特点不相符儿童。
根据心导管主动脉造影PDA最窄管径,将研究对象分为PDA≤2 mm组、~3 mm组及~5 mm组。根据研究对象居住地海拔,将研究对象分为<1 500 米组和≥1 500 米组。本研究经昆明市儿童医院医学伦理委员会批准。
1.2 方法
1.2.1 临床资料收集 采用问卷调查收集研究对象的临床资料,包括姓名、性别、出生日期、体质量、出生地、居住地,根据其居住地住址利用卫星地图等高线查询海拔高度,如居住地地址无确切记录则以该儿童居住县平均海拔计算。
1.2.2 心导管检查及肺动脉压力测定 研究对象均排除右心导管检查相关禁忌症,于介入导管室内予七氟烷吸入,舒芬太尼和依托咪酯静脉给药联合麻醉,穿刺右侧股静脉,建立股静脉→下腔静脉→右心房→右心室→肺动脉轨道,运用COOK 5 F 心脏介入指引导管置于肺动脉干,连接LLC PX 260 压力传感器分别测量PASP、PADP、mPAP数值。穿刺股动脉,建立股动脉→降主动脉轨道,运用COOK 5 F pigtail 心脏介入指引导管置于主动脉弓降部,使用飞利浦Allura XperFD 20 平板数字减影血管造影系统,通过美国MARK-V高压注射器注入造影剂,调整造影角度直至清楚显示动脉导管形态,并准确测量儿童动脉导管最窄径线。
1.3 统计学分析
采用统计学软件SPSS 22.0进行数据处理。符合正态分布的计量资料以均数±标准差表示;不符合正态分布的计量资料采用中位数(四分位间距)表示,组间比较采用Mann-WhiterU、Kruskal WallisH秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。运用双因素方差分析比较不同海拔及PDA最窄管径对于PASP、PADP、mPAP的影响。采用多元线性回归方法分析居住地海拔以及PDA最窄管径与mPAP的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
266例PDA患儿中男107例,女159例;中位年龄2.7(1.3~4.6)岁;居住地中位海拔1 855(1 600~1 897)米。PDA≤2 mm组162例,中位年龄3.0(1.6~4.8)岁,中位体质量13.0(10.5~17.0) kg;PDA~3 mm组61 例,中位年龄2.4(1.0~4.2)岁,中位体质量11.5(8.1~14.8)kg;PDA~5 mm组43例,中位年龄1.4(1.1~4.3)岁,中位体质量9.0(7.5~14.0)kg。不同PDA最窄管径组之间,儿童年龄、体质量以及性别分布的差异均有统计学意义(P<0.05)。见表1。
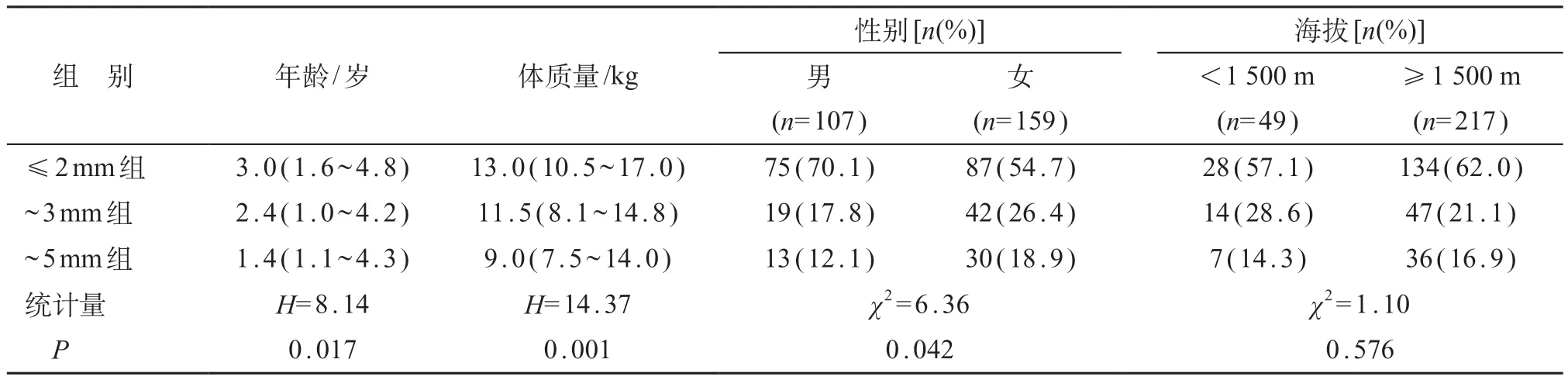
表1 不同PDA管径儿童基本特征
266例PDA儿童中,居住地海拔在<1 500 m 49例,中位年龄2.5(1.3~5.3)岁,中位体质量13.0(10.5~17.0)kg;≥1 500 m儿童217例,中位年龄2.7(1.3~4.6)岁,中位体质量12.0(9.2~16.5)kg。不同海拔组之间,儿童年龄、体质量以及性别分布的差异无统计学意义(H=0.022、0.010,χ2=0.668,P均>0.05)。
2.2 不同海拔PDA儿童肺动脉压力分布
居住地海拔在<1 500 m 和≥1 500 m 患儿的平均mPAP 分别为(24.0±5.8)mmHg 和(25.1±8.4)mmHg。不同海拔、管径PDA儿童肺动脉压力分布见表2。

表2 不同海拔、管径PDA儿童肺动脉压力分布
2.3 居住地海拔、PDA管径对儿童肺动脉压力影响
采用两因素方差分析探讨居住地海拔、PDA 管径对儿童肺动脉压力的影响,结果显示,不同居住海拔之间,PASP、PADP 及mPAP 差异均具有统计学意义(P<0.05)。不同管径PDA 儿童之间,PASP、PADP、mPAP 差异均具有统计学意义(P<0.001)。随海拔升高以及PDA管径增大,PASP、PADP、mPAP呈现增高趋势。见表3。以儿童mPAP作为因变量,居住地海拔(km)、PDA 最窄管径作为自变量,儿童性别、年龄、体质量作为协变量,建立多元线性回归模型,儿童PDA管径与mPAP呈正相关关系(P<0.001)。见表4。
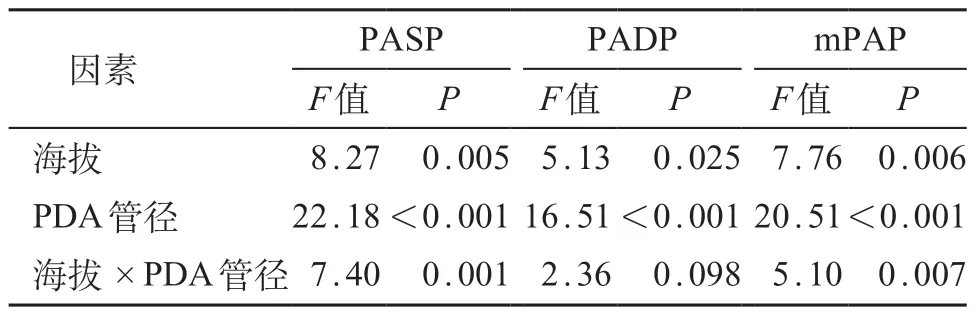
表3 PDA管径、生活地区海拔对于肺动脉压力影响两因素方差分析

表4 PDA管径、生活地区海拔与mPAP多元线性回归分析
3 讨论
右心导管检查被公认为肺动脉血流动力学评估、肺动脉高压诊断的金标准,但由于其为有创检查,往往只能运用于先天性心脏病儿童,如果没有明确指征,不能应用于健康儿童。美国心脏学会及欧洲心脏学会目前将儿童肺动脉高压定义为静息状态下,通过右心导管检查技术评估的平均肺动脉压大于25 mmHg[4-6]。欧洲小儿肺血管疾病网络在2019年更新发布的共识声明指出,轻度的肺动脉压升高(20~25 mmHg)仍有可能与儿童心血管不良事件相关[7]。本研究中,居住地海拔在<1 500m和≥1 500 m儿童的mPAP(mmHg)分别为(24.0±5.8)和(25.1±8.4),接近或高于25 mmHg,提示长期居住于云南省高原环境中的PDA 儿童mPAP 处于较高压力水平。目前,国内报道儿童PAP 评估数据的研究非常有限。2014 年青海省妇女儿童医院运用超声心动图对220名生活于海平面的0~14 岁儿童PAP 进行估测,显示不同年龄段儿童PAP 最低为(14.5 ± 8.6)mmHg,最高(17.7 ± 6.9)mmHg[8]。相关研究对7 例南京地区(平均海拔20~30 m)“沉默型”PDA 患者进行心导管检查肺动脉压力,其mPAP 12~20 mmHg,平均(16.0±2.4)mmHg[9],与上述研究相对比,云南省高原地区儿童mPAP明显高于我国海平面地区儿童。
本研究发现,PDA儿童的mPAP随居住地海拔升高而升高。高原环境具有低气压、低氧含量的大气特点,暴露于高原环境中的儿童可出现肺泡的气氧分压和动脉血氧分压降低,肺泡的气氧分压降低使得肺循环内终末细小动脉及静脉收缩;动脉血氧分压的降低使得肺动脉收缩,导致肺循环压力逐渐升高,进入肺循环的血液减少,缺氧加重,肺循环再次升高,在新生儿期可延迟未闭动脉导管内主肺动脉间压力达到平衡的时间。因此,暴露于云南省高原低气压、低氧含量的大气环境可能是导致该地区儿童PDA 发生以及儿童期mPAP保持在较高水平重要因素之一[10]。如无吸氧禁忌症,出生后给予吸氧治疗,纠正新生儿出生后低氧血症,可否降低儿童PDA 尤其“沉默型”PDA 患病率,值得今后深入研究。
目前,关于“沉默型”PDA并没有精确的定义,仅定义为管径非常小临床无症状的PDA 或可能有特征性PDA 相关杂音但与血流动力学无影响的PDA[9],是否需要接受治疗主要取决于其有无血流动力学特征及其是否增加感染性动脉内膜炎风险。我国PDA介入治疗指南中将有连续性杂音的小直径PDA 列为Ⅱa 级适应症,无杂音的小直径PDA 列为Ⅱb 类适应症[11],并未明确指定手术治疗的PDA 管径值。本研究中,云南省PDA>2 mm 儿童的mPAP 水平高于25 mmHg;且随着居住地海拔升高,PDA 导致肺动脉高压的进展加快,病理性血流动力学的影响增大。因此,云南省PDA>2 mm 尤其居住于高海拔地区儿童,可能从封堵治疗中获得更多的健康收益。2005 年1月至2009年12月,美国波士顿儿童医院共收集168例进行封堵治疗的“沉默型”PDA 儿童及145 例未进行封堵治疗“沉默型”PDA 儿童的资料,并未见明显血流动力学差异,至目前尚未有发生感染性动脉内膜炎报道[12],但其追踪随访时间尚短。本研究中PDA ≤2 mm 儿童在<1500 m、≥1500 m 的mPAP(mmHg)分别为(21.4±4.6)和(22.6±5.4),考虑暴露于高原环境导致其mPAP水平较海平面水平的人群高,但尚无证据支持其对血流动力学的影响,是否需行手术治疗仍需进一步论证。

