AlH3/Fe2O3复合材料的制备及热性能分析
李 瑞,王佳帅,陈 安,龙义强,伍 波,裴重华
(1.西南科技大学 环境友好能源材料国家重点实验室,四川 绵阳 621010;2.四川临港五洲工程设计有限公司,四川 泸州 646003)
引 言
铝热剂是一种由金属和金属氧化物组成的复合含能材料,因其具有高放热特性被广泛应用于军事以及民用领域中[1-4]。通常,铝热剂体系中的铝作为燃料,金属氧化物如Fe2O3、CuO、Bi2O3、Mn2O3和Co3O4等[5-9]作为氧化剂,发生氧化还原反应而释放出大量的热,其中Al/Fe2O3是经典的铝热剂体系。王毅等[10]利用溶胶-凝胶法制备出具有优越点火和能量特性的Al/Fe2O3,其能量性能明显优于传统铝热剂,为提高铝热剂能量性能提供了一个很好的思路。张松林等[11]对微米Al/Fe2O3体系的点火温度与铝热剂组分的尺寸关系进行了深入研究,为相关方面的研究提供了理论基础。然而,传统微米级Al/Fe2O3铝热剂反应活性差、初始反应温度高。为提升反应物之间的接触、减小传质和热传导的距离而提升反应速率,国内外研究人员主要通过制备纳米级的铝热剂提升复合含能材料的反应性。美国利弗莫尔实验室[12]采用溶胶-凝胶法首次成功制备了Al/Fe2O3纳米铝热剂,该体系性能优良,已经被试用于点火器和传爆药,在铝热剂发展上取得了重大进展。然而,纳米铝热剂也存在活性铝含量低、纳米粒子易团聚等现象。
氢化铝是具有高反应活性的金属氢化物,具有低分解温度、快速释氢及高能量密度等优点[13-14],已经在推进剂燃料、高爆炸药以及储氢材料等方向展现出较大的发展潜力。AlH3中具有高还原性的氢和低价态铝特性,在燃烧的过程中可以释放出大量能量。在燃烧含有AlH3的固体推进剂时,AlH3受热分解所产生的氢气能帮助氧化剂迅速燃烧,在生成Al2O3和H2O的同时,可以释放出更多能量[15]。理论上,氢化铝相较于纳米铝粉具有较高的还原性,与金属氧化物反应时,其反应活性能够得到明显提升。此外,氢化铝受热分解得到的氢气还可以提高体系的产气量,从而提高复合材料体系的热性能。
本研究以氢化铝/纳米氧化体系为对象,制备了不同化学计量比的AlH3/Fe2O3复合材料,采用X射线衍射(XRD)、扫描电子显微镜(SEM)、能谱仪(EDS)等对材料的结构形貌进行了表征,并利用热重分析法(TG)和差示扫描量热法(DSC)研究了所制样品的热性能。氢化铝具有高反应活性,在受热分解后生成氢气和活性铝,将氢化铝应用于铝热剂体系中,以期得到高反应活性的铝热剂体系。
1 实 验
1.1 试剂与仪器
四氢铝锂、氯化铝、微米铝粉(d=25μm),均为分析纯,阿拉丁试剂有限公司;四氢呋喃(THF)、甲苯、正己烷、联苯,均为分析纯,成都科隆化学品有限公司;纳米氧化铁(d=30nm),阿拉丁试剂有限公司;以上试剂在使用前均进行无水处理。
BSA124S电子天平,赛多利斯科学仪器(北京)有限公司;超级净化手套箱,米开罗那(中国)有限公司;X′pert Pro X射线衍射仪,荷兰帕纳科公司;Jupiter STA449C同步热分析仪,德国耐驰公司;Max 65能谱仪,英国牛津仪器公司;Apreo 2C扫描电子显微镜,赛默飞世尔科技有限公司。
1.2 AlH3/Fe2O3复合材料的制备
1.2.1 AlH3的制备
将2.28g LiAlH4加入到100mL 无水THF中搅拌0.5h,同时将2g AlCl3加入到50mL无水THF中搅拌0.5h,然后将AlCl3的THF溶液缓慢滴加至LiAlH4的THF溶液中,滴加完毕后继续搅拌反应2h,以上步骤均在-10℃下完成。反应结束后,抽滤得到澄清滤液,在69℃下向滤液中滴加无水正己烷至滤液浑浊,搅拌2h,抽滤得到白色粉末。
1.2.2 AlH3/Fe2O3的制备
将一定量的Fe2O3加入到100mL、100℃的联苯溶液中搅拌0.5h,然后将相应化学计量比的AlH3加入到联苯溶液中搅拌混合2h,Fe2O3和AlH3总质量为0.1g。混合结束后,待溶液冷却,加入100mL甲苯搅拌0.5h,过滤得到红白色粉末。AlH3和Fe2O3的量由铝/铁化学计量比(φ)来确定,φ分别取0.6、1.0和2.0。
1.2.3 Al/Fe2O3的制备
将一定量的Fe2O3加入到100mL、100℃的联苯溶液中搅拌0.5h,然后将相应化学计量比的Al加入到联苯溶液中搅拌混合2h,Fe2O3和Al的总质量为0.1g,混合结束后,待溶液冷却后加入100mL无水甲苯搅拌0.5h,过滤得到红色粉末。Fe2O3和Al的量由化学计量比(φ)来确定,φ分别取0.6、1.0和2.0。
1.3 性能测试
采用X射线衍射(XRD)对AlH3、AlH3/Fe2O3和Al/Fe2O3样品的晶型进行了表征,测试条件为:Cu-Kα(λ=1.540598 Å)辐射源,测试电压和电流分别为40kV和40mA,扫描角度范围3°~80°,扫描速率10°/min。
采用同步分析仪对AlH3、AlH3/Fe2O3和Al/Fe2O3样品的热性能进行了测试,测试条件为:升温速率10K/min,温度范围30~1200℃,Ar气氛,流速50mL/min,样品质量0.2mg。
采用SEM对AlH3、AlH3/Fe2O3和Al/Fe2O3样品的微观形貌进行了表征,测试条件为:光管电压10kV,电流5mA,入射狭缝2mm,步长0.03°。
采用X射线能谱仪(EDS)对样品表面元素分布进行测定,测试条件为:检测范围Be4-U92,工作距离5~7mm。
2 结果与讨论
2.1 物相表征结果分析
制备的AlH3样品以及在氮气气氛300℃下高温处理2min后AlH3样品的XRD谱图如图1所示。
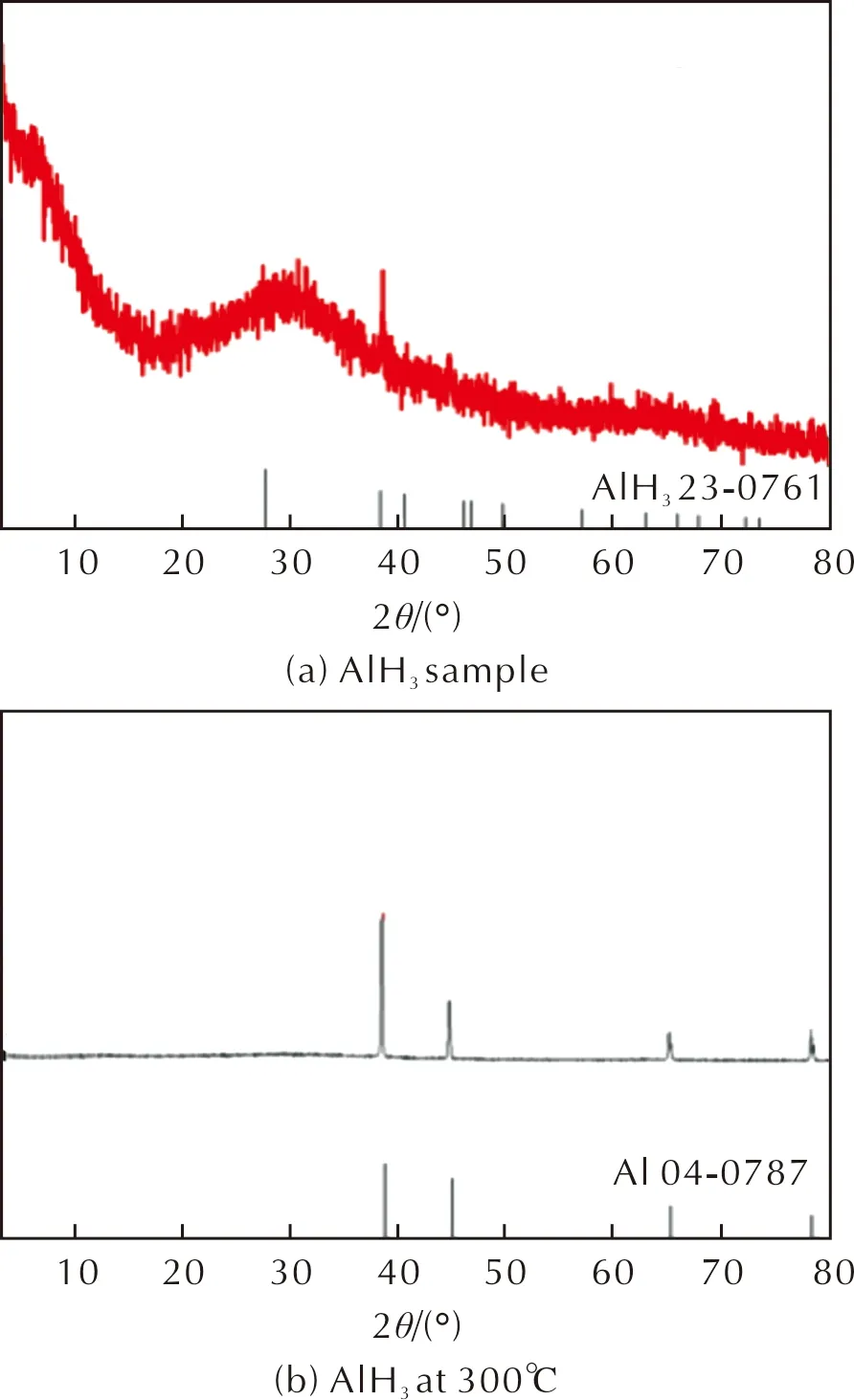
图1 AlH3样品及高温处理后的AlH3样品的XRD谱图Fig.1 XRD patterns of AlH3 sample and AlH3 after high temperature treatment
从图1(a)可以看出,在38°出现了微弱的α-AlH3的衍射峰,其余位置均未出现明显的衍射峰;从图1(b)可以看出,AlH3经高温处理后分解为单质Al,表明所制得的AlH3样品中小部分为α-AlH3,大部分为无定形AlH3。
φ分别为0.6、1.0和2.0的AlH3/Fe2O3复合材料的XRD谱图如图2所示。
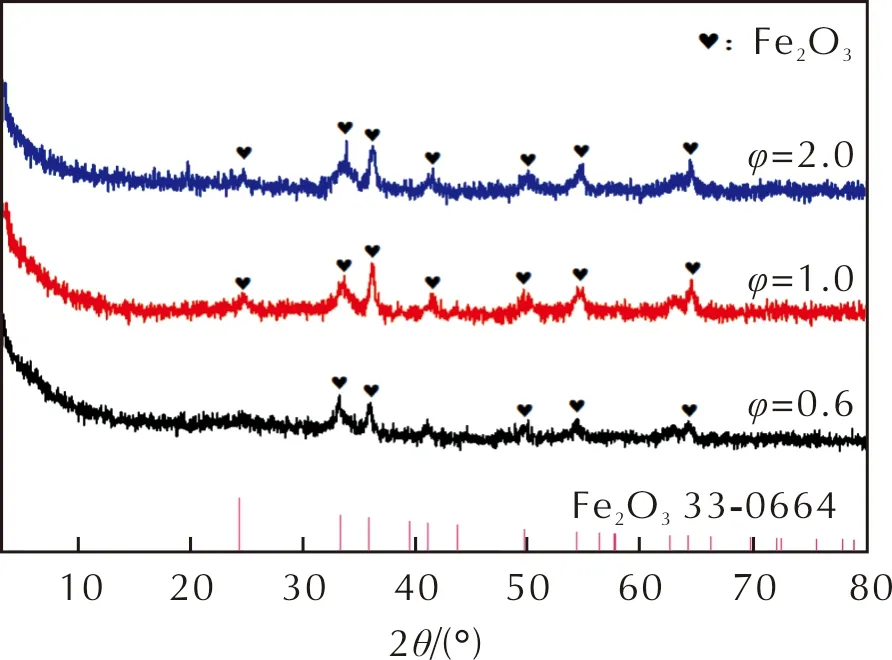
图2 不同化学计量比时AlH3/Fe2O3的XRD谱图Fig.2 XRD patterns of AlH3/Fe2O3 with different stoichiometric ratios
由图2可以看出,3个φ值的样品XRD谱图中均只有Fe2O3的衍射信号,没有晶态AlH3的衍射信号出现,说明样品中只有少量的α-AlH3,而大部分为无定形AlH3。
φ分别为0.6、1.0、2.0时Al/Fe2O3的XRD谱图如图3所示。由图3可以看出,3个样品的XRD谱图中的衍射信号均为Al和Fe2O3。
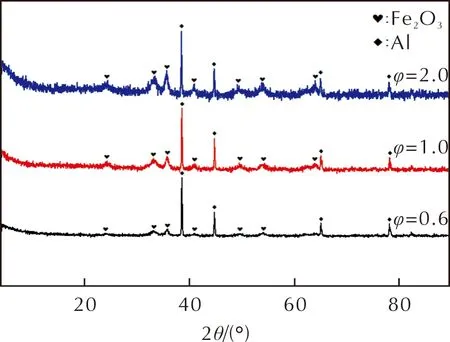
图3 不同化学计量比时Al/Fe2O3的XRD谱图Fig.3 XRD patterns of Al/Fe2O3 with different stoichiometric ratios
2.2 形貌分析
Fe2O3和AlH3的SEM照片如图4所示。由图4可以看出,Fe2O3为30nm左右的梭形颗粒;少量的α-AlH3为方块形颗粒,粒径约为10μm。

图4 Fe2O3和AlH3的SEM照片Fig.4 SEM images of Fe2O3 and AlH3
φ分别为0.6、1.0、2.0的AlH3/Fe2O3的SEM照片如图5所示。
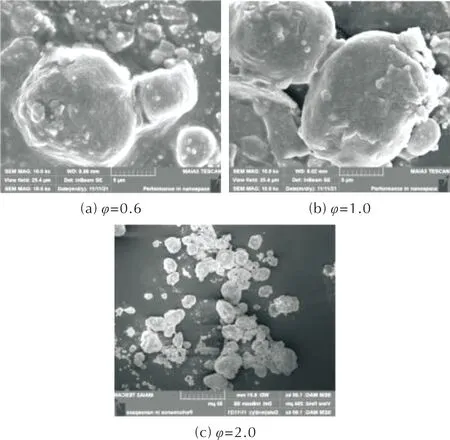
图5 不同化学计量比时AlH3/Fe2O3的SEM照片Fig.5 SEM images of Fe2O3/AlH3 with different stoichiometric ratios
由图5可知,AlH3/Fe2O3呈现颗粒状,随着AlH3含量的提升,颗粒粒径降低,这可能是由于Fe2O3含量降低所致。
φ分别为0.6、1.0、2.0时AlH3/Fe2O3复合材料的EDS图如图6所示。由图6可以看出,φ为0.6、1.0、2.0的AlH3/Fe2O3复合材料表面都存在Al、Fe、O 3种元素,结合AlH3/Fe2O3的EDS图,可以看出,复合材料中Al、Fe、O元素分布较为均匀,且3种元素分布区域大致相同,说明AlH3和纳米Fe2O3复合较好。

图6 不同化学计量比时AlH3/Fe2O3的EDS图Fig.6 EDS images of Fe2O3/AlH3 with different stoichiometric ratios
2.3 热性能分析
AlH3的DSC-TG曲线如图7所示。
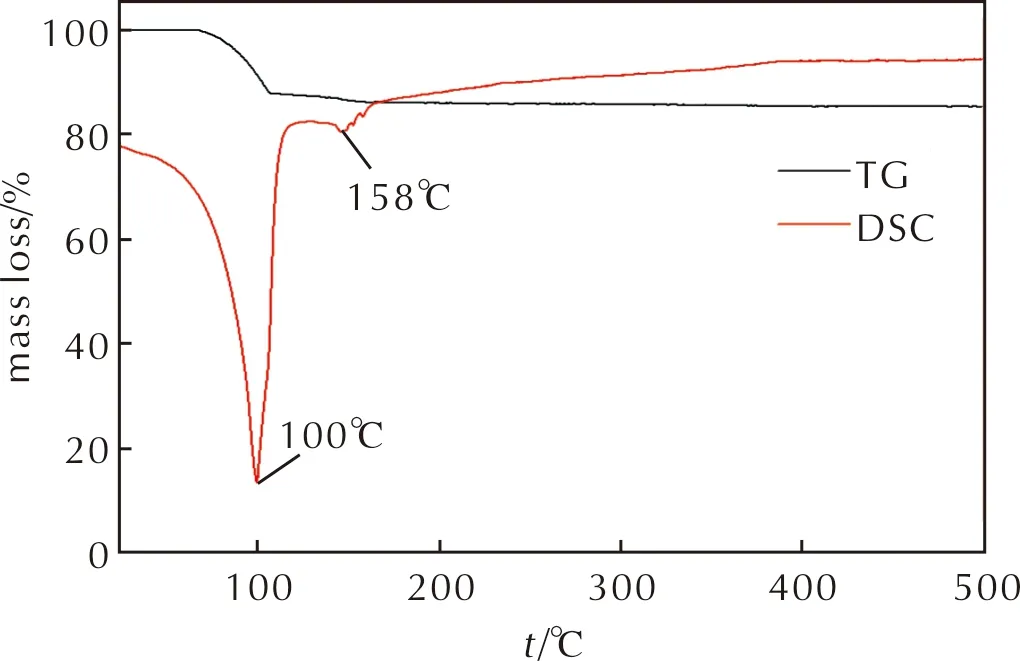
图7 AlH3的TG-DSC曲线Fig.7 TG-DSC curves of AlH3
由图7可以看出,样品失重15%,并在100℃和158℃出现了两个吸热峰,其中158℃的吸热峰信号较弱,晶态AlH3的分解峰温均在150℃以上[16-17]。结合XRD谱图分析,表明样品中仅有小部分α-AlH3,大部分为无定形 AlH3。
AlH3/Fe2O3复合材料与微米Al/Fe2O3的热性能参数见表1,DSC曲线如图8所示。
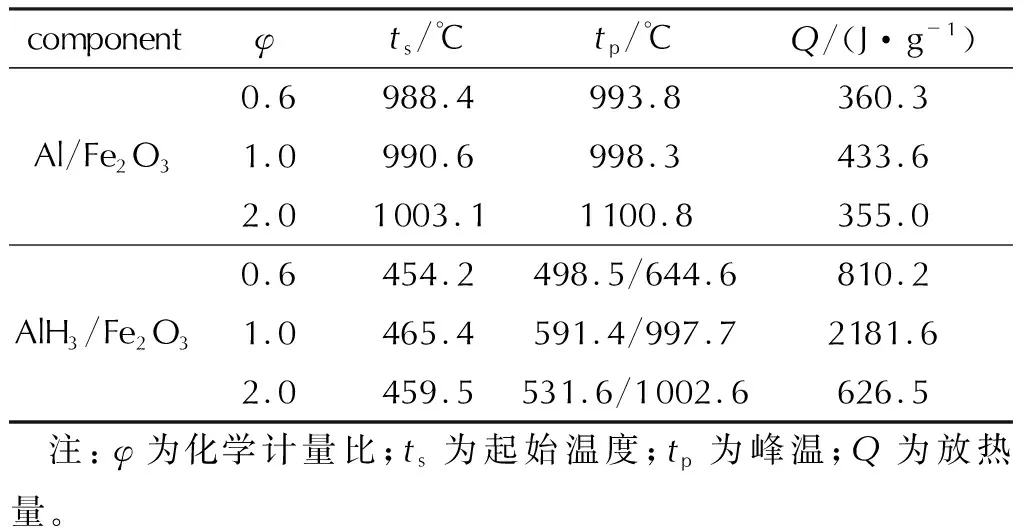
表1 复合材料的热性能参数Table 1 Thermal properties parameters of composite materials
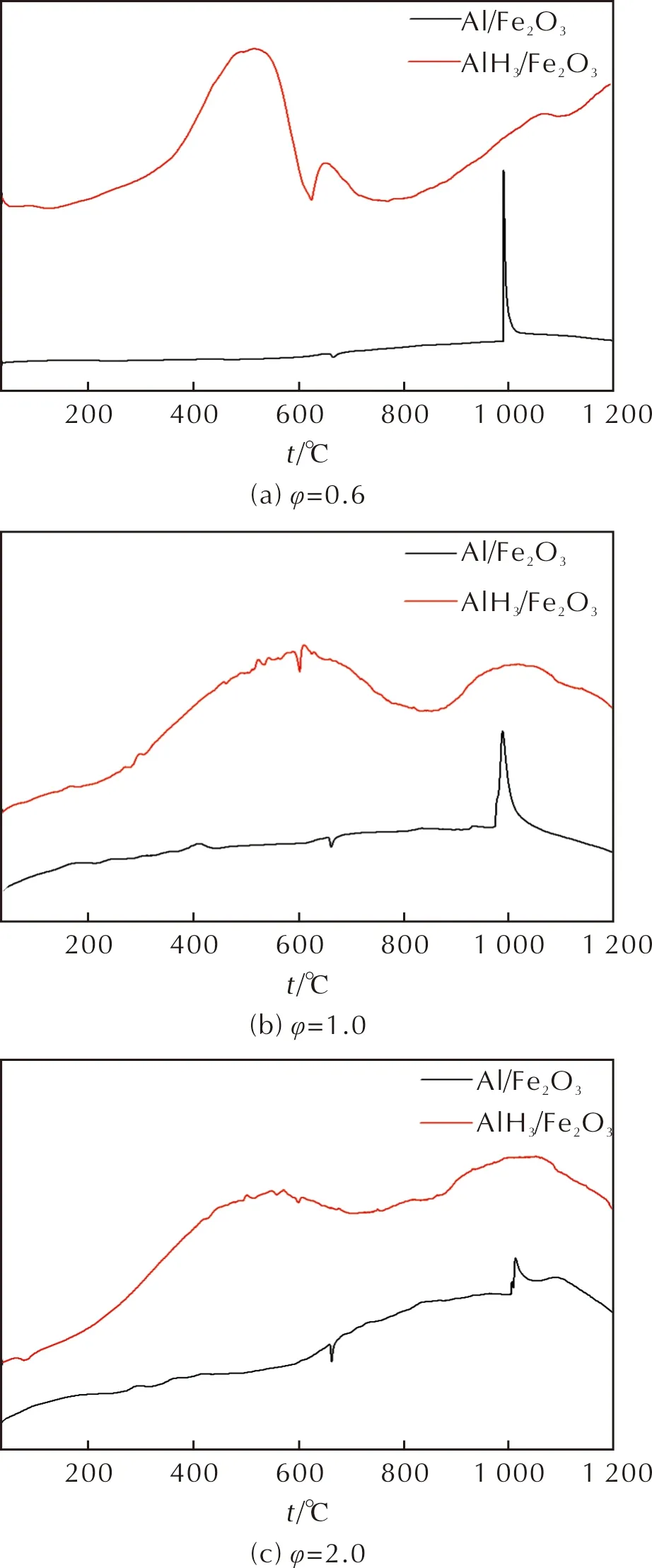
图8 AlH3/Fe2O3复合材料与微米Al/Fe2O3的DSC曲线Fig.8 DSC curves of AlH3/Fe2O3 composite material and micron Al/Fe2O3 with different stoichiometric ratios
结合图8和表1可以看出,φ为0.6的样品放热峰温为498.5℃和644.6℃,φ为1.0的样品放热峰温为591.4℃和997.7℃,φ为2.0的样品放热峰温为531.6℃和1002.6℃,放热从454.2、465.4、459.5℃开始,与微米Al/Fe2O3体系相比,铝热反应温度以及起始放热温度均有大幅降低。分析原因为,在AlH3/Fe2O3体系中,温度升高到450℃附近时,AlH3作为金属燃料,其结构中含有高活性、高还原性的A—H键,在诱发铝热剂的升温过程中,能够释放活性H,催化其与氧化剂(Fe2O3)的氧化还原反应。除此之外AlH3分解产生铝的粒径可能为纳米级,也会使铝热反应温度降低。φ为0.6时,放热量较低,可能因为样品中的AlH3含量少,分解得到的Al也少,致使反应程度较少,体系放热量低。将φ提高到1.0时,可以看到放热量有大幅度提升,因为AlH3含量增大,分解得到的Al增多,故反应程度增大,放热量随之升高;在φ值为2.0时,由于Fe2O3的量不足以使AlH3分解得到的铝完全反应,致使反应程度降低,故放热量比φ为1.0时低。
3 结 论
(1)以无定形AlH3和纳米Fe2O3制备了AlH3/Fe2O3复合材料。所制备的复合材料在一定Al/Fe化学计量比下粒径小于10μm,经EDS表征,AlH3与纳米Fe2O3复合较好,分布较为均匀。
(2)AlH3/Fe2O3复合材料Al/Fe化学计量比φ分别为0.6、1.0和2.0时,起始放热温度均在450℃附近,相比于微米Al/Fe2O3,均提前了500℃,这说明AlH3作为金属燃料,其结构中含有高活性、高还原性的Al—H键,能够释放活性H,催化其与Fe2O3的氧化还原反应,使铝热反应温度大幅度降低。
(3)复合材料中Al/Fe化学计量比φ为1.0时,复合材料具有较高放热量(2181.6J/g),表明AlH3与Fe2O3在此化学计量比下反应较为完全。

