文昌鱼左右体轴建立机制的研究进展
胡广伟,张珍珍,高焕
综 述
文昌鱼左右体轴建立机制的研究进展
胡广伟1,2,张珍珍1,2,高焕1,2
1. 江苏海洋大学,江苏省海洋生物资源与环境重点实验室/江苏省海洋生物技术重点实验室,连云港 222005 2. 江苏海洋大学,江苏省海洋生物产业技术协同创新中心,连云港 222005
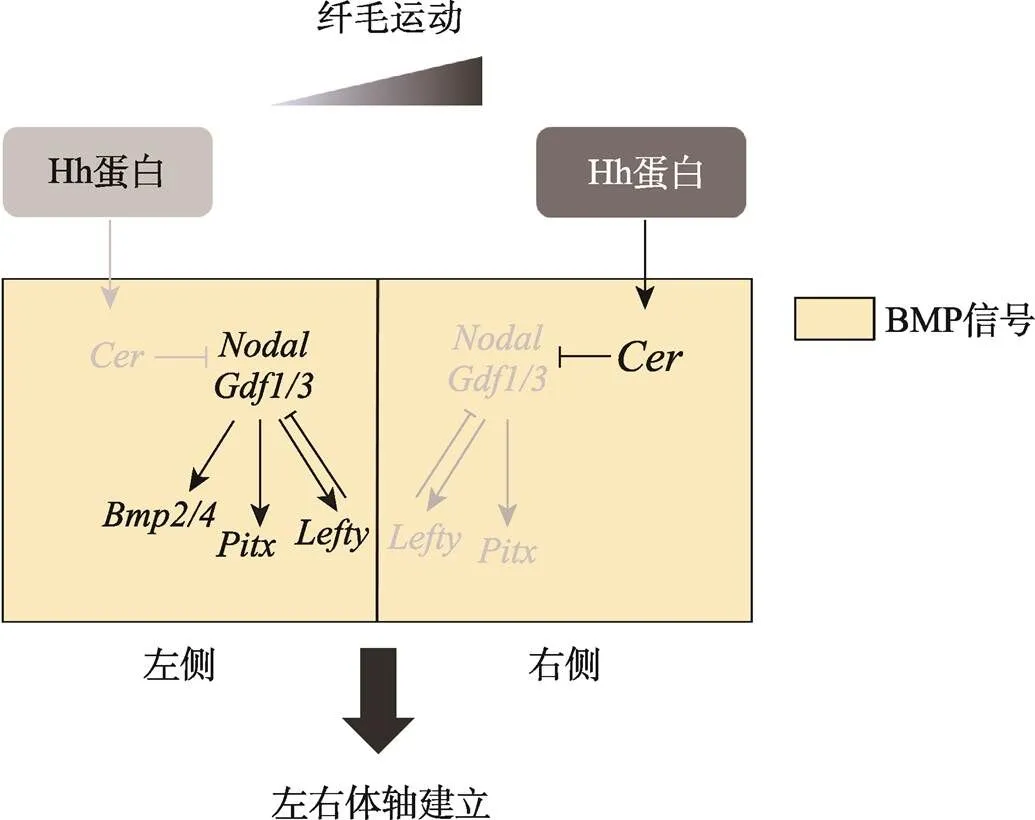
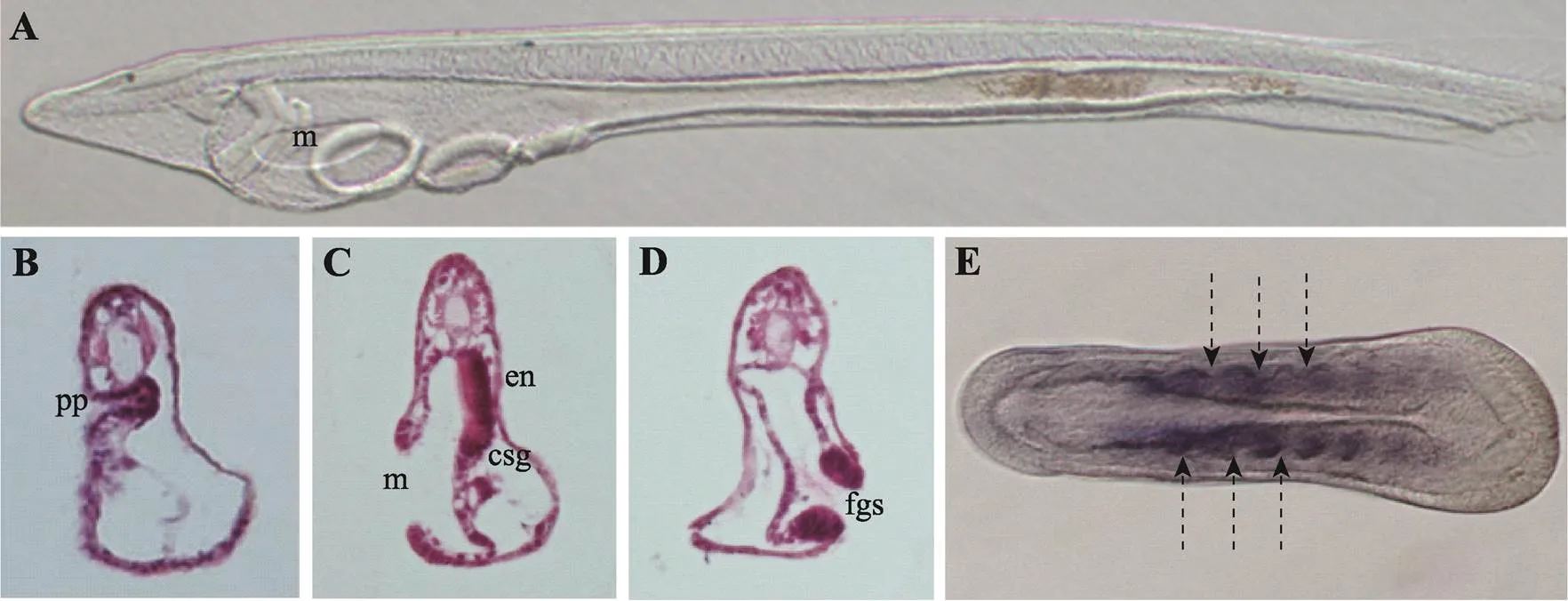
两侧对称动物左右体轴建立机制研究是发育生物学领域重要的基础科学问题之一。文昌鱼(amphioxus)由于其特殊的进化地位以及与脊椎动物相似的胚胎发育模式和身体构筑方式,是研究动物左右体轴建立机制的理想模式物种。近年来随着文昌鱼室内全人工繁育技术、高效显微注射技术和基因敲除技术的建立,国内外学者在左右体轴建立机制研究上取得了丰硕的成果。本文从文昌鱼胚胎左右不对称发育特点出发,总结了近期文昌鱼左右体轴建立方面取得的研究进展,并提出了文昌鱼左右体轴调控网络图:纤毛运动导致Hh蛋白在文昌鱼中不对称分布(L 文昌鱼;左右体轴;胚胎发育 两侧对称动物(Bilateria)体轴的正确建立是胚胎发育过程中的重要事件,是器官发生与形态建成的重要基础[1]。体轴的建立主要包括前后轴(anterior- posterior axis)、背腹轴(dorsal-ventral axis)和左右轴(left-right axis)。左右体轴的建立一般始于胚胎发育早期,其过程主要包括胚胎原始对称的打破、左右体轴建立相关基因的不对称激活和不对称器官的形态建成[2]。在成体中,两侧对称动物外部形态呈两侧对称,但这种对称是相对的,其内部器官的排布往往呈左右不对称排列,从软体动物贝壳的旋转方向到脊椎动物内脏器官的排布都有这种现象。内脏器官的不对称分布不仅能有效地利用躯体空间,而且对于各个器官功能的正常行使也至关重要[3]。 文昌鱼(amphioxus)隶属脊索动物门(Chordata)、头索动物亚门(Cephalochordata),是无脊椎动物向脊椎动物过渡的中间类群,同时也是脊索动物中现存最原始的类群[4]。由于文昌鱼身体构筑方式、基因组成以及胚胎发育模式均与脊椎动物相似,是进化发育与比较基因组学研究的理想模式物种[5,6]。此外,文昌鱼在胚胎学研究上也具有其独特优势。首先,文昌鱼个体小,躯体结构相对简单,繁殖能力强,卵子体外受精、体外发育,胚胎和成体透明,从受精卵的第一次卵裂到神经胚的发育过程都十分清晰[7],非常利于胚胎发育早期的观察和研究;其次,佛罗里达文昌鱼()和白氏文昌鱼()全基因组测序工作已经完成[8,9],相比脊椎动物,文昌鱼的基因组没有经历两轮复制,因此与脊椎动物同源基因家族中的多数成员都是以单拷贝的形式存在,为通过基因编辑方法研究基因功能提供了极大的便利;最后,针对文昌鱼研究的相关技术手段也日趋成熟,目前已经实现了文昌鱼室内全人工繁育技术[10,11]、建立了高效的显微注射技术[12]、实现了TALEN介导的基因敲除技术[13]、建立了文昌鱼转基因技术[14]等。得益于上述技术手段的突破,近年来人们在文昌鱼左右体轴建立方面的研究也取得了很多新成果。本文从文昌鱼胚胎左右不对称发育特点出发,综述了近期文昌鱼左右体轴建立取得的研究进展。 文昌鱼形态学上的左右不对称相比于其他脊索动物较为特殊,在文昌鱼胚胎发育至神经胚中期,体节(somite)首先呈现出左右不对称排布(图1E),其中左侧体节相比右侧体节位置更靠前[15],而且这种不对称会一直持续到成体阶段,最终导致肌节和外周神经元也呈现与体节一致的左右不对称排列特征[16]。文昌鱼在整个胚胎发育过程中的左右不对称在幼体阶段最为明显,尤其以咽区器官(pharyngeal organs)最为显著(图1)。在器官发生时,咽区左右两侧细胞会经历完全不同的命运走向,其中胚胎左侧细胞会分化形成口和前窝(preoral pit),口前窝与脊椎动物垂体前叶(anterior pituitary)同源,由左侧体腔囊(coelomic pouch)发育而来,最终与口前端表皮融合[17]。胚胎右侧咽壁会分化形成内柱(endostyle)和棒状腺(club-shaped gland),内柱与脊椎动物甲状腺同源,位置与口相对。棒状腺是一个管状结构横跨着整个咽区,右侧部分与咽壁相连是具有分泌功能的腺体部,位于内柱的后方;左侧部分是没有分泌功能的管状结构开口于体外,位于口的下方,棒状腺的具体功能以及其在脊椎动物中的同源器官目前尚不清楚[18]。随着发育的进行,咽区器官的不对称程度会随着第一鳃裂的形成而进一步加剧。比较分析发现,不同种类的文昌鱼在胚胎发育过程中虽然会有细微的差异,但是幼体时期的左右不对称特征是这类生物的普遍共性[19]。 图1 文昌鱼左右不对称器官的分布情况 A:文昌鱼三鳃裂时期幼体的侧面观;B~D:文昌鱼咽区器官纵切片结果;E:文昌鱼神经胚期体节的排布情况。pp:口前窝;en:内柱;csg:棒状腺;m:口;fgs:第一鳃裂;箭头表示体节间隔。 Nodal是TGF-β超家族成员之一,在绝大多数后口动物中均有发现[20]。研究表明,Nodal信号通路通过调控下游基因的不对称表达参与左右体轴建立,在左右体轴建立调控网络中处于核心位置[21]。在小鼠()中,基因在节点(node)两侧最初呈对称表达,随后由于Nodal抑制因子Cer在右侧开始表达,使得Nodal的表达主要集中在节点左侧。随着发育的进行,节点处Nodal活性被传递到侧板中胚层[22~24],并在侧板中胚层诱导其自身以及和基因的表达,由于Lefty扩散速度较快,且对Nodal具有抑制作用,从而将Nodal的活性限制在左侧。通过这种自诱导反馈方式(self- enhancement and lateral inhibition, SELL),、和在侧板中胚层中的表达得到进一步强化,最终转录因子Pitx通过激活下游基因的表达参与细胞增殖、分化和不对称器官的发育[25]。 在文昌鱼胚胎中,Nodal信号通路的成员在胚胎孵化早期至神经胚中期呈明显的不对称表达,具体体现为、、和主要在左侧表达(L>R),Nodal的抑制因子Cer主要在右侧表达(L BMP (bone morphogenetic protein)是一类多功能的分泌蛋白,同属于TGF-β超家族,在胚胎发育和器官形态发生中发挥重要功能[32]。已有研究表明,BMP信号通路可与Nodal信号通路相互作用参与动物左右体轴的建立,如在小鼠中BMP信号活性受Nodal信号调控[33],与此同时,BMP信号也可通过调控Nodal信号参与左右体轴建立,敲除导致小鼠节点及侧板中胚层中Nodal表达下降,进而影响左右体轴的正常建立[34]。同样在鸡()和海胆()中,Nodal信号通路成员的不对称表达也依赖于BMP信号活性[35~38]。最新研究显示,在文昌鱼中BMP信号通路通过调控Nodal信号通路参与左右不对称发育,在原肠胚晚期到神经胚期抑制BMP信号活性会使、、和在左侧的表达消失,和呈现异位表达。表型分析发现,抑制BMP信号活性导致文昌鱼左右体轴建立异常,原来位于左侧的口和口前窝消失,取而代之的是原本仅出现在右侧的内柱和棒状腺,胚胎左右两侧均为右侧结构(right isomerism)[39],相关特征与抑制Nodal信号通路产生的结果相一致,说明BMP信号通路与Nodal信号通路在文昌鱼左右体轴调控上具有一致性,同时也表明BMP信号通路在左右体轴建立方面功能的保守性。 ()基因最早是由Nusslein-Volhard等[40]在果蝇()发育相关基因突变体筛选过程中发现的,由于该基因突变导致果蝇身体节段(segment)后部消失,使整个胚胎看起来像一个“刺猬”,因此将这一基因命名为。1993年Forbe等[41]首先提出Hh信号通路概念。随后Hh信号通路核心成员在果蝇中相继被发现,后来又在多种脊椎动物中发现了Hh信号通路的同源基因,证实Hh信号通路在动物中普遍存在,广泛参与细胞增殖、分化及多种组织器官的发生[42]。 英国雷丁大学Shimeld[43]最初将Hh信号通路与文昌鱼左右体轴形成建立联系,通过表达谱分析发现,基因在文昌鱼神经胚中期(5体节)开始出现不对称表达,这与文昌鱼胚胎开始出现不对称表型的时期一致,考虑到Hh信号通路在鸡胚左右体轴建立中的功能[44],Shimeld推测文昌鱼中的不对称表达极有可能与左右体轴建立相关。但是这一观点并未得到大多数学者的认可,主要原因是在文昌鱼中不对称表达出现的时间是在神经胚中期,远远晚于左右体轴调控基因开始不对称表达的时期[28]。直到2014年,随着基因敲除技术的兴起,研究人员利用TALEN技术构建了基因敲除突变体文昌鱼,发现突变体文昌鱼左右不对称器官发育异常,证明Hh信号通路在文昌鱼左右不对称发育过程中发挥重要功能[45]。在这一结果的基础上,Hu等[46]通过组织切片、扫描电镜系统地分析了基因敲除后的表型,发现基因敲除后文昌鱼咽区器官及体节的不对称性均受到影响,主要表现在右侧器官消失,左右两侧均为左侧特征,整个胚胎呈现左右对称的表型;此外原位杂交结果也显示,在突变体中表达消失,及其下游调控基因和表达由左侧表达变为左右对称表达,这些结果证明了Hh信号通路在文昌鱼中通过调控参与左右不对称建立。最新研究结果显示,Hh信号活性在文昌鱼中存在左右差异(L 在大多数脊椎动物中,胚胎原始对称的打破与原肠背部一群短暂存在的特殊细胞团密切相关,这群细胞称为左右组织者(LR organizer, LRO),如小鼠中的节点(node)[48]、非洲爪蟾()中的原肠顶板(gastrocoel roof plate, GRP)[49]和斑马鱼()中的库氏囊泡(Kupffer’s Vesicle, KV)[50]。尽管左右组织者结构在不同物种中形态结构差异较大但都具有如下特点:都存在动纤毛,能够以固定的方式运动产生单向的液流[51,52],液流导致LRO两侧产生差异,并诱导相关基因的左右不对称表达,最终打破左右对称[1]。 文昌鱼胚胎发育模式及身体构筑方式与脊椎动物高度相似,因此有学者认为文昌鱼中也应存在类似于脊椎动物的LRO结构[3,53],并对文昌鱼中左右组织者存在的部位和特点进行了推测:首先,位置上应该位于原肠腔的背壁,可在脊索形成时整合到脊索中;其次,应该存在极性细胞,具有动纤毛能够定向摆动产生单向的液流,并且能够激活相关信号通路;最后,LRO结构出现的时期应该与不对称基因开始表达的时间相一致。根据这一推测,研究人员一直在试图寻找文昌鱼的“LRO”。但事实上,文昌鱼胚胎在原肠胚时期绝大多数细胞都具有纤毛[54],而且在文昌鱼原肠胚期也没有检测到动纤毛标记基因的表达[55],敲除纤毛形成相关基因也不影响文昌鱼左右体轴的正常建立[47]。由此看来,有必要对文昌鱼中是否存在LRO结构这一问题进行重新讨论。需要指出的是,最新的研究结果发现纤毛运动对文昌鱼左右对称的打破至关重要,纤毛运动会导致Hh信号的不对称激活,进而通过调控的表达调控文昌鱼左右不对称发育,用甲基纤维素抑制纤毛运动会导致Hh蛋白分布异常、表达随机化,最终导致左右体轴建立异常[47]。但是由于甲基纤维素只起到抑制纤毛运动的作用,不能确定动纤毛的着生位置,因此依然不确定在文昌鱼中是否有LRO这一结构。 文昌鱼是人们对头索动物亚门动物的统称,与尾索动物亚门和脊椎动物亚门共同组成脊索动物门,是脊索动物中最早分化出来的一支。与以海鞘为代表的尾索动物不同,文昌鱼与脊椎动物具有更多相似的特征,是了解脊椎动物祖先的现生动物代表;此外,文昌鱼是与步带动物(mbulacrarians)亲缘关系最近的脊索动物,因此揭示文昌鱼左右体轴建立机制并将其与步带动物体轴建立机制进行比较对于全面理解两侧对称动物左右体轴建立机制以及背腹轴转换(dorso-ventral inversion)都具有十分重要的意义。 在现存脊索动物中,文昌鱼幼体时期形态学上的左右不对称发育最为特殊,是研究左右体轴建立的绝佳材料。长期以来由于技术手段的限制,使得文昌鱼的研究相比其他模式物种较为滞后,近年来随着相关研究技术手段的建立,尤其是胚胎显微注射技术以及基因敲除技术的应用,以文昌鱼为实验材料,在左右体轴发育机制方面的研究正在迅速展开。研究人员先后阐释了Nodal信号通路、Cer- Nodal-Pitx-Lefty级联信号通路、Hedgehog信号通路、BMP信号通路在文昌鱼左右体轴建立中的功能,且证实纤毛运动为打破左右对称的原始动力。总结现有的文昌鱼左右体轴调控相关研究,本文将文昌鱼左右体轴建立的调控网络总结如下(图2):在文昌鱼中纤毛运动导致Hh蛋白的不对称分布(L 尽管文昌鱼左右体轴建立机制越来越清晰,但是文昌鱼左右体轴建立和分化是一个复杂的动态过程,需要多条信号通路精确调控,目前仍有很多问题有待阐明,如信号通路如何决定动态表达进而参与左右体轴建立?在脊椎动物中参与左右体轴建立的Delta/Notch、Wnt/β-catenin和Wnt/PCP信号通路在文昌鱼中是否参与左右体轴建立?此外,有研究发现用质子泵(proton pumps)抑制剂处理会导致文昌鱼胚胎左右体轴建立异常[53],说明离子流(ion flux)参与文昌鱼左右体轴建立,但是其具体功能还不清楚。最后,文昌鱼中是否存在LRO结构还有待进行深入研究。对于上述科学问题的回答将有助于人们全面阐释文昌鱼左右体轴建立的机制。 图2 文昌鱼左右体轴建立调控网络图 纤毛运动导致Hh蛋白在文昌鱼中不对称分布(L [1] Nakamura T, Hamada H. Left-right patterning: conserved and divergent mechanisms., 2012, 139(18): 3257–3262. [2] Ramsdell AF, Yost HJ. Molecular mechanisms of vertebrate left-right development., 1998, 14(11): 459–465. [3] Blum M, Feistel K, Thumberger T, Schweickert A. The evolution and conservation of left-right patterning mechanisms., 2014, 141(8): 1603–1613. [4] Wang L, Su HY, Wang CL, Wang YH. The bridge between invertebrate and vertebrate—the cephalochordate amphioxus, 2007, (2): 45–51.王磊, 宿红艳, 王昌留, 王艳华. 从无脊椎动物到脊椎动物的纽带—头索动物文昌鱼. 海洋湖沼通报, 2007, (2): 45–51. [5] Zhang SC, Yuan JD, Li HY. Amphioxus—model animal for insights into the origin and evolution of the vertebrates., 2001, 13(5): 214–218.张士璀, 袁金铎, 李红岩. 2001. 文昌鱼—研究脊椎动物起源和进化的模式动物. 生命科学, 2001, 13(5): 214–218. [6] Holland LZ, Laudet V, Schubert M. The chordate amphioxus: an emerging model organism for developmental biology., 2004, 61(18): 2290–2308. [7] Holland LZ, Onai T. Early development of cephalochordates (amphioxus)., 2012, 1(2): 167–183. [8] Putnam NH, Butts T, Ferrier DEK, Furlong RF, Hellsten U, Kawashima T, Robinson-Rechavi M, Shoguchi E, Terry A, Yu JK, Benito-Gutiérrez EL, Dubchak I, Garcia-Fernàndez J, Gibson-Brown JJ, Grigoriev IV, Horton AC, de Jong PJ, Jurka J, Kapitonov VV, Kohara Y, Kuroki Y, Lindquist E, Lucas S, Osoegawa K, Pennacchio LA, Salamov AA, Satou Y, Sauka-Spengler T, Schmutz J, Shin-I T, Toyoda A, Bronner-Fraser M, Fujiyama A, Holland LZ, Holland PWH, Satoh N, Rokhsar DS. The amphioxus genome and the evolution of the chordate karyotype., 2008, 453(7198): 1064–1071. [9] Huang SF, Tao X, Yuan SC, Zhang YH, Li PY, Beilinson HA, Zhang Y, Yu WJ, Pontarotti P, Escriva H, Le Petillon Y, Liu XL, Chen SW, Schatz DG, Xu AL. Discovery of an active RAG transposon illuminates the origins of V(D)J recombination., 2016, 166(1): 102–114. [10] Li G, Yang X, Shu ZH, Chen XY, Wang YQ. Consecutive spawnings of Chinese amphioxus,, in captivity., 2012, 7(12): e50838. [11] Li G, Shu ZH, Wang YQ. Year-round reproduction and induced spawning of Chinese amphioxus,, in laboratory., 2013, 8(9): e75461. [12] Liu X, Li G, Feng J, Yang X, Wang YQ. An efficient microinjection method for unfertilized eggs of Asian amphioxus., 2013, 223(4): 269–278. [13] Li G, Feng J, Lei Y, Wang J, Wang H, Shang LK, Liu DT, Zhao H, Zhu Y, Wang YQ. Mutagenesis at specific genomic loci of amphioxususing TALEN method., 2014, 41(4): 215–219. [14] Shi CG, Huang J, Chen SX, Li G, Wang YQ. Generation of two transgenic amphioxus lines using the Tol2 transposon system., 2018, 45(9): 513–516. [15] Minguillón C, Garcia-Fernàndez J. The single amphioxus Mox gene: insights into the functional evolution of Mox genes, somites, and the asymmetry of amphioxus somitogenesis., 2002, 246(2): 455–465. [16] Lu TM, Luo YJ, Yu JK. BMP and Delta/Notch signaling control the development of amphioxus epidermal sensory neurons: insights into the evolution of the peripheral sensory system., 2012, 139(11): 2020–2030. [17] Glardon S, Holland LZ, Gehring WJ, Holland ND. Isolation and developmental expression of the amphioxusgene (): insights into eye and photoreceptor evolution., 1998, 125(14): 2701– 2710. [18] Lacalli T. Mucus secretion and transport in amphioxus larvae: organization and ultrastructure of the food trapping system, and implications for head evolution., 2008, 89(3): 219–230. [19] Holland ND, Holland LZ. Laboratory spawning and development of the Bahama lancelet,(Cephalochordata): fertilization through feeding larvae., 2010, 219(2): 132–141. [20] Chea HK, Wright CV, Swalla BJ. Nodal signaling and the evolution of deuterostome gastrulation., 2005, 234(2): 269–278. [21] Duboc V, Lepage T. A conserved role for the nodal signaling pathway in the establishment of dorso-ventral and left-right axes in deuterostomes., 2008, 310(1): 41–53. [22] Brennan J, Norris DP, Robertson EJ. Nodal activity in the node governs left-right asymmetry., 2002, 16(18): 2339–2344. [23] Kawasumi A, Nakamura T, Iwai N, Yashiro K, Saijoh Y, Belo JA, Shiratori H, Hamada H. Left-right asymmetry in the level of active Nodal protein produced in the node is translated into left-right asymmetry in the lateral plate of mouse embryos., 2011, 353(2): 321–330. [24] Saijoh Y, Oki S, Ohishi S, Hamada H. Left-right patterning of the mouse lateral plate requires nodal produced in the node., 2003, 256(1): 160–172. [25] Grimes DT, Burdine RD. Left-right patterning: Breaking symmetry to asymmetric morphogenesis., 2017, 33(9): 616–628. [26] Onai T, Yu JK, Blitz IL, Cho KWY, Holland LZ. Opposing Nodal/Vg1 and BMP signals mediate axial patterning in embryos of the basal chordate amphioxus., 2010, 344(1): 377–389. [27] Yasui K, Zhang S, Uemura M, Saiga H. Left-right asymmetric expression of BbPtx, a Ptx-related gene, in a lancelet species and the developmental left-sidedness in deuterostomes., 2000, 127(1): 187–195. [28] Yu JK, Holland LZ, Holland ND. An amphioxus nodal gene (AmphiNodal) with early symmetrical expression in the organizer and mesoderm and later asymmetrical expression associated with left-right axis formation., 2002, 4(6): 418–425. [29] Le Petillon Y, Oulion S, Escande ML, Escriva H, Bertrand S. Identification and expression analysis of BMP signaling inhibitors genes of the DAN family in amphioxus., 2013, 13(8): 377–383. [30] Soukup V, Yong LW, Lu TM, Huang SW, Kozmik Z, Yu JK. The Nodal signaling pathway controls left-right asymmetric development in amphioxus., 2015, 6: 5. [31] Li G, Liu X, Xing CF, Zhang HY, Shimeld SM, Wang YQ. Cerberus-Nodal-Lefty-Pitx signaling cascade controls leftright asymmetry in amphioxus., 2017, 114(14): 3684–3689. [32] Bragdon B, Moseychuk O, Saldanha S, King D, Julian J, Nohe A. Bone morphogenetic proteins: a critical review., 2011, 23(4): 609–620. [33] Fujiwara T, Dehart DB, Sulik KK, Hogan BLM. Distinct requirements for extra-embryonic and embryonic bone morphogenetic protein 4 in the formation of the node and primitive streak and coordination of left-right asymmetry in the mouse., 2002, 129(20): 4685–4696. [34] Mine N, Anderson RM, Klingensmith J. BMP antagonism is required in both the node and lateral plate mesoderm for mammalian left-right axis establishment., 2008, 135(14): 2425–2434. [35] Piedra ME, Ros MA. BMP signaling positively regulates Nodal expression during left right specification in the chick embryo., 2002, 129(14): 3431–3440. [36] Schlange T, Arnold HH, Brand T. BMP2 is a positive regulator of Nodal signaling during left-right axis formation in the chicken embryo., 2002, 129(14): 3421–3429. [37] Bessodes N, Haillot E, Duboc V, Röttinger E, Lahaye F, Lepage T. Reciprocal signaling between the ectoderm and a mesendodermal left-right organizer directs left-right determination in the sea urchin embryo., 2012, 8(12): e1003121. [38] Luo YJ, Su YH. Opposing nodal and BMP signals regulate left-right asymmetry in the sea urchin larva., 2012, 10(10): e1001402. [39] Soukup V, Kozmik Z. The Bmp signaling pathway regulates development of left-right asymmetry in amphioxus., 2018, 434(1): 164–174. [40] Nüsslein-Volhard C, Wieschaus E. Mutations affecting segment number and polarity in., 1980, 287(5785): 795–801. [41] Forbes AJ, Nakano Y, Taylor AM, Ingham PW. Genetic analysis of hedgehog signalling in theembryo., 1993: 115–124. [42] Qi XL, Wang YJ, Wu G. Progress of study on hedgehog signaling pathway., 2013, 35(8): 1211– 1220.齐晓龙, 王玉炯, 吴更. Hedgehog信号通路研究进展. 中国细胞生物学学报, 2013, 35(8): 1211–1220. [43] Shimeld SM. The evolution of the hedgehog gene family in chordates: insights from amphioxus hedgehog., 1999, 209(1): 40–47. [44] Levin M, Johnson RL, Stern CD, Kuehn M, Tabin C. A molecular pathway determining left-right asymmetry in chick embryogenesis., 1995, 82(5): 803–814. [45] Wang H, Li G, Wang YQ. Generating amphioxusknockout mutants and phenotype analysis.(), 2015, (10): 1036–1043.王慧, 李光, 王义权. 文昌鱼基因敲除和突变体表型分析. 遗传, 2015, (10): 1036–1043. [46] Hu GW, Li G, Wang H, Wang YQ.participates in the establishment of left-right asymmetry during amphioxus development by controllingexpression., 2017, 144(24): 4694–4703. [47] Zhu X, Shi CG, Zhong YH, Liu X, Yan QN, Wu XT, Wang YQ, Li G. Cilia-driven asymmetric Hedgehog signalling determines the amphioxus left-right axis by controllingexpression., 2020, 147(1): dev182469. [48] Lee JD, Anderson KV. Morphogenesis of the node and notochord: the cellular basis for the establishment and maintenance of left-right asymmetry in the mouse., 2008, 237(12): 3464–3476. [49] Schweickert A, Weber T, Beyer T, Vick P, Bogusch S, Feistel K, Blum M. Cilia-driven leftward flow determines laterality in Xenopus., 2007, 17(1): 60–66. [50] Essner JJ, Amack JD, Nyholm MK, Harris EB, Yost HJ. Kupffer's vesicle is a ciliated organ of asymmetry in the zebrafish embryo that initiates left-right development of the brain, heart and gut., 2005, 132(6): 1247–1260. [51] Blum M, Weber T, Beyer T, Vick P. Evolution of leftward flow., 2009, 20(4): 464–471. [52] Hirokawa N, Tanaka Y, Okada Y, Takeda S. Nodal flow and the generation of left-right asymmetry., 2006, 125(1): 33–45. [53] Soukup V. Left-right asymmetry specification in amphioxus: review and prospects., 2017, 61(10-11-12): 611–620. [54] Hirakow R, Kajita N. Electron microscopic study of the development of amphioxus,: The gastrula., 1991, 207(1): 37–52. [55] Yu XW, Ng CP, Habacher H, Roy S. Foxj1 transcription factors are master regulators of the motile ciliogenic program., 2008, 40(12): 1445–1453. Progress on the left-right asymmetry patterning in amphioxus Guangwei Hu1,2, Zhenzhen Zhang1,2, Huan Gao1,2 The mechanisms underlying the establishment of left-right (L-R) asymmetry in bilaterians is one of the central enigmas in developmental biology. Amphioxus is an important model in studying the mechanisms of animal asymmetry specification due to its particular phylogenetic position, vertebrate-like embryogenesis and body plan. Recently, with the establishments of artificial breeding technology, high-efficiency microinjection method and gene knockout technology, researchers have successfully dissected the mechanisms of amphioxus L-R asymmetry development. In this review, we summarize the major progress in understanding L-R asymmetry specification in amphioxus and propose a model of regulation of L-R asymmetry in this species. Hh protein is transported dominantly to the right side by cilia movement, leading to R>L Hh signaling andexpression. Cer inhibits expression of Nodal, leading to the asymmetric expression of Nodal-dependent genes. The L-R differences in the propagation of the Nodal pathway result in the correct morphological L-R asymmetry development in amphioxus embryo. BMP signaling probably does not provide the asymmetric cue, but is necessary for correct expression ofand. amphioxus; L-R axis; embryonic development 2020-07-28; 2020-12-18 国家自然科学基金项目(编号:31900370),江苏省自然科学基金项目(编号:BK20191007)和江苏省高校优势学科建设工程项目资助[Supported by the National Natural Science Foundation of China (No. 31900370), the Natural Science Foundation of Jiangsu Province (No. BK20191007), and the Priority Academic Program Development Fund of Jiangsu Higher Education Institutions (PAPD)] 胡广伟,博士研究生,讲师,研究方向:动物遗传发育。E-mail: hgw0127@163.com 10.16288/j.yczz.20-246 2021/1/4 13:52:16 URI: https://kns.cnki.net/kcms/detail/11.1913.R.20201230.1713.002.html (责任编委: 孙永华)1 文昌鱼形态学上的左右不对称
2 参与文昌鱼左右体轴建立的信号通路
2.1 Nodal信号通路与文昌鱼左右体轴建立
2.2 BMP信号通路与文昌鱼左右体轴建立
2.3 Hedgehog信号通路与文昌鱼左右体轴建立
3 左右组织者结构与左右对称的打破
4 结语与展望