纳米孔三代测序在HIV/AIDS合并肺部感染者快速病原学鉴定的应用价值探讨
邓浩辉,刘惠媛,高洪波,陈伟烈
目前,二代宏基因组测序技术已广泛用于临床,能对样本的微生物构成进行准确鉴定,但其受限于实验原理,测序速度相对较慢。根据文献报道,纳米孔三代测序(Oxford Nanopore Technologies)相对于二代测序对样本病原学鉴定具有更快速且能保持准确性的优势。目前该技术对人类免疫缺陷病毒/获得性免疫缺陷综合征(Human Immunodeficiency Virus/Acquired Immunedeficiency Syndrome,HIV/AIDS)合并肺部感染者快速病原学鉴定的准确性评估尚未见相关报道,现报道如下。
1 研究对象与方法
1.1 研究对象 本研究纳入2019年8月-9月在广州市第八人民医院住院治疗的2例HIV/AIDS合并肺部感染者,患者A为男性69岁,患者B为男性60岁。2例患者均留取纤维支气管镜肺泡灌洗液样本。患者HIV/AIDS的诊断符合《中国艾滋病诊疗指南(2018版)》[1]。患者肺部感染的诊断符合《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018版)》[2],临床标本的留取参照 WS/T640-2018临床微生物学检验标本的采集和转运的标准。纳入研究的2例患者均签署知情同意书。
1.2 常规实验室检查 本研究2例患者的肺泡灌洗液样本均进行常规细菌和真菌培养,并常规行结核DNA(PCR法)和GeneXpert MTB/RIF等方法对样本的结核分枝杆菌进行检测。患者血常规检测使用X1000全自动血液分析仪(日本Sysmex公司),血清降钙素原使用Cobas 801全自动电化学分析仪(瑞典Roche公司),CD4+T淋巴细胞计数使用Canto II流式细胞仪进行检测(美国BD公司)。
1.3 样本DNA提取和测序文库的构建
1.3.1 纤维支气管镜肺泡灌洗液样本DNA提取 纤维支气管镜肺泡灌洗液样本首先使用液氮研磨进行预处理,使样本中的微生物充分裂解,处理后的样本使用Qiamp DNA Mini Kit试剂盒(德国Qiagen公司)进行样本总DNA提取,提取后的核酸使用NanoDrop2000核酸检测仪(美国Thermo Fisher公司)进行定量检测。
1.3.2 DNA文库的构建与测序 本研究相同的样本均使用纳米孔三代测序和Illumina二代测序进行建库,以比较两种测序方法的准确性。纳米孔三代测序DNA文库的构建使用快速1D建库试剂盒SQK-RAD004(英国Oxford Nanopore Technologies公司)进行建库。构建好的DNA文库使用Flow cells R9.4测序芯片和MinION测序仪(英国Oxford Nanopore Technologies公司)进行测序。Illumina二代测序文库的构建使用NEB Next Ultra DNA Library Prep Kit for Illumina试剂盒(美国NEB公司)进行DNA文库的构建,构建的DNA文库使用Illumina Hiseq平台(美国Illumina公司),PE150模式进行测序。
1.4 生物信息学分析
1.4.1 原始测序数据的产生和过滤 纳米孔三代测序MinION测序仪产生的原始数据文件格式为fast5,使用MinKNOW软件完成实时识别并生成的fastq文件,然后提取不同时间1、3、6、12、24 h和所有27 h的测序数据,并通过MinKNOW软件过滤低质量值序列。Illumina二代测序的原始数据使用FASTX-Toolkits软件进行数据过滤,剔除Q30小于90%和长度小于35bp的序列,剩余序列进行下游数据分析。过滤后数据进行去宿主DNA操作(使用人基因组参考序列Hg38),纳米孔三代测序数据使用Minimap2软件及Illumina二代测序的数据使用Bowtie2软件进行去宿主DNA序列。
1.4.2 测序数据多序列比对和致病微生物的判定经数据过滤和去宿主DNA的测序数据使用Centrifuge v1.0.3进行与NCBI非冗余核酸数据(NT)库进行多序列比对。原始的微生物比对结果中除病原微生物外,还包括了大量的背景微生物,因此需要设立致病菌的判定标准:①本研究纳入的样本为纤维支气管镜肺泡灌洗液样本,剔除正常口咽部微生物;②查阅相关文献,排除与肺部感染无关的微生物;③对于细菌、病毒和寄生虫,物种覆盖度(CR)水平大于其他微生物10倍以上;对于真菌,CR大于5倍以上;对于结核分枝杆菌,因提取的DNA含量低,故只要检测一条序列,即判定为阳性[3-4];④排除细菌(结核除外)、真菌、病毒序列数少于3的微生物[5]。
2 结果
2.1 常规检查结果 本研究纳入2例HIV/AIDS合并肺部感染者,CT检查均提示双肺多发感染,半乳甘露聚糖和1,3-β-D葡聚糖试验均为阴性。患者A入院后查白细胞为7.59×109/L,中性粒细胞比例为88.2%,降钙素原0.096 ng/L,CD4+细胞计数264/μL,肺泡灌洗液细菌培养提示铜绿假单胞菌感染。患者B入院后查白细胞为6.47×109/L,中性粒细胞比例为80.5%,降钙素原0.130 ng/L,CD4+细胞计数142/μL,肺泡灌洗液细菌培养提示肺炎克雷伯杆菌和屎肠球菌混合感染,结核DNA检测阳性,GeneXpert MTB/RIF检查提示样本中结核分枝杆菌阳性。
2.2 样本测序的数据量 纳米孔三代测序和Illumina二代测序的原始数据量和过滤后的数据量(表1),患者A和患者B的纤维支气管镜肺泡灌洗液样本对应为样本A和样本B。样本A和样本B纳米孔三代测序所产生的原始数据量分别为10.2 G和11.3 G,平均序列长度分别为(1.35±0.42)Kb和(1.40±0.5)Kb。样本A和样本B的Illumina二代测序原始数据量为8.3 G和8.5 G。纳米孔三代测序不同时间产生的序列数和Illumina二代测序产生的序列数,表1。
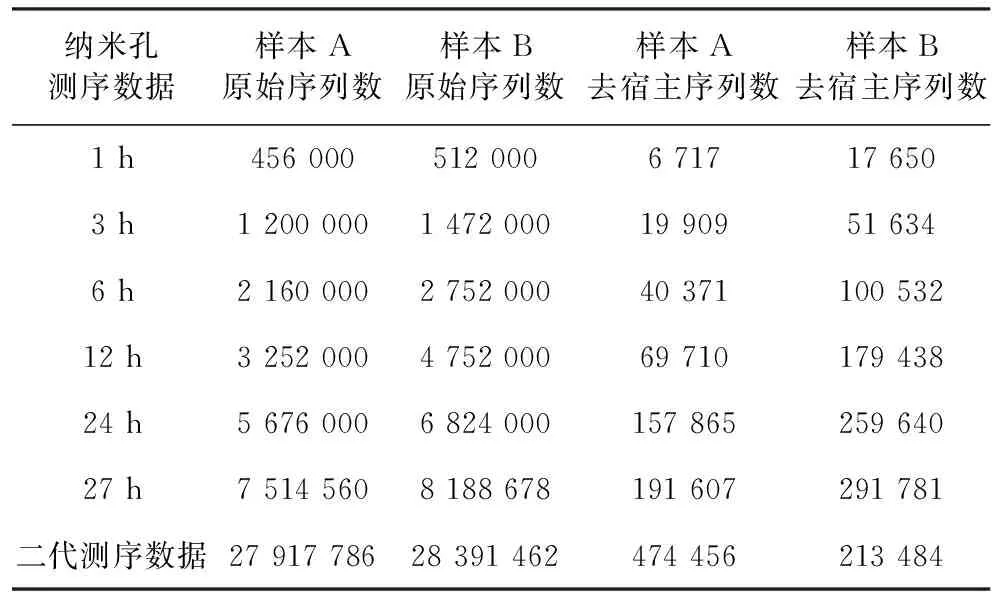
表1 纳米孔三代测序和Illumina二代测序原始和去宿主后的序列数(条)
2.3 纳米孔三代测序快速病原学鉴定结果分析 本研究中,样本A纤维支气管镜肺泡灌洗液常规细菌培养的结果提示样本中的致病菌为铜绿假单胞菌,二代测序的结果也发现铜绿假单胞菌的基因序列,纳米孔三代测序仅1 h的测序结果已可检测出该菌的基因序列;在样本B中,常规细菌培养和病原学检查的结果提示肺炎克雷伯杆菌、屎肠球菌和结核分枝杆菌混合感染,二代测序的结果也提示上述致病菌感染,对纳米孔三代测序数据的分析结果提示,在测序1 h后,即可检测出肺炎克雷伯杆菌和屎肠球菌基因序列,6 h的测序结果可发现结核分枝杆菌的序列,表2。
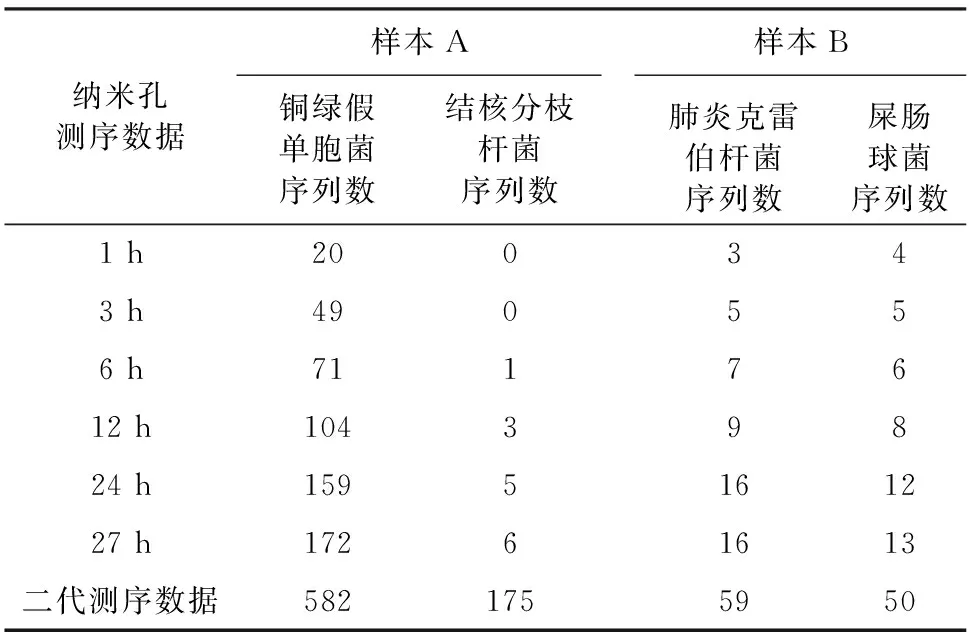
表2 纳米孔三代测序和Illumina二代测序检测致病微生物的序列数(条)
3 讨论
对于感染性疾病,确定病原体的时间非常重要,建立快速病原鉴定的方法对合理使用抗感染药物有重要的指导作用[6]。传统的细菌和真菌培养技术耗时较长,且微生物培养的阳性率受限于方法学和抗菌素治疗的影响,大部分的细菌和真菌在常规的培养条件下难以生长[7]。目前,随着高通量测序技术的发展,二代宏基因组测序(Illumina和IonPGM测序等平台)已广泛应用于科研和临床诊疗[8],其结果可指导临床合理使用抗菌药物,提高临床疗效,改善患者预后[9],二代测序对微生物检测的灵敏度和准确性高,但受限于其实验原理,获取结果需耗时3 d以上。根据文献报道,纳米孔三代宏基因组测序能在极短时间内对样本中的微生物进行快速病原学鉴定[10-11],但目前评估该技术在HIV/AIDS合并肺部感染者快速病原学鉴定准确性的研究未见报道。
HIV/AIDS患者由于天然免疫,细胞和体液免疫受损[12-13],常合并各种机会性感染,其中肺部感染是HIV/AIDS患者最常见的机会性感染[14]。HIV/AIDS肺部感染常为多种致病菌混合感染[15],且反复发生。严重的肺部感染常合并呼吸衰竭,是HIV/AIDS患者死亡率上升的主要原因,而快速准确的病原学诊断对治疗肺部感染和减少患者死亡率至关重要。
本研究中,对2例HIV/AIDS合并肺部感染者纤维支气管镜肺泡灌洗液样本进行研究,结果表明,纳米孔三代测序仅1 h的测序结果即可检测出样本致病菌(铜绿假单胞菌,肺炎克雷伯杆菌和屎肠球菌)的基因序列,6 h的测序结果已可检测结核分枝杆菌的基因序列,外加样本处理和DNA文库构建,生物信息学分析(约2 h),仅需8 h即可检测出上述样本致病微生物的组成,且结果与常规病原学检查和Illumina二代测序的结果基本一致,提示纳米孔三代测序能在极短的时间准确判断样本中的微生物组成。
综上所述,纳米孔三代测序的快速测序模式可快速且准确地了解HIV/AIDS合并肺部感染者肺泡灌洗液的微生物组成,为患者合理使用抗感染药物提供理论依据。由于纳米孔三代测序的成本问题,本研究仅纳入2例患者进行研究,仍需纳入更多临床样本进行研究验证其准确性。另外,本研究仅对样本的DNA进行测序,下一步研究应对样本的RNA进行测序,进一步评价其在病毒宏基因组测序中的准确性。

