25-羟维生素D抑制类风湿关节炎滑膜成纤维细胞释放炎性因子的相关性研究
张月月,顾冰洁,沈敏宁,杨磊磊,苏定雷,高大玉,袁 海,陈兴国
0 引 言
类风湿关节炎(rheumatoid arthritis,RA)是一种以侵犯多个小关节为主要临床表现的慢性自身免疫性疾病,滑膜成纤维细胞(Fibroblast-like Synoviocytes,FLS)是RA滑膜组织的主要成分,在炎症刺激下产生大量细胞因子,包括:白细胞介素-1β(Interleukin-1 Beta, IL-1β)、IL-6、IL-8、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、血小板抑制因子、血管内皮生长因子等,引起滑膜炎症与增生[1]。RA发病机制较为复杂,遗传和环境因素均参与其发病过程。维生素D缺乏在RA发病机制中的作用及维生素D的抗炎和免疫调节作用日益受到关注[2]。目前研究显示RA患者血清中存在维生素D不足与缺乏[3],并与疾病活动度呈负相关[4]。我们课题组前期的小鼠实验研究中发现,在维生素D缺乏的环境下,人细胞色素P450家族成员27B1-/-(CYP27B1-/-)加速了胶原诱导性小鼠RA的发生发展,其关节肿胀加剧,C反应蛋白水平升高,关节骨破坏及滑膜炎症增加,而补充活性维生素D可使这一病理过程得到缓解[5]。在炎症环境中,活性维生素D可上调FLS的骨保护素/核因子κB配体的比值,抑制炎症诱导的RA破骨作用[6]。但活性维生素D抑制炎症的机制是否与抑制炎性细胞因子(TNF-α,IL-1β,IL-6)的释放有关,迄今未见明确的研究结论。本研究通过体外实验,检测活性维生素D干预前后MH7A细胞的炎性细胞因子的表达变化,证实维生素D在滑膜细胞中的抗炎作用。
miRNAs作为调控细胞信号转导因子,不仅参与了RA患者炎症反应的调控,而且还参与了FLS的增殖、凋亡、侵袭和炎性细胞因子的分泌[7]。据报道,miR-155在RA患者的外周血以及FLS中表达上调[8],其过表达可促进FLS的增殖和炎性细胞因子的分泌[9]。因此,本研究通过给予活性维生素D干预前后检测MH7A滑膜细胞中miR-155表达的变化,了解两者间的关系,为探讨其抑制炎症的分子作用机制奠定基础。
1 资料与方法
1.1 实验资料
1.1.1 样本采集回顾分析2019年5月至2020年5月南京市第一医院风湿免疫科住院的类风湿关节炎患者血清标本93份,以及同期正常体检者血清标本48份。统计25(OH)D的浓度,并记录RA患者类风湿因子(RF)、抗环瓜氨酸多肽(抗CCP)抗体、血沉(ESR)、C反应蛋白(CRP)、血钙(Ca)、压痛关节数(TJC)和肿胀关节数(SJC)的临床指标。所有RA患者均符合2010年美国风湿病学会(ACR)/欧洲抗风湿联盟(EULAR)RA的分类标准。并排除感染、严重心脑血管疾病、糖尿病、肝肾功能不全、恶性肿瘤以及合并其他结缔组织病;发病期间未服用影响体内维生素D代谢的相关药物。
1.1.2主要试剂人类滑膜成纤维细胞系(MH7A)来源于日本瑞肯细胞库(Ibaraki),此细胞系是由RA患者原代滑膜成纤维细胞经SV40T抗原基因转染而成的永生化细胞系。高糖DMEM培养基(Gibco公司,美国),10%胎牛血清(ScienCell,美国),0.25%Trypsin-EDTA(Gibco公司,美国),Anti-Anti(Gibco公司,美国),TRIzol(TaKaRa,日本),RNA逆转录试剂盒及SYBR Green PCR Master Mix(TaKaRa,日本),miRNA逆转录试剂盒,U6引物(锐博,中国广州),1a,25(OH)2D3(Sigma-Aldrich,美国),脂多糖LPS(Sigma-Aldrich,美国),引物设计合成(生工,中国), ELISA试剂盒(R&D Systerms a biotechne brand,美国)。
1.2方法
1.2.1 临床数据分组将类风湿关节炎住院患者血清93份作为RA组,同期正常体检者血清48份作为健康组,用质谱法检测血清25(OH)D的浓度值,比较两组值之间的差异。并记录以上93例住院患者的临床指标,包括:类风湿因子、抗环瓜氨酸多肽抗体、血沉、C反应蛋白、血钙、压痛关节数、肿胀关节数和25(OH)D水平。按疾病活动度DAS28评分将93份数据分为缓解组、中低活动组和高活动组,统计不同疾病活动度与25(OH)D及其他临床指标的相关性;按血清25(OH)D浓度将93份数据分为25(OH)D正常组、25(OH)D不足组和25(OH)D缺乏组,统计不同血清25(OH)浓度与疾病活动度及其他临床指标的相关性。以及统计血清25(OH)D水平与各临床指标之间相关性。
1.2.2细胞培养及干预在37 ℃、5%CO2培养箱中将MH7A细胞在6孔培养板上用含有10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素、DMEM高糖培养基中培养传代,当细胞融合率达85%,细胞数约(2×105个/皿)进行下一步实验。脂多糖(LPS)溶于蒸馏水中配置为浓度50 μg/mL溶液,1α-25(OH)2D3(VD)溶于无水乙醇中配制成浓度为10-4mol/L的溶液。将细胞分为对照组、刺激组和干预组,对照组:孔中不加任何处理;刺激组:孔中加入LPS终浓度为100 ng/mL和无水乙醇与细胞培养基孵育5 h,模拟RA的体外炎症环境;干预组:孔中加入VD(10-4mol/L)终浓度为10-8mol/L和LPS(100 ng/mL)与细胞培养基共孵育24 h,收集3组细胞及细胞上清进行下一步实验。
1.2.3RNA提取与实时定量PCR细胞总RNA经TRIzol提取,用反转录酶对总RNA进行1 μg逆转录成cDNA。炎性因子的表达,以β-actin作为内参,miRNA的表达以U6作为内参,每个样品均设3个副孔。用融解曲线验证PCR结果,用循环相对表达量计算阈值(Ct)值和2-△△CT来表示目的基因相对表达量。引物序列见表1。

表 1 RT-qPCR分析的引物序列
1.2.4炎性细胞因子(TNF-α、IL-1β、IL-6)的测定用ELISA法进行。将收集的3组细胞上清液,使用相应的ELISA试剂盒来定量炎性细胞因子的蛋白浓度。根据厂家说明及步骤检测。
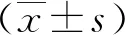
2 结 果
2.1 RA组与健康组25(OH)D浓度的比较RA组血清25(OH)D水平[(15.8±6.01 )ng/mL)]低于健康组[(30.5±3.80)ng/mL],差异有统计学意义(P<0.01)。
2.2RA疾病活动度与25(OH)D及其他临床指标的比较疾病高活动组的血清25(OH)D水平低于缓解组和中低活动组(P<0.05),中低活动组的血清25(OH)D水平低于缓解组(P<0.05);疾病高活动组的ESR、CRP、TJC和SJC高于缓解组和中低活动组(P<0.05),中低活动组的ESR、CRP、TJC和SJC高于缓解组(P<0.05)。见表2。
2.3RA血清25(OH)浓度值与疾病活动度及其他临床指标的比较血清25(OH)D缺乏组的DAS28、ESR、CRP、TJC和SJC高于另外2组(P<0.05);血清25(OH)D不足组的DAS28、ESR、CRP、TJC和SJC与25(OH)D正常组差异无统计学意义(P>0.05)。见表3。
2.4RA血清25(OH)D水平与临床指标相关性针对93份血清25(OH)D水平,分析其与RF、抗CCP、ESR、CRP、血Ca、DAS28、TJC和SJC之间的相关性,结果显示血清25(OH)D与高ESR(r=-0.485,P<0.01);高CRP(r= -0.667,P<0.01);低血Ca(r=0.548,P<0.01);高TJC(r=-0.563,P<0.01);高SJC(r=-0.466,P<0.01)及高DAS28评分(r=-0.761,P<0.01)相关;与RF、抗CCP无明显相关性。见图1。
2.5VD降低MH7A炎性细胞因子的表达RT-qPCR结果显示,LPS刺激MH7A细胞后,与对照组比较,刺激组炎性细胞因子(TNF-α,IL-1β,IL-6)的mRNA表达水平升高(P<0.01);与刺激组比较,干预组的炎性细胞因子的mRNA表达水平下调(P<0.01),见图2。ELISA结果同样也显示,与对照组比较,刺激组炎性细胞因子的蛋白表达水平升高(P<0.01);与刺激组比较,干预组的炎性细胞因子的蛋白表达水平有所下调(P<0.05),见图3。

表 2 RA疾病活动度与25(OH)D及临床指标的一般资料
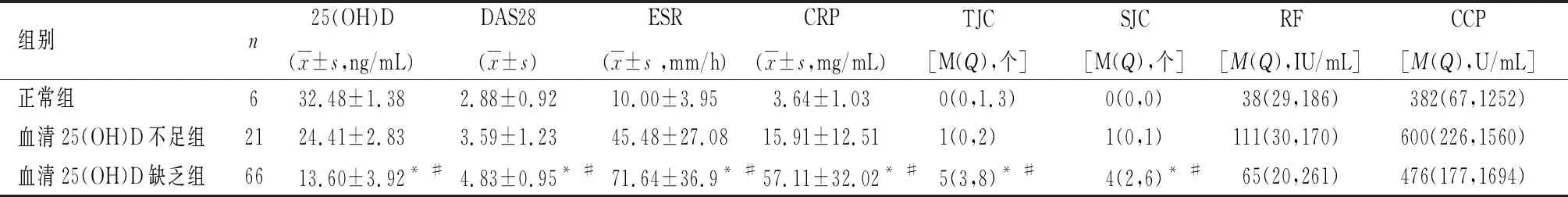
表 3 RA 25(OH)D浓度与DAS28及临床指标的一般资料
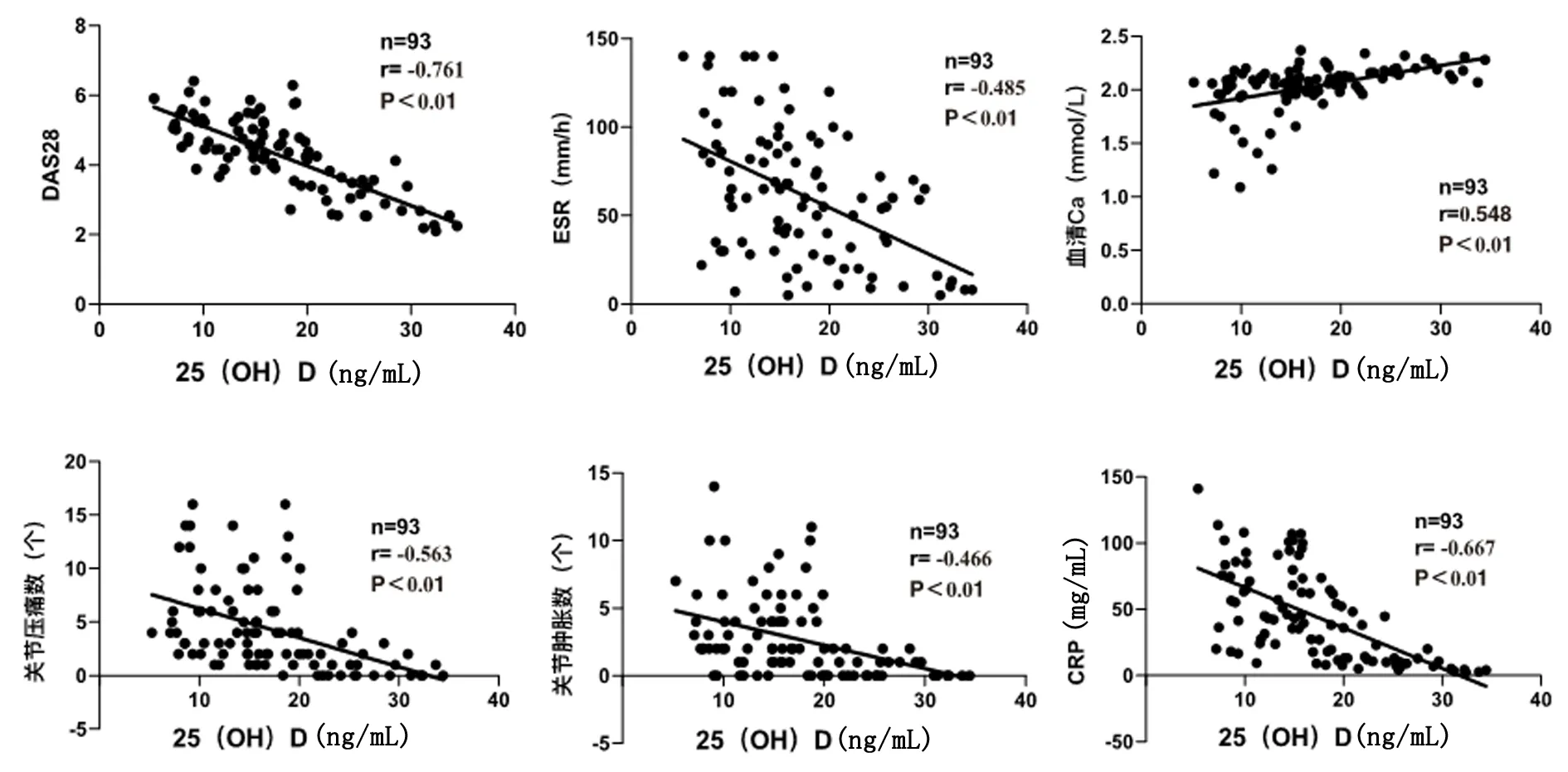
图 1 血清25(OH)D与DAS28、ESR、Ca、TJC、SJC和CRP相关
*P < 0.01

*P < 0.05, **P < 0.01
2.6VD降低MH7A细胞中miR-155的表达RT-qPCR检测,与对照组miR-155表达(1.00±0.00)比较,刺激组(3.86±0.07)升高(P< 0.01),而干预组较刺激组表达(2.22±0.10)下调(P< 0.01)。
3 讨 论
维生素D是一种类固醇激素,在体内的主要活性形式是1,25-二羟基维生素D3,并与维生素D受体结合发挥相应的生物学效应[10]。传统认为维生素D的主要生理功能是调节钙、磷代谢,促进骨骼生长,它的缺乏会导致骨质疏松和佝偻病[11]。近年来研究发现维生素D具有免疫调节活性,它通过抑制T细胞的增殖、分化和炎性细胞因子的产生,诱导调节性T细胞的分化等发挥作用[12]。其缺乏会增加自身免疫性疾病的风险,包括类风湿关节炎、系统性红斑狼疮(SLE)、I型糖尿病、自身免疫性甲状腺疾病、多发性硬化和炎性肠病[13-17]。迄今为止,维生素D补充剂被认为是安全的,诱发高钙血症和尿路结石的风险较低[18],并具有心血管保护作用[19]。在风湿科,维生素D补充剂可预防糖皮质激素引起的骨质疏松和减少老年骨质疏松症的骨折[20-21]。然而,维生素D补充剂在免疫介导的风湿病[如SLE、RA、系统性硬化症(SSC)和血管炎]中的抗免疫炎症作用尚未得到很好的证实[22]。
血清25(OH)D是活性维生素D在体内的主要代谢中间产物,可直接反映1,25(OH)2D3在体内的水平。虽然对健康和病理状态下的血清25(OH)D水平没有共识,但在健康个体中发现25(OH)D水平大约在30~100 ng/mL,而21~29 ng/mL是其不足状态的特征,低于20 ng/mL表明其明显缺乏[23]。本研究统计了93例RA患者的血清25(OH)D水平,发现93.5%RA患者存在25(OH)D的不足或缺乏。与Lee等[3]的研究一致。该研究统计结果还发现患者疾病活动度越高,其血清25(OH)D水平越低,ESR、CRP、TJC、SJC越高,与RF和抗CCP无显著相关性;当血清中25(OH)D浓度降低明显时,ESR、CRP、TJC、SJC和DAS28评分显著升高,与RF和抗CCP无显著相关性。说明RA患者血清中25-羟维生素D3水平与RA患者的疾病活动度呈负相关,血清中RF和抗CCP水平与病情活动不相关,与Lin等[4]的meta分析和系统性回顾研究相一致。此外本研究分析了93例患者血清25(OH)D水平与患者的年龄、病程、RF、抗CCP、ESR、CRP、血Ca、DAS28、TJC、SJC之间的相关性,发现其与血清中ESR、CRP、DAS28、TJC、SJC呈负相关,与血Ca呈正相关,另外该研究还发现血清25(OH)D水平与病程、RF和抗CCP无相关性。说明RA患者高ESR、高CRP、低Ca、高TJC、高SJC、高DAS28评分,其血清25(OH)D水平可能更低,病程、RF和抗CCP不影响血清25(OH)D水平。以上研究证明RA高活动患者维生素D缺乏更明显,维生素D缺乏可能加重RA的发生、进展,但需注意的是RA的发生、进展还受到很多其他因素的影响,如遗传、环境危险因素,需要临床上不断的研究、探索。
目前维生素D的抗免疫炎症作用尚未被证实。但最近的一项Meta分析结果提示维生素D补充降低了系统性红斑狼疮抗ds-DNA的阳性率,并可能减少类风湿关节炎的复发[24]。我们课题组已经在小鼠实验模型中发现补充活性维生素D可缓解关节炎进展[5]。该次研究采用体外实验以支持维生素D在RA治疗中的抗炎作用。因原代类风湿性滑膜成纤维细胞在扩张和维持过程中逐渐失去RA的特性,我们选用MH7A作为研究RA成纤维样滑膜细胞的有用细胞系[25]。研究发现用LPS刺激滑膜细胞后,炎性细胞因子(TNF-α、IL-1β、IL-6)的表达明显升高,证实脂多糖(LPS)可通过诱导线粒体依赖的凋亡从而诱导MH7A细胞释放促炎细胞因子,表明我们成功建立了RA的体外模拟环境。在体外给予适当浓度的活性维生素D干预后炎性细胞因子的表达得到较为显著的抑制,证实其在滑膜细胞中具有抗炎作用。以上这些初步结果可以表明维生素D补充剂在RA治疗中的有利作用。但是目前研究缺乏临床数据统计的支持,譬如在RA患者中给予活性维生素D治疗与未给予活性维生素D治疗两组病人RA疾病活动度的评估。但患者的维生素D补充试验在病人数量、特征、疾病持续时间/严重程度、用药方案的类型/持续时间、结果的分析和衡量这些结果的时间等方面都尚待深入研究。
本研究结果已证实用LPS刺激MH7A细胞后,miR-155表达升高,体外给予活性维生素D干预后miR-155的表达被抑制,而miR-155的高表达可促进滑膜成纤维细胞的增殖和炎性细胞因子的分泌[9]。因此我们猜测维生素D可能通过调控miR-155在滑膜成纤维细胞中的表达来发挥其在RA中的抗炎作用。但其通过何种分子信号通路来抑制滑膜细胞炎性因子的释放,有待更完善的实验数据阐明。
综上所述,RA患者存在维生素D水平不足或缺乏,并与疾病活动度呈负相关。活性维生素D可抑制滑膜成纤维细胞炎性细胞因子的释放,补充维生素D有利于RA的治疗。

