甜龙竹笋采后不同时间及温度储藏下酶活性的变化*
董春凤,赵一鹤
(1.西南林业大学生态与环境学院,云南 昆明 650224;2.云南省林业和草原科学院,云南 昆明 650201)
甜龙竹(Dendrocalamusbrandisii),别名甜竹、勃氏麻竹、勃氏甜龙竹,在云南省分布较为广泛,主要分布在云南南部、西部,海拔600~2 000 m,广东也有栽培[1]。甜龙竹属禾本科(Gramineae)牡竹属(Dendrocalamus)竹种,正常发笋期 6—10月,笋重1~3 kg左右,笋高在25~50 cm之间。由于甜龙竹竹丛紧密高大、叶片翠绿宽大,又具有一定的观赏价值,是亚热带地区一种极为重要的经济竹种,且笋可鲜食,是我国重要和优良的笋材兼用竹,在我国西双版纳、普洱等地及东南亚国家广受欢迎[2-3]。甜龙竹多栽种于偏远山区,交通不便,竹笋采后运输距离和时间长,导致竹笋木质化。在竹笋木质化过程中,纤维素和木质素的合成与沉积是竹笋木质化的主要原因,而木质素的合成是许多酶参与的一个复杂生理过程,木质素生物合成途径参与的酶主要包括苯丙氨酸解氨酶、肉桂酸-4-羟基化酶、肉桂酸-3-羟基化酶、4-香豆酸辅酶A连接酶、阿魏酸-5-羟基化酶、对羟基苯乙烯酰辅酶A-3-脱氢酶、肉桂酰辅酶A还原酶、肉桂醇脱氢酶等[4]。研究较多的与竹笋木质化相关的酶有苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)、过氧化氢酶(CAT)、过氧化物酶(POD)、肉桂醇脱氢酶(CAD)、超氧化物歧化酶(SOD)等。
目前,关于绿竹(Bambusaoldhami)[5-6]、雷竹(Phyllostachyspraecoxf.prevelnalis)[7-8]、毛竹(Phyllostachypubescens)[9-10]等竹笋的采后酶活性变化的研究很多,而关于甜龙竹笋的采后酶活性变化鲜见报道。本研究对甜龙竹笋在采后不同储藏时间和不同储藏温度下的PAL、PPO、CAT、POD、CAD酶活性变化进行测定,分析其变化特征,以期为下一步甜龙竹笋活体保鲜技术研究提供理论基础和科学依据。
1 材料与方法
1.1 材料和处理
本项研究采用新鲜甜龙竹笋,2020年8月采摘于云南省普洱市思茅区倚象镇半坡村杨家寨。采集大小适中,高约30 cm左右,无病虫害和机械损伤、生长健壮的鲜活甜龙竹笋,带回云南省林业和草原科学院经济林产品检测中心实验室,分0 ℃、4 ℃以及常温保存(20~25 ℃),采取基部、中部、尖部混合取样的方式,每隔12 h取样1次(0.5 g),总共7次。每次取样重复3次,取平均值。取样以后使用液氮速冻处理后放置于-80 ℃超低温冰箱保存待测。
1.2 测定指标和方法
采用植物ELISA检测试剂盒(酶联免疫法)对苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)、过氧化氢酶(CAT)、过氧化物酶(POD)、肉桂醇脱氢酶(CAD)进行测定[11]。具体步骤如下:从室温平衡20 min后的铝箔袋中取出所需板条,剩余板条用自封袋密封放回4 ℃冰箱。设置一个标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;样本孔先加待测样本10 μL,再加样本稀释液40 μL;空白孔不加。除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,用封板膜封住反应孔,37 ℃水浴锅或恒温箱温育60 min。弃去液体,使用吸水纸上拍干,每孔加满洗涤液,静置1 min,甩去洗涤液,继续使用吸水纸上拍干,如此重复洗板5次(也可用洗板机洗板)。每孔加入底物A、B各50 μL,37 ℃避光孵育15 min。每孔加入终止液50 μL,15 min内,在450 nm波长处测定各孔的OD值[12]。
1.3 数据分析
使用Excel 2010和SPSS 24对数据进行整理和方差分析,使用Origin 2019软件进行图表绘制,所有数据均为3次生物学重复平均值±标准差(SD)。
2 结果和分析
2.1 不同储藏时间和温度下酶活性的变化
2.1.1 PAL(苯丙氨酸解氨酶)活性变化
采后甜龙竹笋在不同储藏温度下PAL活性随时间的变化见图1。由图1可知,不同温度储藏下甜龙竹笋PAL活性总体随着储藏时间呈现先上升后下降的趋势。0 ℃储藏的甜龙竹笋PAL活性变化范围是0.080~0.208 U/g,其中,在12 h检测到最大值为0.208 U/g(P<0.05),在72 h检测到最小值为0.080 U/g(P<0.05);4 ℃储藏的甜龙竹笋的PAL活性先上升后下降,PAL变化范围是0.098~0.199 U/g,在12 h检测到最大值为0.199 U/g(P<0.05),在72 h最小值为0.098 U/g(P<0.05);常温对照(20~25 ℃)储藏的甜龙竹笋PAL活性呈现先上升再下降、再上升再下降的波动,在12 h检测到最大值为0.218 U/g(P<0.05),在72 h检测到最小值为0.095 U/g(P<0.05),表明常温对照组PAL活性波动较大。而在储藏时间72 h均检测到所有储藏温度的最小值,分别为0.080、0.098和0.095 U/g。总体来看,相比0 ℃和4 ℃储藏的甜龙竹笋,常温对照组的PAL活性处在一个较高的水平,表明0 ℃和4 ℃低温储藏可以在一定程度上抑制PAL活性的急剧上升或下降。

图1 不同贮藏温度下甜龙竹笋PAL(苯丙氨酸解氨酶)活性变化Fig.1 Changes of PAL(Phenylalanine Ammonia-lyase)activity in D.brandisii under different storage temperatures
2.1.2 PPO(多酚氧化酶)活性变化
采后甜龙竹笋在不同储藏温度下PPO活性随时间的变化见图2。由图2可知,不同温度储藏的甜龙竹笋PPO活性总体随着储藏时间呈现波动变化的趋势。0 ℃储藏的甜龙竹笋PPO活性变化范围是8 179.667~19 571.333 U/g,在36 h的最大值为19 571.333 U/g(P<0.05),在24 h最小值为8 179.667 U/g(P<0.05);4 ℃储藏的甜龙竹笋PPO活性变化范围是9 033.000~19 488.333 U/g,在72 h最大值为19 488.333 U/g(P<0.05),在24 h最小值为9 033.000 U/g(P<0.05);常温对照(20~25 ℃)储藏的甜龙竹笋PPO活性在0 h到12 h波动不大,24 h后急剧下降到最小值6 742.667 U/g(P<0.05),之后又上升再下降,到72 h上升到最大值21 654.333 U/g(P<0.05)。
2.1.3 CAT(过氧化氢酶)活性变化
采后甜龙竹笋在不同储藏温度下CAT活性随时间的变化见图3。由图3可知,不同温度储藏的甜龙竹笋CAT活性随着储藏时间呈现波动变化的趋势。0 ℃储藏的甜龙竹笋CAT活性变化范围是624.933~819.533 U/g,在48 h的最大值为819.533 U/g(P<0.05),在12 h最小值为624.933 U/g(P>0.05);4 ℃储藏的甜龙竹笋CAT活性变化范围是553.133~899.300 U/g,在0 h最大值为899.300 U/g(P<0.05),在24 h最小值为553.133 U/g;刚采收后甜龙竹笋的CAT活性就到达一个较高的值,常温对照组的甜龙竹笋的CAT活性最高,达到936.233 U/g,达到顶峰后急剧下降到最小值476.333 U/g,而后持续上升又下降。

图3 不同贮藏温度下甜龙竹笋CAT(过氧化氢酶)活性变化Fig.3 Changes of CAT(catalase)activity in D.brandisii
2.1.4 POD(过氧化物酶)活性变化
采后甜龙竹笋在不同储藏温度下POD活性随时间的变化见图4。由图4可知,不同温度储藏的甜龙竹笋POD活性随着储藏时间呈现波动变化的趋势。0 ℃储藏的甜龙竹笋POD活性变化范围是2.671~4.686 U/g,在72 h检测到最大值为4.686 U/g(P<0.05),在36 h检测到最小值为2.671 U/g(P<0.05);4 ℃储藏的甜龙竹笋POD活性变化范围是2.561~4.067 U/g,在72 h检测到最大值为4.067 U/g,在60 h检测到最小值为2.561 U/g(P<0.05);常温对照的甜龙竹笋POD活性波动变化到48 h达到最高值4.445 U/g,在60 h降至最小值3.088 U/g。

图4 不同贮藏温度下甜龙竹笋POD(过氧化物酶)活性变化Fig.4 Changes of POD(peroxidase)activity of D.brandisii under different storage temperatures
2.1.5 CAD(肉桂醇脱氢酶)活性变化
采后甜龙竹笋在不同储藏温度下CAD活性随时间的变化见图5。由图5可知,不同温度储藏的甜龙竹笋CAD活性随着储藏时间呈现波动变化的趋势。0 ℃储藏的甜龙竹笋CAD活性变化范围是5 175.667~7 870.667 U/g,在0 h检测到最大值为7 870.667 U/g(P<0.05),在72 h检测到最小值为5 175.667 U/g;4 ℃储藏的甜龙竹笋CAD活性变化范围是4 520.333~7 592.000 U/g,在36 h检测到最大值为7 592.000 U/g,在72 h检测到最小值为4 520.333 U/g(P<0.05)。常温对照组的甜龙竹笋CAD活性在0 h到24 h呈下降趋势,在24 h后开始升高,到36 h达到最大值8 450.667 U/g(P<0.05),在72 h检测到最小值4 596 U/g。
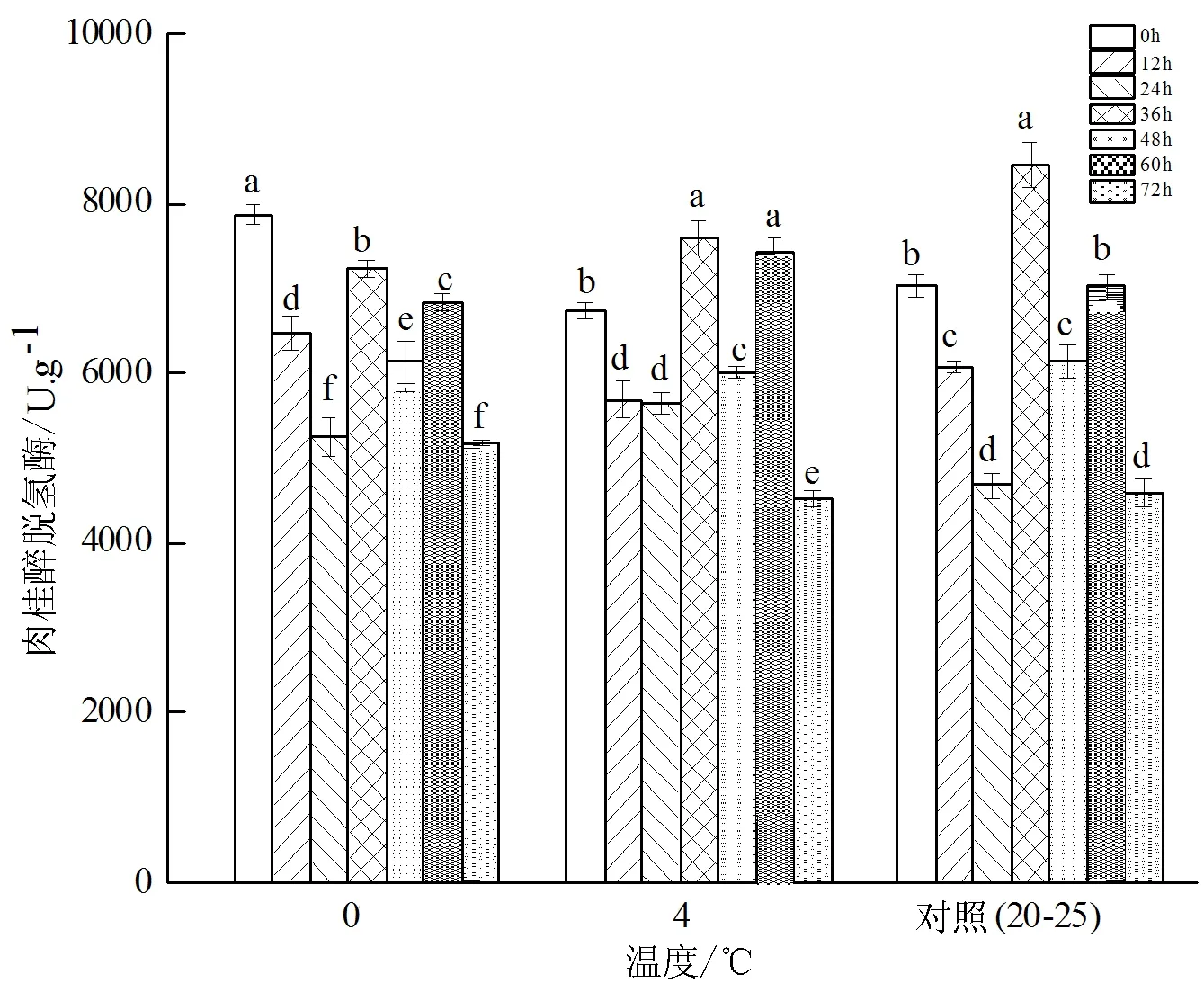
图5 不同贮藏温度下甜龙竹笋CAD(肉桂醇脱氢酶)活性变化Fig.5 Changes of CAD (cinnamyl alcohol dehydrogenase)activity in D.brandisii under different storage temperatures
2.2 时间和温度对酶活性的影响
从表1可知,5种甜龙竹笋酶活性在第一排序轴解释量为60.37%,第二排序轴解释量为20.60%,即前两轴对酶活性特征解释值为80.97%,且储藏的时间-温度对酶活性的累计解释量达到了97.06%。表明前两轴能较好的解释甜龙竹酶活性与培养的时间-温度关系,并且主要由第一排序轴决定。第一、第二排序轴中,时间-温度因子与甜龙竹笋酶活性的相关系数分别为0.795 4和0.604 1,反映出甜龙竹酶活性与的时间-温度关系密切。
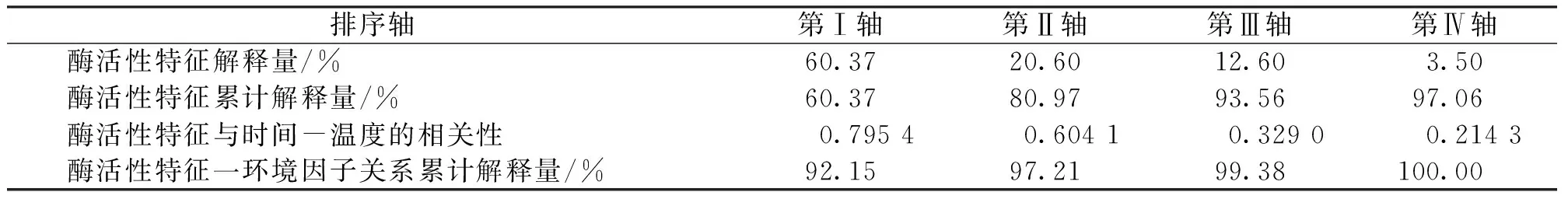
表1 时间-温度对酶活性RDA排序的特征值及累积解释量Tab.1 The eigenvalues and cumulative interpretations of enzyme activities’ RDA sequencing by time-temperature
从培养的时间-温度与酶活性的二维排序图(图6)可知,时间与PPO和CAT夹角较小且方向一致,说明其与两种酶呈显著正相关关系(P<0.05),表明时间对PPO和CAT的正向变化起促进的作用;而时间与PAL夹角最大且方向相反,表明其对该种酶存在显著负效应。温度与POD夹角最小且方向一致,说明温度对POD影响最大且呈显著正相关关系。储藏的时间-温度均对CAD无明显的方向和夹角关系,表明时间和温度对该酶活性的影响最小。

图6 酶活性与时间-温度的冗余度分析Fig.6 Redundancy analysis of enzyme activities and time-temperature
3 讨论与结论
3.1 讨论
竹笋采后木质化过程中,笋体内外都发生着一系列的变化,笋壳变黄、变暗、褐化、霉变等,笋体内营养成分流失、竹笋硬度增加,逐渐丧失口感和食用品质。而竹笋木质化过程是在一系列酶促反应下进行的[13]。PAL、POD、PPO、CAD、CAT在竹笋木质化的过程中都起着重要作用。PAL、POD、PPO、CAD、CAT在竹笋木质化的过程中都发挥着重要作用。PAL是木质素生物合成中的关键酶,可以催化苯丙氨酸转化为肉桂酸[14]。PPO 是酚类物质进行合成的关键酶,它可以为木质素合成提供前体物质[15]。CAT作为一种活性氧清除剂,能够清除O2-、H2O2减缓褐变[15]。POD是木质素合成最后一步的限速酶,在木质素生物合成中通过催化H2O2分解从而使木质素单体能发生聚合反应形成木质素[16]。CAD是木质素合成途径中作用于木质素合成代谢途径的最后一步反应的关键酶[16]。本研究测定的0 ℃、4 ℃以及常温对照(20~25 ℃)下甜龙竹笋PAL、POD、PPO、CAT、CAD的酶活性变化特征,PAL呈现先上升后下降的趋势,这与许多学者研究结果一致。谢冰[17]等的研究表明,绿芦笋采后PAL、PPO、CAD、POD 的活性均呈先上升后下降的趋势,这在麻竹笋[18]、绿竹笋[6]、雷竹笋[19]的采后酶活性研究中变化趋势也相同。周成敏等[20]研究发现黄甜竹笋采收后,随着贮藏时间的增加,PAL 和 POD 活性在短时间内快速地增加,经过一定时间后减少。在本研究中,储藏时间达到12 h后,0 ℃、4 ℃以及常温对照的甜龙竹笋PAL活性呈现波动下降的趋势,这是由于甜龙竹笋在逆境环境压迫下,苯丙烷类代谢被激活,导致 PAL酶活力上升,此时笋内体会产生较多植酸、木质素等来降低自身所受的伤害。在合成一定量的次生物质后,它们会反馈抑制PAL酶活力,从而减少营养物质的流失,并防止次生物质过度积累对笋体产生毒害,延缓老化[21]。PPO活性呈现波动变化趋势,这和周琦[18]、夏海涛[22]的研究结果一致,出现这种趋势的原因,可能是酚类物质氧化成醌,进行下一步聚合时消耗掉一部分底物;还有可能是褐变组织中PPO受较低的酶反应底物与较高的产物所制约[23-24]。POD活性在不同温度下都呈现波动趋势,常温(对照组)POD活性总体上高于0 ℃和4 ℃,但是差别不大,这和周琦[18]、夏海涛等[25]在不同温度贮藏雷竹笋和马蹄笋的研究结果不一致,可能是竹笋品种、取样时间以及温度设置等实验条件的差别导致。CAT和CAD活性在不同温度下呈现波动趋势,但常温对照组CAT活性波动较大,表明储藏温度对甜龙竹笋采后CAT活性存在影响,可能与甜龙竹笋受到高温胁迫有关。常温(对照组)CAD活性在36 h达到峰值,明显高于0 ℃和4 ℃储藏下的甜龙竹笋的CAD活性峰值,表明低温对于甜龙竹笋采后CAD活性有一定的抑制作用,但变化呈现波动趋势,考虑可以设置间隔更长的时间梯度,以达到更好的观测甜龙竹笋采后CAD活性变化规律。
3.2 结论
甜龙竹笋采后储藏过程中,酶活性的异常变化会导致甜龙竹笋品质的下降、营养成分的流失、食用率和商品率下降等问题。本次研究得知,低温储藏对甜龙竹笋的酶活性波动起到一定的抑制作用,常温下储藏的甜龙竹笋酶活性波动范围大,且会急剧上升或下降。储藏时间的延长对PPO和CAT的活性增加起促进的作用,对PAL活性存在抑制作用。

