LSA-10型大孔树脂分离恒山黄芪总黄酮的吸附动力学
刘 瑞, 张弘弛*, 魏新宇, 李 慧, 周 凤
(1.山西大同大学生命科学学院, 大同 037009; 2.山西大同大学应用生物技术研究所, 大同 037009)
恒山黄芪(Astragalusmembranaceus),属于豆科黄芪属的蒙古黄芪,主产于山西北部,尤其以北岳恒山所在的浑源县为最佳[1-2],当地也将其称为“正北芪”。恒山黄芪药用历史悠久,有“补药之长”之称,为历代中医最常用的中药之一,其化学成分主要是多糖、三萜、黄酮等,其中恒山黄芪的总黄酮含量丰富,具有增加人体的免疫力和抵抗力、保护肝脏、抗肿瘤、抗病毒、糖尿病、延缓衰老等生理活性[3-5]。
传统的黄酮类天然药物的提取方式主要是碱提酸沉法和乙醇提取法[6-7]。但传统方式有着提取率低、成本高、资源浪费的弊端。20世纪末发展起来的新型高分子吸附剂——大孔吸附树脂,是一类不含交联基团的多孔性交联聚合物[8],具有理化性质较为稳定、不溶于酸碱或其他有机溶剂、吸附速度快、稳定性好、生产周期短、成本低等优点[9],在工业生产中具有广阔的应用前景,在许多具有重要药理作用的天然产物分离,特别是黄酮类化合物的纯化中得到了广泛的应用[10]。
目前,恒山黄芪总黄酮的研究和开发很少,对于黄芪黄酮的提取材料,中国研究主要集中于甘肃黄芪和蒙古黄芪。对于恒山黄芪总黄酮的提取没有文献报道,故在综合分析文献的基础上,经过树脂的筛选,确定LSA-10型大孔树脂作为恒山黄芪总黄酮的分离介质。在LSA-10型大孔树脂分离黄芪总黄酮的吸附动力学研究基础上,探讨LSA-10型分离恒山黄芪总黄酮的工艺,以期为规模化工业的应用奠定理论基础。
1 仪器与材料
1.1 试剂和药品
黄芪根(粉碎后试验,山西浑源万生黄芪开发有限公司),树脂XSA-5B、XDA-1、XSA-5、XSA-40、XDA-4、LSA-10、D101(国药集团化学试剂有限公司),芦丁对照品(批号:V0038-201606,都莱生物试剂公司),其余试剂(国药集团化学试剂厂,分析纯)。
1.2 仪器
T650CT型双头恒温超声波提取机(上海左乐仪器有限公司);UV1600紫外分光光度计(上海美谱达仪器有限公司);GW-D型摇床(常州市国旺仪器制造有限公司)。
2 实验方法
2.1 黄芪总黄酮的提取和浓度测定
准确称取10 g黄芪粉末,转入150 mL的三角瓶中,加入100 mL 无水乙醇,摇匀,室温下浸提10 h,然后在超声波提取机(提取功率500 W,时间30 min)中提取,重复3次操作,合并提取液,常温,5 000 r/min离心10 min,收集上清液,待用。按照文献[5]的方法,测定黄芪总黄酮浓度。
2.2 静态吸附和解吸实验
2.2.1 不同树脂的静态吸附和解吸性能测试
精确称取干燥的XSA-5B、XDA-1、XSA-5、XSA-40、XDA-4、LSA-10、D101型大孔树脂0.5 g,分别置于150 mL的三角瓶内,各加入50 mL黄酮提取液,于25 ℃下在摇床上以120 r/min振荡12 h。将吸附平衡后的树脂取出,过滤,测定吸附平衡后溶液中总黄酮的浓度,用来计算吸附量;之后再用去离子水清洗滤出的树脂,加入80%的乙醇溶液50 mL,设定温度为25 ℃,在摇床上以120 r/min振荡12 h进行解吸,过滤,得解吸液,测定解吸液中总黄酮的浓度,计算解吸量。计算公式为
(1)
(2)
(3)
式中:Qe为干树脂的吸附能力即每克干树脂吸附黄酮的质量,mg/g;Qd为每克干树脂的解吸量,mg/g;D为解吸率,%;C0为每毫升黄酮提取液的初始浓度,mg;V0为黄酮样品液的初始体积,mL;Ce为吸附平衡后黄酮的浓度,mg/mL;Cd为解吸液的浓度,mg/mL;Vd为解吸液的体积,mL;W为树脂的干质量,g。
2.2.2 所选树脂上的吸附动力学测试
将50 mL样品溶液加入到150 mL的三角瓶中(含所选大孔树脂0.5 g),在摇床上以25 ℃、120 r/min振荡,每30 min测试吸附液中总黄酮的浓度,直到达到吸附平衡,得到吸附动力学曲线。通过拟一阶和拟二阶模型[10-11]的适用性,预测黄芪总黄酮在所选树脂的吸附过程。拟一阶和拟二阶模型表达式为
(4)
(5)
式中:Qt为t时刻每单位质量吸附剂中溶质的浓度,mg/g;k1和k2为拟一阶和拟二阶速率常数。设定初始条件为t=0,Qt=0时,两个动力力学方程具有解析解,即
(6)
(7)
2.2.3 所选树脂的吸附等温线测试
将50 mL不同浓度样品溶液加入到150 mL的三角瓶中(含所选大孔树脂0.5 g),分别在15、25、35 ℃的条件下,以120 r/min在摇床上振荡12 h,检测达到平衡后的浓度,对Freundlich和Langmuir模型进行适应度评估。用这一方法来确定所选树脂对于黄芪提取物的吸附等温线。溶液中的总黄酮浓度分别设定为:0.916、1.338、2.725、3.247、4.728 mg/mL。
Langmuir方程[12]模型的数学表达式为
(8)
式(8)中:KL为Langmuir 相关系数;Qm为理论上的最大吸附能力。将Langmuir 方程转化为以Ce和Ce/Qe为横纵坐标的线性形式为
(9)
Freundlich模型[13]是一种双参数模型,广泛应用于许多不同的吸附剂/吸附体系的气相和液相吸附。
Freundlich方程模型的数学表达式为
(10)
线性形式的Freundlich方程可以表示为
(11)
式(11)中:KF为反映树脂吸附能力的Freundlich 常数;1/n为与吸附驱动力大小相关的经验常数。由截距可以得到KF的值,由斜率可以得到1/n的值,最后由lnCe和lnQe可以得到线性回归直线。
2.3 动态吸附和解吸测试
2.3.1 上样浓度的优化
前期试验表明,上样流速恒定的条件下,上样浓度与泄漏点呈现正相关,所以选择树脂柱径高比为1∶8,上样流速1 mL/min,设置 0.3、0.4、0.5、0.6、0.7、0.8 mg/mL不同上样浓度考察动态吸附,计算出不同上样浓度的吸附量和吸附率,确定最佳上样浓度;在最佳上样浓度下,测定动态泄露曲线,确定最佳上样体积。
2.3.2 上样流速的优化
前期试验表明,黄芪的黄酮提取液在LSA-10型树脂的吸附较慢,所以筛选工艺选择树脂柱径高比为1∶8,已筛选的上样浓度0.5 mg/mL,设置1、2、3、4 mL/min的流速,考察动态吸附,测定流出液的黄酮浓度,绘制吸附曲线,确定最佳的上样流速。
2.3.3 洗脱液浓度的优化
选择树脂柱径高比为1∶8,上样浓度0.5 mg/mL,上样流速2 mL/min,用30%、40%、50%、60%、70%、80%的1 BV(bed volume,床体积)的乙醇溶液进行淋洗,控制流速为1.0 BV/h。测定所得液体中黄酮的浓度,选出最佳的洗脱液浓度。
2.3.4 洗脱液流速的优化
相同的装柱和上样步骤,用60%的乙醇溶液淋洗,分别控制洗脱液流出的速度为1.5、2、3、4 BV/h,将洗脱液按照每份5 mL进行收集,记录流出的液体中黄酮的浓度,计算解吸量,确定最佳洗脱液流速。
2.3.5 洗脱液体积的优化
相同的装柱和上样步骤,用洗脱液洗脱,分段收集流出液,每份5 mL,测定流出的液体中黄酮的浓度,得出解吸量,确定最佳洗脱液体积。
3 结果与分析
3.1 芦丁标准曲线
芦丁标准曲线如图1所示,通过线性回归得到标准方程为

图1 芦丁标准曲线Fig.1 Standard curve of rutin
Y=-0.004 7+0.580 5X,R2=0.998 19。
3.2 吸附和解吸能力以及解吸率
树脂的吸附和解吸能力取决于它的三维空间立体结构,特别是取决于其平均孔隙直径、比表面积和极性。吸附和解吸的结果如图2所示。从图2中可以看出,LSA-10型树脂相比于其他树脂具有更好的吸附和解吸性能,因此选择 LSA-10型树脂作为后续实验的树脂。
3.3 LSA-10树脂的吸附动力学
接触时间是决定吸附作用的另一个重要的因素。为了评价接触时间对吸附性能的影响,得出了黄酮在 LSA-10型树脂上的吸附动力学曲线,如图3所示,LSA-10树脂吸附量在90 min左右达到平衡。因此,将吸附时间设定为90 min。“lg(Qe-Qt)与t”和“t/Qt与t”的关系曲线如图3(a)和图3(b)所示。从这些曲线的斜率计算出k1和k2的值。可以得出以下方程:
拟一阶方程:lg(Qe-Qt)=-0.000 9t+1.32;
拟一阶和拟二阶动力学模型的相关系数(R2)分别为0.96和0.985[图3(a)和图3(b)]。因此,用拟二阶动力学模型偏差较小,适合用于解释黄酮在 LSA-10型树脂的吸附情况。

图3 黄酮在LSA-10型树脂上的吸附动力学曲线Fig.3 Adsorption kinetic curve of flavonoids on LSA-10 resin
3.4 吸附等温线
为了研究总黄酮在LSA-10型树脂上的吸附能力,并且表征其吸附行为,提取了不同浓度总黄酮(0.916、1.338、2.725、3.247、4.728 mg/mL)的溶液,用LSA-10型树脂分别在15、25、35 ℃ 下振荡,达到吸附平衡。可以得到等温线如图4(a)所示。从图4(a)可知:在研究温度范围内,相同的初始浓度条件下,25 ℃时吸附能力最好,因此,选择最适合工业化生产的温度25 ℃。图4(b)和图4(c)所示为基于Langmuir和Freundlich模型对总黄酮的实验结果的模拟拟合的结果。
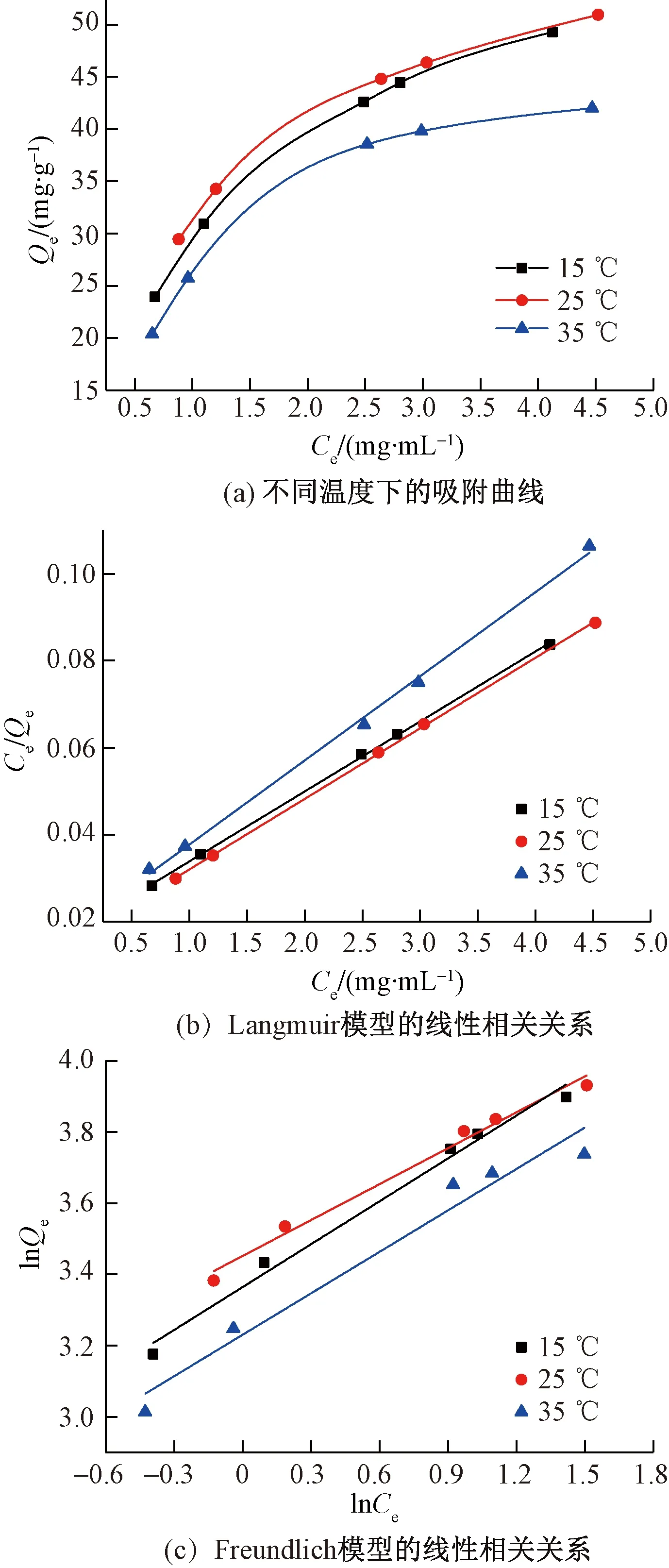
图4 在15、25、35 ℃ 下LSA-10型树脂对于总黄酮的吸附等温线Fig.4 Adsorption isotherms on LSA-10 resin at 15, 25, 35 ℃ for total flavonoids
温度不同时,Langmuir和Freundlich方程的参数如表1和表2所示。LSA-10型树脂上总黄酮的Langmuir和Freundlich方程的相关系数(R2)分别0.99和0.95。高相关系数表明,Langmuir等温吸附方程模型适用于描述所研究浓度范围内被测吸附体系。

表1 在不同温度下LSA-10树脂上总黄酮的Langmuir参数Table 1 Langmuir parameters of LSA-10 resin at different temperatures
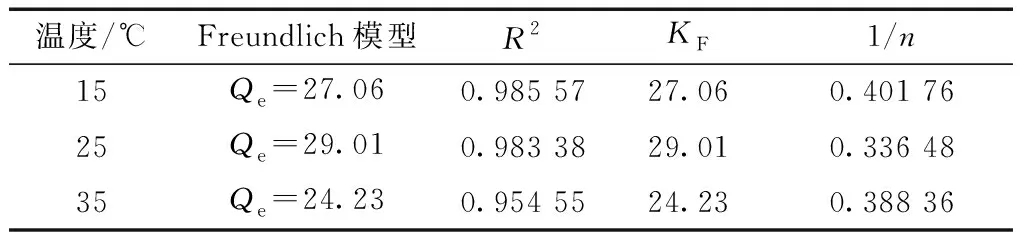
表2 在不同温度下LSA-10树脂上总黄酮的Freundlich参数Table 2 Freundlich parameters of LSA-10 resin at different temperatures
3.5 上样液浓度的确定
由图5可以看出,上样浓度越高,吸附力越低,吸附量越高。当上样浓度小于等于0.5 mg/mL时,吸附率高于80%,满足吸附要求,同时考虑到上样液浓度为 0.5 mg/mL时吸附量较大,因此,选择上样浓度为0.5 mg/mL。由图6可知,随着黄芪提取液上样体积的增加,流出液中的总黄酮的浓度也在不断增加,吸附率会逐渐降低,当流出液收集至4 BV时,洗脱液中黄酮的浓度迅速增加,表明此时已经达到泄漏点(流出液中黄酮浓度占上样液中黄酮浓度的百分比为泄漏率,当泄漏率为10%时即为泄漏点),因此,选择上样体积为4 BV。

图5 不同上样浓度对黄酮吸附率及吸附量的影响Fig.5 Effect of sample solution concentration on adsorption rate and total adsorption amount
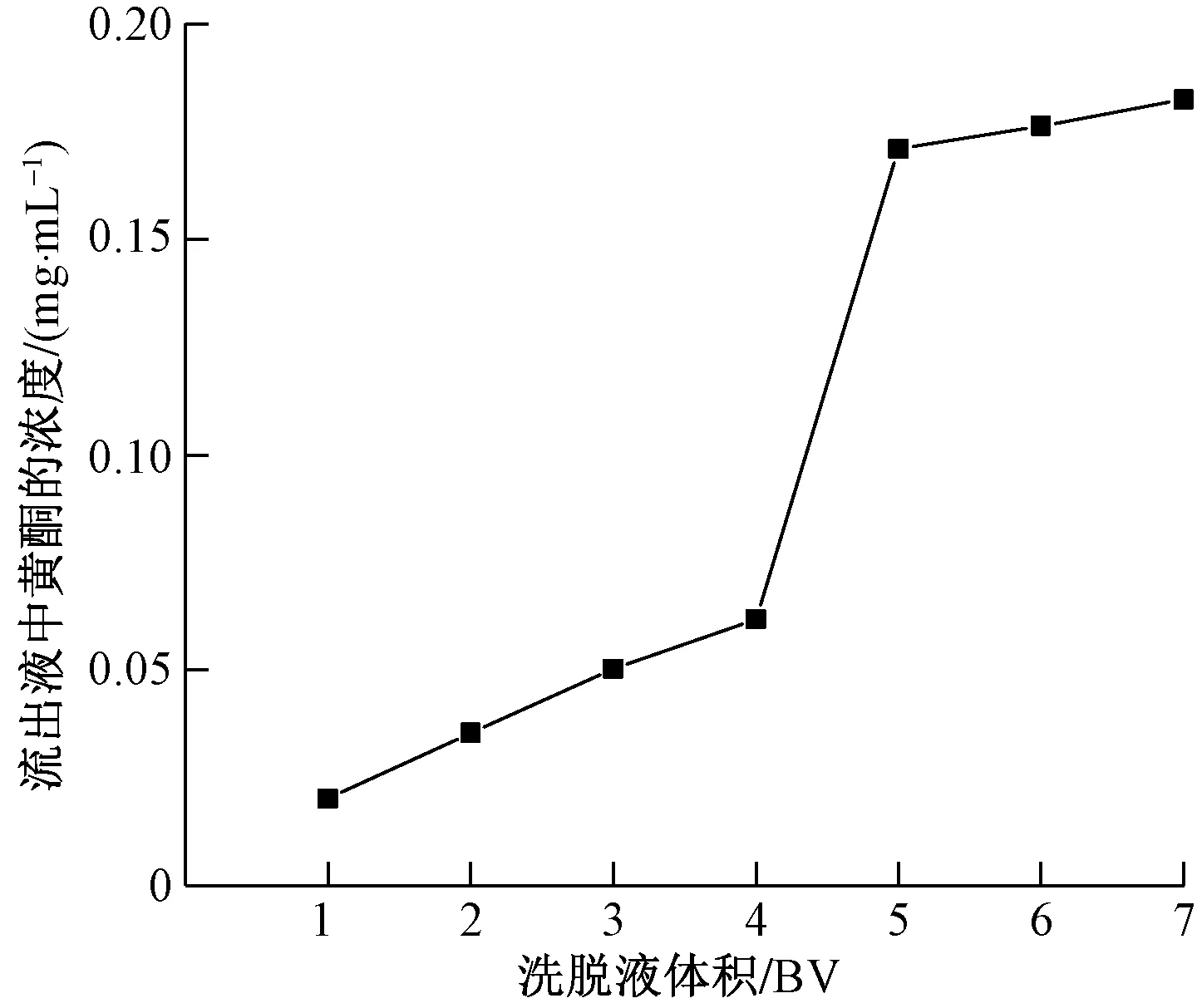
图6 上样浓度0.5 mg/mL时,黄芪总黄酮在LSA-10型树脂上的动态泄露曲线Fig.6 Dynamic leakage curve of total flavones of astragalus on LSA-10 resin at the loading concentration of 0.5 mg/mL
3.6 上样流速的确定
当上样流速为1、2、3 mL/min时,泄漏点出现较晚,上柱体积分别为5、4、5 BV;而流速为4 mL/min时泄漏点出现较早,在2 BV(图7)。上样流速越快,泄漏点出现越早,原因可能是流速加快,溶质分子未及扩散到树脂表面,就被流走,没有完全进行吸附;而上样流速越小,黄酮分子就有足够的时间进行扩散和吸附,有利于吸附,但流速也不宜过慢,导致吸附周期延长,效率低,不利于实际生产。因而,确定后续实验上样流速为3 mL/min。

图7 不同上样流速时树脂的动态吸附曲线Fig.7 Dynamic adsorption curve for different absorption flow rate of resin
3.7 洗脱液浓度的确定
当乙醇浓度达到80%时,流出液中总黄酮浓度明显减少。因此,选择乙醇浓度30%~80%的乙醇洗脱液进行常规优化,结果如图8(a)所示。在乙醇浓度达到60%之前,洗脱能力有所提高;60%之后洗脱能力下降,因此在后续的实验中以60%的乙醇水溶液作为洗脱剂。
3.8 洗脱液体积的确定
如图8(b)所示,随着洗脱液的用量增加,洗脱液中黄酮浓度提升,当洗脱液的消耗量达到7 BV时,洗脱液中黄酮浓度达到最大值,洗脱液的消耗量达到9 BV时,洗脱液中黄酮浓度锐减,因此为节约时间以及成本,选用8 BV洗脱剂来进行洗脱。
3.9 洗脱流速的确定
为了有效地从树脂中解吸出黄酮,一个合适的流速是十分必要的。从图8(c)中可以看出,当洗脱剂流速在2 BV/h时,洗脱液中总黄酮的解吸率较高,并且从工艺过程上来看更加经济有效率。因此选择洗脱流速为2 BV/h较为合适。

图8 不同因素对LSA-10树脂洗脱能力的影响Fig.8 Effect of different factors on elution capacity of LSA-10 resin
3.10 验证实验结果
经过三次验证实验,发现纯化后总黄酮的纯度提高到49.4 %。
4 讨论
LSA-10大孔树脂在天然药物成分提取中的应用研究相对较少,主要集中在多糖和黄酮方面。Dong等[14]报道了LSA-10型大孔树脂对芹菜素的吸附性能;韩凤波等[15]对比分析了LSA-10型和LX-20B型大孔吸附树脂纯化玉竹多糖工艺;董文宾等[16]研究了LSA-10型树脂纯化大豆异黄酮工艺条件;雷雪等[17]以金丝桃素为指标,研究了LSA-10型大孔树脂纯化贯叶连翘提取物的工艺。本文研究发现,LSA-10型大孔树脂对黄芪总黄酮也有很好的吸附作用,扩展了LSA-10型大孔树脂在天然药物成分提取中的应用范围。
5 结论
(1)通过静态吸附和解吸测试,优选了树脂类型,确定了LSA-10型树脂对于黄芪中总黄酮有着最佳的吸附特性。
(2)LSA-10型大孔吸附树脂对黄芪中总黄酮分离的最佳条件是:黄芪提取液的上样浓度0.5 mg/mL,上样体积4 BV,上样流速3 mL/min,以8 BV、60%乙醇以2 BV/h的速度进行洗脱。应用此工艺纯化黄芪总黄酮,发现其纯度提高到49.4%,解吸率达95.7%,LSA-10型大孔吸附树脂适合用于黄芪总黄酮的富集分离。优化了上样量、上样流速、洗脱剂浓度、洗脱剂流速、洗脱剂用量等参数,大大提高了提取液中总黄酮的浓度。该方法具备低毒、低成本、高效、操作简单等优点,将有助于解决黄芪中总黄酮的纯化问题。

