超声波辅助提取黄精多糖工艺优化及抗氧化活性研究
董 琪, 李 娜, 刘 露, 胡万祥, 鲍 伟, 王梦雪, 杜伟健
(1.亳州学院 生物与食品工程系,安徽 亳州 236800;2. 药食同源功能食品亳州市重点实验室,安徽 亳州 236800)
黄精在我国已有两千余年药用历史,是一种药食同源的植物,黄精植物资源丰富,品种繁多,具有广阔的开发应用前景。药理实验表明黄精具有降血压、降血糖、抗菌、抗衰老等作用。黄精中含量最多的主要成分是糖类,经鉴定这些糖类主要包括多糖、低聚糖和单糖等,其中黄精多糖是黄精中重要的活性成分之一。
目前,针对黄精多糖的研究主要集中在不同地域、品种、生长年龄、部位等黄精多糖含量的测定,药理作用和营养价值的研究以及多糖提取、纯化工艺的优化和抗氧化活性研究。多糖提取的方法较多,常用的方法有水浸提法、醇析分离法、酸碱提取法、微波辅助和超声波辅助提取等。黄精多糖提取率的高低与黄精品种、质量、产地和提取方法等有较大关系,与传统热水提取方法相比,超声辅助提取法可一定程度节省提取时间,简化提取流程,提高黄精多糖提取率。因此,本研究结合超声波辅助法,分别采用单因素实验和正交实验设计,对黄精多糖提取取工艺进行了优化,以维生素 C 作为阳性对照,对黄精多糖的抗氧化活性进行研究,为黄精多糖的进一步开发和利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
黄精,产自安徽霍山,购于亳州康美中药材交易市场。葡萄糖、苯酚、浓硫酸购于天津市致远化学试剂有限公司;DPPH(Sigma公司);HO(Aladdin公司);FeSO、邻苯三酚、无水乙醇、乙醚、氢氧化钠、Tris-HCl缓冲液购于国药集团化学试剂有限公司,均为分析纯。
UV-752 型紫外分光光度计(上海光谱仪器厂);UC-250DE超声波清洗器(上海精其仪器有限公司);高速万能粉碎机(天津索斯特仪器有限公司);ME204E电子分析天平(梅特勒);GZX-9240MBE电热鼓风干燥箱(上海博讯);L600高速台式离心机(湖南湘仪实验室仪器开发有限公司);HH-3A单列单控三孔水浴锅(常州国宇仪器制造有限公司);WB400US数控超声波清洗器(上海王标仪器有限公司)。
1.2 实验方法
1.2.1 样品制备
黄精→筛选→清洗→低温干燥→粉碎→黄精粉末→过筛→脱脂→保存备用。
1.2.2 多糖含量的测定
1.2.2.1 葡萄糖标准曲线制备 以葡萄糖为标样,采用硫酸-苯酚比色法测定黄精多糖,参照蔡兴航等的方法。精确称取在105 ℃烘至恒重的葡萄糖样品25 mg,定容至250 mL。分别取梯度体积的葡萄糖溶液(0、0.2、0.4、0.6、0.8、0.10 mL)于具塞试管中,依次分别加入适量蒸馏水至2 mL,随后加入5%苯酚1 mL和3 mL浓硫酸,震荡,反应30 min。每样平行3次。在紫外可见分光分光度计490 nm处测吸光度值。以葡萄糖浓度(mg/mL)为横坐标(X),以吸光度值为纵坐标(Y),绘图,结果如图1所示。得到标准曲线得回归方程为 y=1.134 4x+0.010 5,R
=0.997 9,线性关系良好,可用于黄精多糖的测定。
图1 葡萄糖标准曲线
1.2.2.2 黄精多糖提取流程 称取黄精样品5 g于烧杯中,加入一定比例的蒸馏水,放置在超声波清洗器中,调节相应温度,提取一定时间,将提取液过滤,转移至容量瓶中,定容备用。用苯酚-硫酸法测定吸光度,结合葡萄糖标准曲线,计算多糖得率。
1.2.3 黄精多糖提取优化试验
1.2.3.1 单因素试验 超声功率对黄精多糖提取率的影响:为得到最佳的超声功率,最大程度的获得黄精多糖,准确称取黄精多糖5 g,料液比(g/mL)为1∶25,超声波时间为60 min,提取温度为65 ℃,考察超声波功率为120、150、180、210 W条件下黄精多糖的提取率。
超声提取温度对黄精多糖提取率的影响:为得到最佳的超声提取温度,最大程度的获得黄精多糖,准确称取黄精多糖5 g,超声功率由以上单因素实验获得,超声提取时间为60 min,料液比(g/mL)为1∶25,考察超声提取温度为50、60、70、80、90 ℃对黄精多糖提取率的影响。
料液比对黄精多糖提取率的影响:为得到最佳的料液比,最大程度的获得黄精多糖,准确称取黄精多糖5 g,超声功率和超声提取功率由以上单因素确定,超声提取时间为60 min,考察料液比(g/mL)为1∶10、1∶15 、1∶20、1∶25、1∶30对黄精多糖提取率的影响。
超声提取时间对黄精多糖提取率的影响:为得到最佳的超声提取时间,最大程度的获得黄精多糖,准确称取黄精多糖5 g,超声功率、超声提取时间和料液比由以上单因素实验获得,考察超声提取时间为20、40、60、80、100 min对黄精多糖提取率的影响。
1.2.3.2 正交试验设计 在单因素试验的基础上,选取超声功率、超声提取温度、超声提取时间、料液比4个因素,每个因素取3个水平,以黄精多糖提取率作为考察指标,进行L(3)正交试验设计(表1),得到最佳提取条件。

表1 正交试验因素水平表L9(34)
1.2.4 黄精多糖的抗氧化活性测定
1.2.4.1 黄精多糖对DPPH·清除效果的测定 参照文献[7]中DPPH·法测定抗氧化能力,略有修改。用无水乙醇配制0.15 mg/mL 的DPPH·溶液,冷暗处保存备用。取不同浓度的样品溶液1 mL,加入 DPPH·溶液1.5 mL,用无水乙醇定容到10 mL,冷暗处静置30 min,在517 nm 处的吸光度为A;以无水乙醇取代样品,同法测得的吸光度为A; 取不同样品溶液1 mL,用无水乙醇定容到10 mL,测定的吸光度为A。以相同浓度的维生素C溶液作为阳性对照,按式(1) 计算黄精多糖对DPPH·的清除率。
清除率(%)=(A
-A
+A
)/A
×100(1)
1.2.4.2 黄精多糖对·OH的清除效果的测定 ·OH 的测定方法参考文献[7]。在比色管中依次加入9.0 mmol/L的 FeSO溶液1.0 mL、9.0 mmol/L的水杨酸溶液1.0 mL和1.0 mL多糖溶液,混合后充分摇匀,再加入8.8 mmol/L 的HO溶液1.0 mL,37 ℃水浴锅下反应30 min,于510 nm处测定吸光度A。不加样液所测的吸光度为A,不加HO溶液所测的吸光度为A。通过公式(1)计算清除率并以维生素C为阳性对照。

2 结果与分析
2.1 单因素实验结果
2.1.1 超声波功率对黄精多糖提取率的影响 由图2可知,黄精多糖提取率随超声波功率的増大而逐渐提高,在超声波功率150 W时达到最大,之后,随着超声功率的增加,提取率略有下降。次现象可能因为功率增加加快了酶介导的反应,但功率过大会对酶结构产生破坏,且造成黄精多糖降解。由此选取最佳的超声波功率为150 W。

图2 超声波功率对黄精多糖提取率的影响
2.1.2 提取温度对黄精多糖提取率的影响 由图3可知,随着提取温度不断升高,黄精多糖提取率增大,在60 ℃达到最大值,当温度不断上升时,多糖提取率又呈现降低趋势。此现象与多糖稳定性有关,随着温度升高,可能引起部分黄精多糖的分解及结构的破坏,一定程度影响其生物活性。由此选取最佳的提取温度为60 ℃。
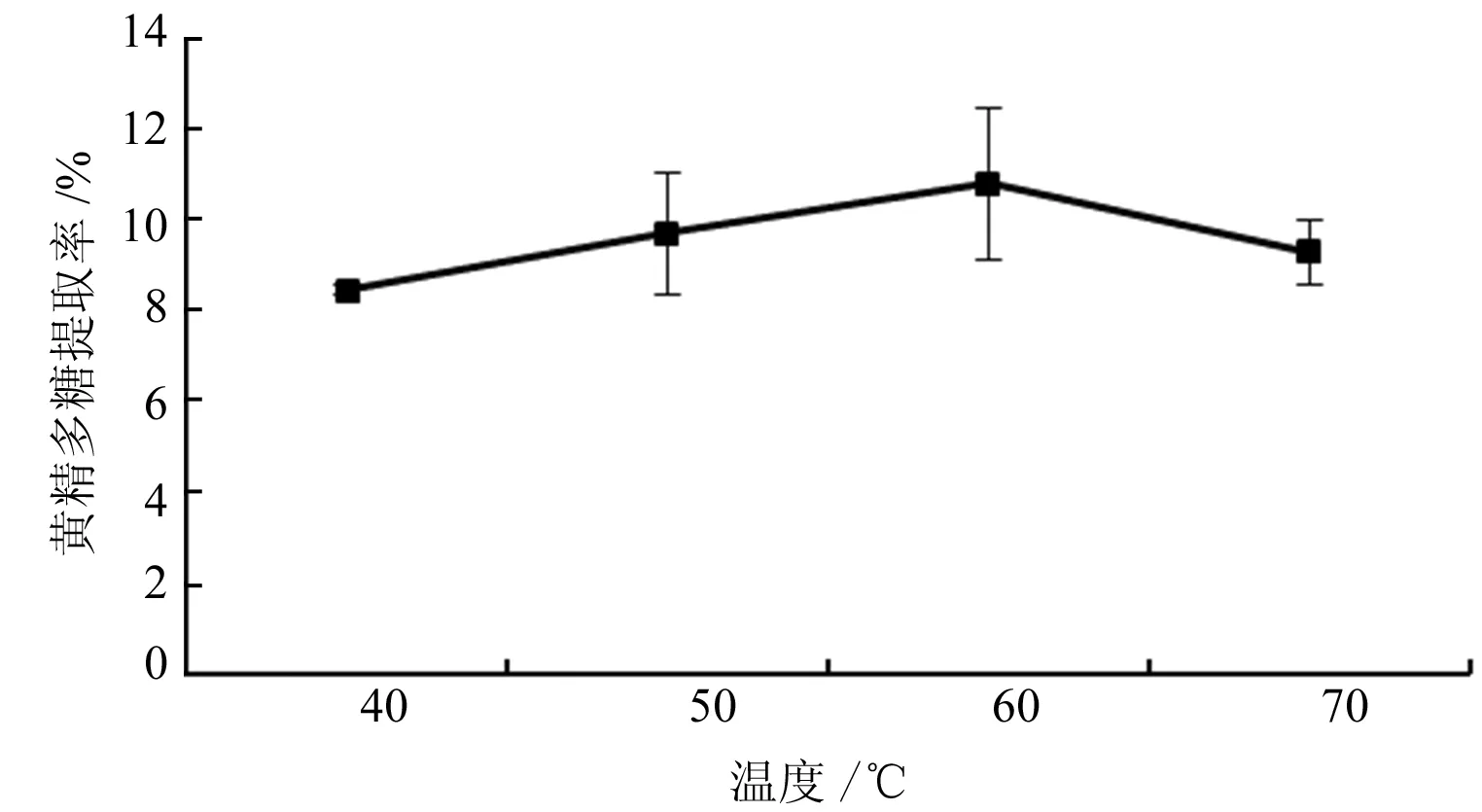
图3 提取温度对黄精多糖提取率的影响
2.1.3 料液比对黄精多糖提取率的影响 由图4可知,黄精多糖提取率随物料与溶液的比例的増大而升高,但当料液比大于1∶15时,多糖提取率变化不大。这与涂宗财等利用超声波提取荷叶多糖和刘姝霖利用超声波提取月见草叶多糖料液比结果类似。由此选取最佳的料液比为1∶15 g/mL。

图4 料液比对黄精多糖提取率的影响
2.1.4 提取时间对黄精多糖提取率的影响 黄精多糖的提取率随提取时间的延长而增加,但提取时间达到60 min后,提取时间再增加提取率略有下降。这与在40~60 min,样品中的多糖逐渐从细胞中溶出,随着时间的延长逐渐达到平衡,时间过长就会对多糖结构造成破坏,导致提取率下降。由此选取最佳的提取时间为60 min。
2.2 正交试验结果
黄精多糖提取率正交试验结果如表2所示。根据极差分析,4个参数对黄精多糖提取率的影响主效应为料液比>提取时间>提取温度>超声功率,最优组合为ABCD,即功率为180 W,温度为60 ℃,时间为70 min,料液比为1∶15 g/mL。在此条件下进行验证实验,提取率为10.48%±0.27%。

表2 正交试验结果L9(34)
2.3 黄精多糖的抗氧化活性测定结果
2.3.1 黄精多糖对DPPH·的清除率 从图5可以看出,随着黄精多糖溶液浓度的增大,其对DPPH·的清除率越来越高,但相较于维生素C对DPPH·的清除能力要小,黄精多糖清除DPPH·的IC50值为13.71 mg/mL。
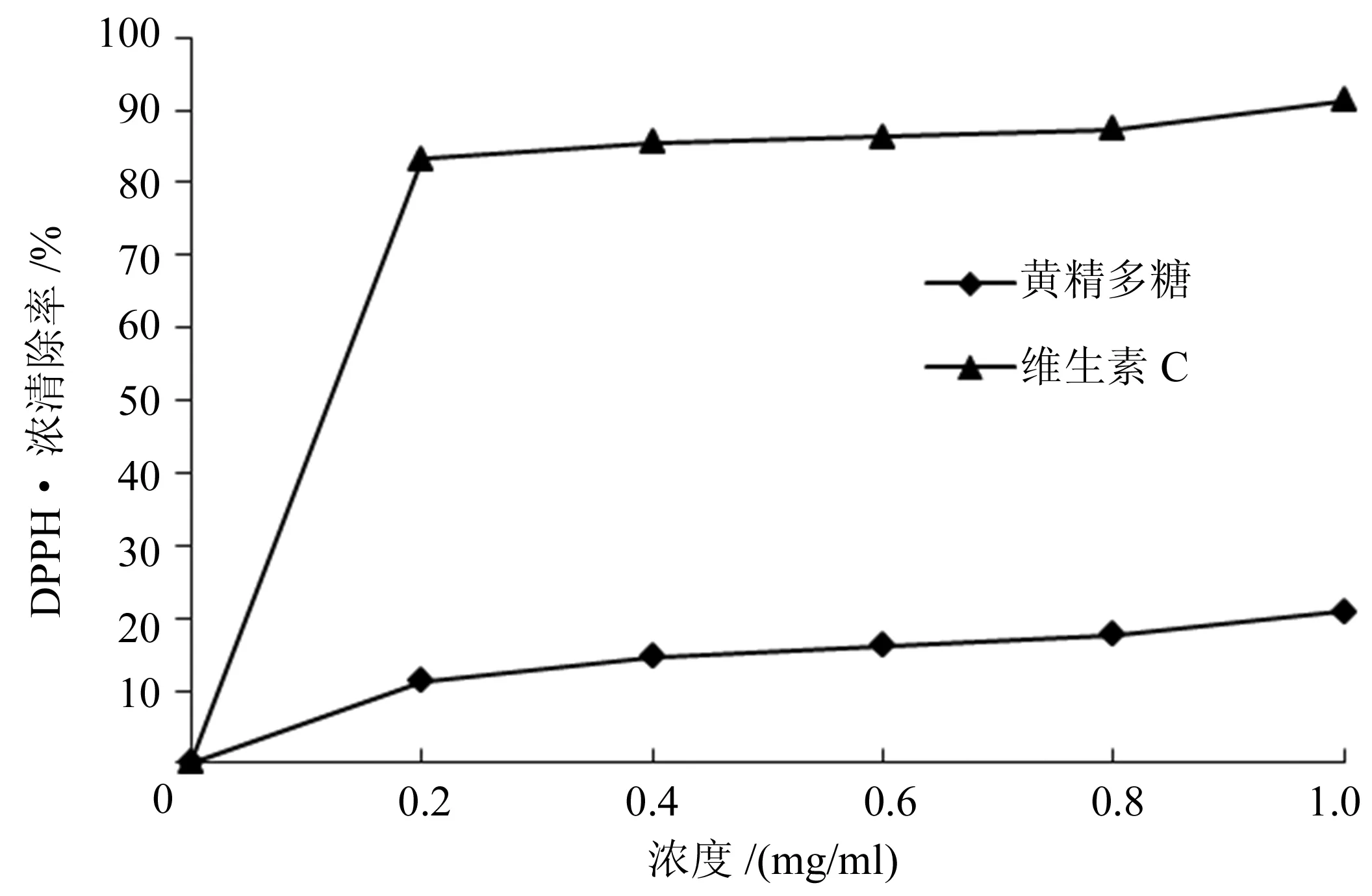
图5 黄精多糖清除DPPH·的能力
2.3.2 黄精多糖对·OH 的清除率 从图6可以看出,随着黄精多糖溶液浓度的增大,其对·OH的清除率越来越高,但相较于维生素C对·OH的清除能力要小,黄精多糖清除·OH的IC50值为10.79 mg/mL。

图6 黄精多糖清除·OH的能力

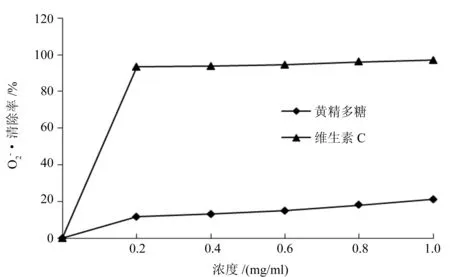
图7 黄精多糖清除的能力
3 结论
本研究通过单因素实验和正交试验设计,借助超声波辅助提取黄精多糖,得到最佳工艺条件为:超声波功率180 W,提取温度60 ℃,超声波时间70 min,料液比1∶15(g/mL)时,黄精多糖的提取率为10.48%。


