环状RNA hsa_circ_0026344对乳腺癌细胞增殖和侵袭的相关研究
党少华,徐敏,胡金月,孙永强
(郑州市第三人民医院 a.乳腺甲状腺外科;b.内分泌科,河南 郑州 450000)
乳腺癌已位居我国女性恶性肿瘤发病的首位,且其发病率呈不断上升趋势[1-2]。近年来,乳腺癌的早期诊断与治疗水平逐渐提高,在一定程度上降低了乳腺癌的病死率,但由于乳腺癌发病机制的复杂性,仍有部分患者发生复发与转移。因此,从分子层面深入探讨乳腺癌的发生机制可为乳腺癌的治疗与控制复发提供有效靶点。环状RNA(circular RNA,circRNA)是一类共价闭合的内源性非编码RNA,具有组织特异性及较高的结构稳定性,可吸收多达120个microRNA(miRNA)作为竞争性内源性RNA[3-5]。研究证实,在功能层面上,疾病相关的miRNA可以与circRNA相互作用,从而影响下游靶基因功能,在疾病的发生发展过程中起到了重要的调控作用[6-7],其中circRNA在乳腺癌发生、发展中发挥着尤为重要的作用。hsa_circ_0026344是一种新发现的circRNA,在乳腺癌细胞中的作用尚不明确。本研究通过观察hsa_circ_0026344在乳腺癌细胞中的表达及其在乳腺癌进展中的作用,揭示hsa_circ_0026344影响乳腺癌细胞生长的生物学行为,为circRNA分子靶向治疗的研究提供实验依据。
1 材料与方法
1.1 材料MDA-MB-231人乳腺癌细胞系及T47D人乳腺癌细胞系购自Sigma公司,购于中国科学院上海细胞库。18对乳腺癌组织及癌旁正常组织取自郑州市第三人民医院,乳腺癌组织和正常组织均经病理证实,其中3个Luminl A型和10个Luminl B型,3个HER-2阳性,2个三阴型。18例患者中7例患者死亡,随访时间为24~131个月,中位随访时间68个月。样本组织均先在液氮中进行处理,处理完毕后再送至-80 ℃冰箱内进行冷藏。本研究经郑州市第三人民医院医学伦理委员会批准,所有患者均签署书面知情同意书。采用杭州四季青公司的胎牛血清及RPMI-1640培养基,上海安亭科学仪器厂的Anke TDL-40B型台式离心机,美国Thermo HERAcell 240二氧化碳培养箱,Costar公司Transwell细胞培养板,武汉博士德生物工程有限公司细胞计数试剂盒(cell counting kit-8,CCK-8),美国Bio-Rad公司的电泳仪及凝胶成像分析系统,日本的KUBOTA KA-2200台式离心机,美国Thermo公司的Applied Biosystems 7500 Real-Time PCR System。
1.2 方法
1.2.1细胞培养及转染 将含有体积分数为10%胎牛血清的RPMI -1640培养基对MDA-MB-231与T47D细胞置于条件为37 ℃、体积分数为5%CO2培养箱中进行培养,待细胞汇合度达到70%时,使用LipofectamineTM2000转染MDA-MB-231与T47D细胞系,24、48 h后收获细胞。将hsa_circ_0026344过表达的编码序列转入PLCDH-cir载体(中国广州,RiboBio),并构建慢病毒载体。
1.2.2qRT-PCR检测 采用TRIzol试剂从正常人乳腺上皮细胞MCF-10A和相关乳腺癌细胞及乳腺癌组织中提取总RNA,使用酶标仪检测其浓度和纯度。将RNA反转录成为cDNA。使用美国Bio-Rad公司的ABI 7500 PCR实时荧光定量仪检测hsa_circ_0026344在乳腺癌组织和细胞中的相对表达水平。该研究所用的特异性引物购自GenePharma公司(中国上海),序列如下。以GAPDH为内参,GAPDH上游引物序列:5’-TTGCCCTCAACGACCACT-TT-3’,下游引物序列:5’-TGGTCCAGGGGTCTTACTCC-3’。hsa_circ_0026344上游引物序列:5’-CTCAGCCTCTAGCATAAGCTC-3’,下游引物序列:5’-AGGCAAGAGAATATATTTGAAC-3’。首先以cDNA为模板,95 ℃预变性3 min,然后95 ℃变性5 s,接着给予60 ℃退火30 s,72 ℃延伸30 s的条件下扩增40个循环。给每个样品设置3个复孔,采用2-△△CT法表示hsa_circ_0026344的相对表达量。实验重复3次。
1.2.3CCK-8法检测细胞增殖 在转染细胞48 h后,将各组细胞制成细胞悬液,将细胞悬液加入到96孔板中并进行培养,培养时间为24、48、72和96 h,再将10 μL的CCK- 8溶液加入每孔中,并放在培养箱内进行孵育,孵育时间为2 h,最后使用酶标仪在刻度450 nm处进行OD值的测定。
1.2.4体外迁移实验 Transwell细胞培养板购自于Costar公司,将细胞以5×104细胞/孔悬浮于0.5 mL的无血清DMEM培养液中接种内槽,外槽加入含0.5 mL的体积分数为10%胎牛血清的细胞培养液中,放置于培养箱中培养24~36 h,37 ℃、体积分数为5%CO2,清洗PBS,对结晶紫进行染色并清洗,镜检。随机选取3个视野,计数迁移到每张膜下的细胞并重复3次。
1.2.5流式细胞术检测乳腺癌细胞凋亡 取转染的各组细胞,将培养液去除后清洗3遍PBS,将100 μL细胞悬液加入5 mL离心管,再加入5 μL PI及5 μL FITC Annexin V进行混匀,放置室内避光处静置15 min后再加入400 μL 1× Binding Buffer并进行混匀,再放置室内避光处反应15 min,并采用流式细胞仪检测凋亡率。
1.3 统计学分析采用SPSS 23.0统计软件进行数据处理,各组的差异比较采用独立样本t检验,采用Kaplan-Meier法绘制生存曲线,患者生存率比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 hsa_circ_0026344在乳腺癌中呈低表达本研究对比hsa_circ_0026344在正常乳腺细胞MCF-10A及不同乳腺癌细胞系中的表达情况,结果显示hsa_circ_0026344正常乳腺细胞MCF-10A的表达水平与乳腺癌细胞株中的相对表达水平比较有明显降低,其中T47D和MDA-MB-231降低表现尤为明显(P<0.05,图1A)。
2.2 hsa_circ_0026344表达与乳腺癌患者预后关系分析本研究进一步检测hsa_circ_0026344在癌旁正常组织与乳腺癌组织中的表达水平,qRT-PCR结果显示乳腺癌组织中hsa_circ_0026344表达水平明显低于正常乳腺组织(P<0.01,图1B)。生存率分析显示,hsa_circ_0026344低表达与乳腺癌患者的预后不良呈明显相关(P<0.001,图1C)。
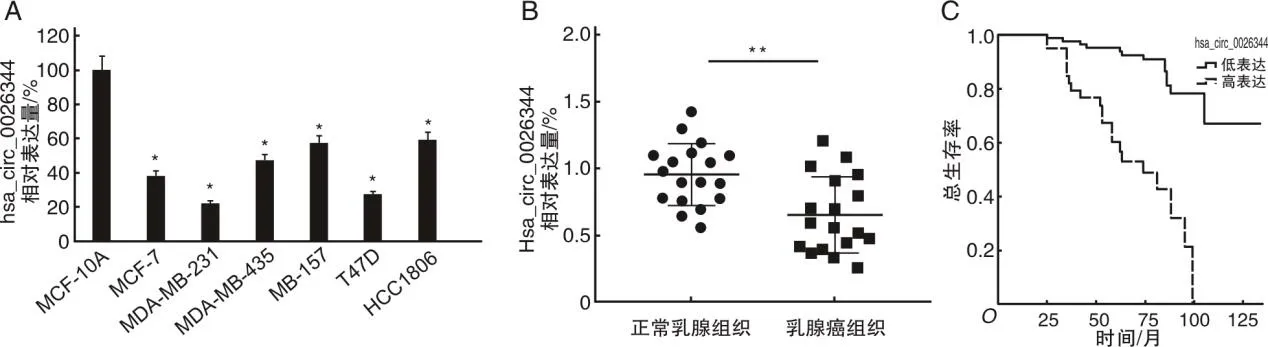
A为采用qRT-PCR检测hsa_circ_0026344在乳腺癌细胞株中的相对表达;B为hsa_circ_0026344在18对乳腺癌组织及癌旁非癌组织中的相对表达;C为Kaplan-Meier分析18例乳腺癌患者hsa_circ_0026344高、低表达的总生存曲线;*P<0.05,**P<0.01。图1 hsa_circ_0026344在乳腺癌中的表达
2.3 hsa_circ_0026344过表达抑制乳腺癌进展本研究构建hsa_circ_0026344过表达慢病毒载体,分别转染T47D与MDA-MB-231细胞。qRT-PCR检测hsa_circ_0026344在T47D与MDA-MB-231细胞中表达结果显示,过表达组中的hsa_circ_0026344表达水平与对照组相比明显升高(P<0.01,图2A)。采用CCK-8法检测hsa_circ_0026344过表达对乳腺癌细胞增殖能力的影响,结果显示,过表达组中的hsa_circ_0026344细胞增殖率与对照组相比明显降低(P<0.05,图2B)。流式细胞仪分析显示hsa_circ_0026344的过表达能够增加乳腺癌细胞的凋亡率(P<0.01,图2C)。Transwell 迁移实验检测结果显示,与基础对照组相比,过表达组hsa_circ_0026344能够使乳腺癌细胞穿膜数减少,侵袭能力明显降低(P<0.01,图2D)。
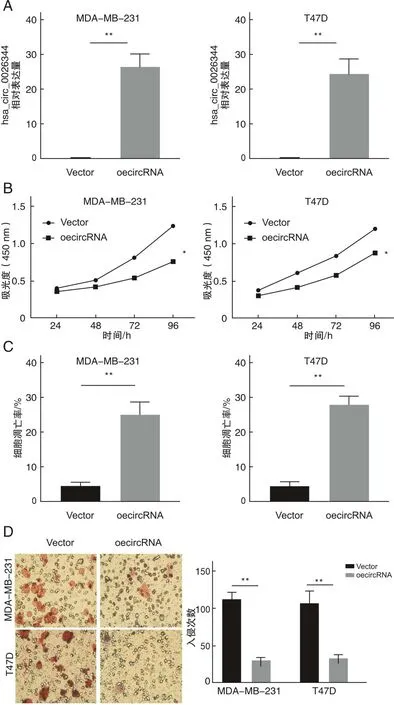
A为MDA-MB-231和T47D细胞在经过hsa_circ_0026344过表达载体转染后,hsa_circ_0026344表达明显升高;B为CCK-8检测显示,hsa_circ_0026344过表达抑制了乳腺癌细胞的增殖;C为hsa_circ_0026344过表达能够促使乳腺癌细胞凋亡;D为Transwell实验表明,hsa_circ_0026344过表达导致细胞入侵减少;*P< 0.05,**P<0.01。图2 hsa_circ_0026344过表达抑制乳腺癌细胞增殖与迁移并促进细胞凋亡
3 讨论
circRNA是一类共价闭合的内源性非编码RNA,circRNA在众多哺乳动物细胞中表达,通过高通量测序技术,目前已在人体组织中发现超过百万种circRNA。circRNA与传统线性 RNA不同,虽然仍受核酸内切酶的影响,但其对核酸外切酶介导降解存在抗性,其细胞中线性转录本更稳定[8],circRNA 主要定位于细胞核内,可参与调控转录过程,且演化拥有较强的保守性[9],提示circRNA在一些基本的生命过程中具有非常重要的作用[10]。circRNA的这些特性不仅是其在疾病生理过程中发挥作用的结构基础,也暗示其作为疾病预测和诊断的新型标志物,可能发挥重要的转录及转录后调控作用。
近年来,随着生物信息技术的不断发展与RNA-seq技术的应用,circRNA以其特异性及较好的稳定性已成为肿瘤领域靶标研究热点之一。研究显示,circRNA在多种肿瘤发生、发展中起着重要的作用[11],如乳腺癌、肝癌、肠癌、胃癌等[12-15]。随着高通量测序技术的不断发展,在乳腺癌组织中发现circRNA,且circRNA的表达存在明显差异,在正常乳腺组织中检测到的circRNA数量高于乳腺肿瘤组织。越来越多的证据表明,部分circRNA作为miRNA海绵功能参与调控肿瘤的增殖、转移和侵袭。Memczak等[16]研究发现一些circRNA可以作为天然的miRNA海绵,可以结合miRNA并抑制其活性,对于调控miRNA靶标发挥作用。有研究通过circRNA芯片筛选出乳腺癌组织中差异表达的circRNA,发现circ-ACBC10在乳腺癌组织中的表达上调,沉默circ-ACBC10 可以抑制乳腺癌细胞的增殖并促进其凋亡[17-18]。通过生物信息学预测与荧光素酶报告基因实验证实,circ-ACBC10与miRNA-1271靶向结合,且circ-ACBC10作为miRNA-1271海绵影响乳腺癌细胞的生物学行为[19]。总之,既往研究提示circRNA作为miRNA的海绵在乳腺癌发生、进展过程中发挥重要作用。本研究结果显示,hsa_circ_0026344在乳腺癌癌组织中的低表达水平之后,通过慢病毒稳定转染细胞系构建过表达hsa_circ_0026344的MDA-MB-231和T47D细胞。采用Transwell 侵袭实验及CCK-8分别检测hsa_circ_0026344过表达对乳腺癌细胞增殖和迁移能力的影响,结果表明,hsa_circ_0026344过表达检测后 MDA-MB-231与T47D的细胞增殖率均明显降低。同时,hsa_circ_0026344进行过表达检测后,MDA-MB-231与T47D细胞的凋亡率显著升高。该实验结果表明hsa_circ_0026344过表达可明显抑制乳腺癌细胞增殖与迁移,促进乳腺癌癌细胞凋亡。近期一项研究表明,hsa_circ_0026344在结肠癌中的表达较正常组织下降5倍[19],该结果与本研究结果相符合。
综上所述,hsa_circ_0026344在乳腺癌细胞及组织中表达降低,并与不良预后有关,hsa_circ_0026344的表达与细胞的恶性生物学行为密切相关。hsa_circ_0026344在体外的调控表明其可能是一种潜在的靶向治疗乳腺癌的方法。

