消脂方调控NF-κB炎症信号通路对高脂饮食诱导肥胖小鼠糖代谢及胰岛素抵抗的影响
孙怡婕,冯 强,张 栩,3,李 红
(1.上海中医药大学,上海 201203;2.复旦大学附属华东医院,上海 200040;3.复旦大学中西医结合研究院老年医学研究所,上海 200040;4.上海中医药大学附属龙华医院,上海 200032)
肥胖的发生往往由于能量摄入大于消耗导致,是一种代谢障碍状态,受到生活状态、环境、遗传等因素的共同影响。越来越多的研究指出肥胖是一种慢性、低度炎症状态。既往观点认为体内脂肪只是储存器官,贮存脂肪以提供能量,调节脂肪酸动态平衡;现代研究认为脂肪组织还具有多种生物功能,包括分泌多种激素、细胞因子和趋化因子等,参与整个机体的代谢、炎症、能量平衡及免疫调节,以维持机体内环境的稳定[1-3]。在肥胖状态下,巨噬细胞、炎症因子等在代谢器官中介导炎症,影响脂质代谢和胰岛素受体信号,降低胰岛素敏感性,触发胰岛素抵抗,进一步减慢脂肪组织中的脂肪分解和肝脏中的糖异生[4]。李红教授在上海市名老中医徐蓉娟教授学术思想的基础上,结合临床经验总结自拟消脂方治疗单纯性肥胖,临床应用疗效显著。本实验基于NF-κB炎症信号通路,探讨了消脂方对高脂饮食诱导肥胖小鼠糖代谢、胰岛素抵抗的影响,以为该方的应用提供实验依据。
1 实验材料与方法
1.1仪器与试剂
1.1.1主要仪器 赛多利斯电子天平,月旭科技(上海)股份有限公司。Spectra Max iD3多功能酶标仪,Molecular Devices Corporation产品(美国美谷仪器)。Mix Max震荡混匀仪,合肥艾本森科学仪器有限公司。ML31生物显微镜,MSX2显微镜数字相机,明美光学。Bio-Rad电泳装置,垂直平板电泳槽,凝胶图像分析系统,美国Bio-Rad。生物分光光度计,德国Eppendorf。-80 ℃超低温冰箱,美国Thermo。-20 ℃低温冰箱,中国海尔。One touch Ultra血糖仪,美国强生。
1.1.2主要试剂 Western细胞裂解液及转膜液、BCA蛋白浓度测定试剂盒、SDS-PAGE蛋白缓冲液,碧云天生物科技有限公司。白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)ELISA试剂盒 96T,上海古朵生物科技有限公司。重组人胰岛素注射液,Lily France。血糖试纸,美国强生。葡萄糖,Sigma。核因子-κB抑制蛋白-α(IKBα)抗体、p65抗体、p-IKBα抗体、p-p65抗体、β-actin抗体,CST美国。
1.2动物及饲料
1.2.1动物 C57BL/6J雄性小鼠,体质量13~15 g,购于上海市西普尔-必凯生物动物有限公司,实验动物生产许可证:SCXK(沪)2018-0006。小鼠饲养于上海中医药大学动物房,动物饲养条件:SPF级屏障环境,室温20~24 ℃,湿度50%~70%,标准小鼠笼饲养,5只/笼,12 h明暗交替,自由饮水。根据组别差异定量摄取普通固体饲料或高脂肪饲料,依据实验动物伦理学规定进行动物实验。
1.2.2饲料 小鼠高脂饲料购自Ready Bite公司,货号:D12492。普通饲料购自南通特洛菲饲料科技有限公司,货号:LAD3001M。
1.3药物及给药剂量 消脂方组成:仙灵脾15 g、柴胡9 g、大黄6 g、枳实15 g、黄芩9 g、半夏9 g、白芍9 g、决明子15 g、荷叶15 g、知母15 g、绞股蓝15 g、川芎9 g,成人每日生药总量141 g。参考《药理实验方法学》[5]人与动物间按体表面积换算法,成人按70 g体质量,小鼠按20 g体质量,换算系数0.002 6,计算得到0.366 6 g(生药)/20 g体质量(小鼠)。试验每日灌胃量设定为0.2 mL/10 g体质量,得到等效剂量(中剂量)给药浓度为0.366 6 g(生药)/0.4 mL=0.916 5 g(生药)/mL,高剂量为1.833 0 g/mL,低剂量为0.458 3 g/mL。生药由复旦大学附属华东医院药剂科提供,采用传统水煎法制备,按组方和比例称取药材加入饮用水浸没草药。浸泡30 min后,加热至沸并保持微沸20 min,分离煎出液,药渣依法再次煎煮合并煎出液,过滤后进一步浓缩药液,用蒸馏水配制药液浓度至高剂量浓度即1.833 g/mL,冷却后4 ℃冰箱保存。其余剂量组给药时按比例加入蒸馏水。对照药物:荷丹片,南昌济顺制药,国药准字Z20023129,批号:20180305。按照上述的生药换算比例,成人每日药量0.73 g×2×3=4.38 g,小鼠用量0.011 388 g/20 g,等效剂量给药浓度为0.028 5 g/mL。将适当体积的蒸馏水加入药物中,震荡混匀10 min,4 ℃冰箱保存。
1.4分组、造模及干预 参照文献[6-8]将C57BL/6J小鼠普通饲料适应性喂养7 d,依据体质量随机选取6只作为正常组,从实验开始到结束均喂食普通饲料;其余小鼠采用喂食高脂饲料12周方法建立肥胖模型,造模结束后,超出正常小鼠平均体质量的20%为诱导肥胖成功。将合格的肥胖模型小鼠按体质量随机分为模型组、消脂方低剂量组、消脂方中剂量组、消脂方高剂量组、荷丹片组,每组6只,除模型组外,其余组给予相应药物灌胃,均1次/d,持续4周。
1.5检测指标
1.5.1体质量 灌胃干预期间每周定时记录每只小鼠的体质量。
1.5.2葡萄糖耐量实验血糖值及胰岛素水平、胰岛素抵抗指数(HOMA-IR)、葡糖糖曲线下面积(AUC) 参考文献[9]方法:4周干预结束后,小鼠禁食不禁水16 h,腹腔注射葡萄糖溶液(2 g/kg,葡萄糖浓度400 mg/mL,0.1 mL/20 g),分别于0,15,30,60,120,180 min尾静脉取血,应用血糖仪测量血糖值。并分别于0,30,60 min通过眼眶采血,血浆标本在4 ℃以3 000×g转速离心20 min,取上清备用,按说明书ELISA法检测血清胰岛素水平,记录空腹胰岛素(FINS)、30 min胰岛素/空腹胰岛素比值(0.5hINS/FINS)、60 min胰岛素/空腹胰岛素比值(1hINS/FINS)。稳态模型评估HOMA-IR,HOMA-IR=空腹血糖(FPG)×FINS/22.5;记录AUC,AUC=0.25×(血糖0 min+血糖15 min)÷2+0.25×(血糖15 min+血糖30 min)÷2+0.5×(血糖30 min+血糖60 min)÷2+1×(血糖60 min+血糖120 min)÷2+1×(血糖120 min+血糖180 min)÷2。
1.5.3胰岛素耐量实验 参考文献[9]方法:葡萄糖耐量实验后24 h,小鼠禁食不禁水6 h,腹腔注射正规胰岛素0.75 IU/kg即为0 min,分别于0,15,30,60,90,120 min尾静脉取血,应用血糖仪测量血糖值。
1.5.4肝脏组织中炎症因子水平 处死各组小鼠,取肝组织,剪碎,加入预冷的PBS中配置成10%的肝组织匀浆。按ELISA法产品说明书步骤(包括稀释、加样、孵育和洗涤、加酶、显色和终止等),通过标准曲线换算得到样品浓度,测量肝脏组织中IL-1β、IL-6、IL-10、TNF-α水平。
1.5.5肝脏组织中相关蛋白表达水平 根据研究目的,除外荷丹片组,取其余组小鼠肝脏组织,按照产品说明书步骤操作(包括提取蛋白、BCA法测量总蛋白浓度、Western blot检测目的蛋白等),使用Bio-Rad Imgae Lab分析目的条带光密度值,以β-actin作为内参,并以正常组设为“1”,以此计算各组IKBα、p65、p-IKBα、p-p65蛋白表达的相对量。

2 结 果
2.1各组小鼠体质量比较 正常组、模型组、消脂方低剂量组、荷丹片组小鼠体质量在干预的4周内持续增长;消脂方中剂量组小鼠体质量在干预前3周持续增长,第3周最高,此后下降;消脂方高剂量组小鼠体质量在干预第1周持续增长,第1周最高,此后逐步下降。消脂方各剂量组和荷丹片组各时间点小鼠体质量均明显低于模型组(P均<0.05),且消脂方中、高剂量组小鼠体质量均明显低于荷丹片组(P均<0.05)。见图1。

图1 各组小鼠干预4周内体质量变化情况
2.2各组小鼠葡萄糖耐量实验血糖值比较 高脂饮食诱导下各组小鼠各时间点血糖值均明显高于正常组(P均<0.05),且血糖高峰较正常组延后。消脂方各剂量组和荷丹片组各时间点血糖值均明显低于模型组(P均<0.05),且消脂方高剂量组(除0 min外)各时间点血糖值均明显低于荷丹片组和消脂方中、低剂量组(P均<0.05),消脂方中剂量组(除30 min外)均明显低于消脂方低剂量组(P均<0.05)。见表1。

表1 各组小鼠葡萄糖耐量实验血糖值比较
2.3各组小鼠葡萄糖耐量实验胰岛素、AUC、HOMA-IR比较 高脂饮食诱导下各组小鼠FINS、AUC、HOMA-IR均明显高于正常组(P均<0.05),0.5hINS/FINS及1hINS/FINS比值均明显低于正常组(P均<0.05)。消脂方各剂量组和荷丹片组FINS、AUC、HOMA-IR均明显低于模型组(P均<0.05),0.5hINS/FINS及1hINS/FINS比值均明显高于模型组(P均<0.05),且消脂方高剂量组各指标均明显低于或高于荷丹片组和消脂方中、低剂量组(P均<0.05),消脂方中剂量组FINS、AUC、HOMA-IR均明显低于消脂方低剂量组(P均<0.05)。见表2。
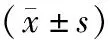
表2 各组小鼠葡萄糖耐量实验胰岛素、AUC、HOMA-IR 比较
2.4各组小鼠胰岛素耐量实验血糖比值比较 高脂饮食诱导下各组小鼠各时间点血糖比值均明显高于正常组(P均<0.05)。消脂方各剂量组和荷丹片组各时间点血糖比值均明显低于模型组(P均<0.05),且消脂方高剂量组各时间点血糖比值均明显低于荷丹片组和消脂方中、低剂量组(P均<0.05),消脂方中剂量组血糖30 min/血糖0 min、血糖60 min/血糖0 min和血糖90 min/血糖0 min比值均明显低于消脂方低剂量组(P均<0.05)。见表3。

表3 各组小鼠胰岛素耐量实验血糖比值比较
2.5各组小鼠肝脏组织中炎症因子水平比较 高脂饮食诱导下各组小鼠IL-1β、IL-6、TNF-α水平均明显高于正常组(P均<0.05),IL-10水平均明显低于正常组(P均<0.05)。与模型组比较,消脂方各剂量组和荷丹片组IL-1β、IL-6、TNF-α水平均明显降低(P均<0.05),IL-10水平均明显升高(P均<0.05);消脂方高剂量组IL-1β、IL-6、TNF-α水平均明显低于荷丹片组和消脂方中、低剂量组(P均<0.05),IL-10水平均明显高于荷丹片组和消脂方中、低剂量组(P均<0.05);消脂方中剂量组IL-6、TNF-α水平均明显低于消脂方低剂量组(P均<0.05),IL-10水平明显高于消脂方低剂量组(P<0.05)。见表4。

表4 各组小鼠肝脏组织中炎症因子水平比较
2.6各组小鼠肝组织中IKBα、p65、p-IKBα、p-p65蛋白表达水平及磷酸化比值比较 各组小鼠肝组织中IKBα、p65蛋白表达水平比较差异均无统计学意义(P均>0.05)。与正常组比较,模型组和消脂方低、中剂量组p-IKBα蛋白表达水平及p-IKBα/IKBα均明显升高(P均<0.05),模型组和消脂方低剂量组p-P65蛋白表达水平及p-p65/p65均明显升高(P均<0.05)。与模型组比较,除消脂方低剂量组p-p65蛋白及其磷酸化比值外,消脂方各剂量组p-IKBα、p-p65蛋白表达水平及两者磷酸化比值均明显降低(P均<0.05);消脂方高剂量组p-IKBα及其磷酸化比值均明显低于消脂方中、低剂量组(P均<0.05)。见表5及图2。
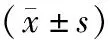
表5 各组小鼠肝脏组织中IKBα、p-IKBα、p65、p-65蛋白表达水平及磷酸化比值比较

1为正常组;2为模型组;3为消脂方低剂量组;4为消脂方中剂量组;5为消脂方高剂量组
3 讨 论
自拟消脂方是李红教授结合多年临床经验总结的治疗单纯性肥胖的验方,方中重用仙灵脾为君药,寓以补肾固元之意。柴胡、黄芩、大黄、枳实、姜半夏、白芍共为臣药,取大柴胡汤和解少阳、内泻热结之意;决明子、荷叶、绞股蓝共为佐药,行益气健脾、润肠通便之功;川芎为使药,取其活血行气之力;诸药合用,共奏补肾固元、祛痰化瘀、内泻热结之效。现代研究发现,淫羊藿总黄酮可以上调高血脂症大鼠体内过氧化物酶体增殖物激活受体的表达水平,降低血清超氧化物歧化酶、丙二醛水平,改善体内氧化应激反应[10]。常一川等[11-12]研究发现大柴胡汤的主要成分具有降脂作用,其可能通过降低TNF-α及IL-6的蛋白表达起效。卢锟刚等[13]研究报道,决明子、丹参、绞股蓝配伍具有降血脂、增强机体抗氧化能力及保肝作用。
脂肪细胞可分泌多种炎性因子,包括TNF-α、IL-6等。生理状态下,抗炎因子和促炎因子处于平衡状态,保证机体正常功能,但随着白色脂肪体积增多,TNF-α、IL-6等促炎因子被大量分泌,IL-10等抑炎因子分泌减少,平衡遭到破坏,最终形成肥胖的慢性炎症状态[14-15]。TNF-α可通过刺激脂肪细胞分解释放脂肪酸,反馈性刺激巨噬细胞,进一步释放TNF-α,由此导致代谢性炎症恶性循环,放大炎症反应;TNF-α还可通过干扰胰岛素信号通路的传导,影响能量代谢平衡,最后引发机体的胰岛素抵抗状态,降低胰岛素敏感性[16-19]。肝脏是IL-6的靶器官之一,在鼠类肝细胞及人肝癌细胞中发现IL-6通过阻断胰岛素受体信号表达来降低胰岛素活性,导致胰岛素抵抗的发生,并通过抑制胰岛素受体信号下游区片段的活性,抑制糖原合成[20]。IL-10是与肥胖相关的重要抗炎因子,可减少TNF-α对脂肪细胞造成的破坏,抑制多种细胞因子的活性,具有重要的免疫调节作用,在慢性炎症、肥胖、代谢综合征、胰岛素抵抗及2型糖尿病的并存发展过程中扮演着重要的角色[21-22]。IL-1β是目前公认的导致胰岛细胞功能破坏的炎性因子之一,肥胖人群IL-1βSNP呈高表达[23];另外长期暴露在高血糖环境下,可促进IL-1β大量表达,诱导β细胞凋亡[24]。
NF-κB是一个核转录因子,属于Rel蛋白家族,具有多种生物学活性,可调控机体及细胞内的各种生命活动,如细胞发育、分裂、分化、凋亡,器官组织形成、机体免疫应答等。在一些刺激性物质诱导激活后,NF-κB与启动基因位点特异性结合,下游基因转录,促炎因子表达合成,从而导致机体炎症和相关疾病的发生[25-26]。NF-κB所有家族成员都有着高度保守的Rel同源结构区由N端和C端结构域连接而成,其中C端结构域上的一个核定位区域负责与DNA结合、二聚体化和核易位。RelA(p65)的C端存在反式激活结构域用来激活其目标基因[27-28]。IκB 是NF-κB的抑制蛋白,其家族成员包括p100、p105、IκBα、IκBβ、IκBγ、IκBε、Bcl-3及IκB-R[29]。IκBa是NF-κB信号转导通路中起着关键作用的调控蛋白,在静息状态下,由于IκBa与p50/p65的亲和力较高,IκB通过其C末端特定的锚蛋白重复序列与NF-κB结合,形成三聚体复合物p50/p65-IκBa,掩盖p50上的核定位氨基酸序列,阻止NF-κB向细胞核内转移,p50、p65与IκB-α以失活状态存在于细胞质中,NF-κB信号通路处于抑制状态。而当炎症刺激物诱导刺激细胞激活IκB激酶(IκK),使IκB泛素化,NF-κB与IκB的结合位点暴露,磷酸化并降解IκB-α,使得p50、p65从失活状态活化,NF-κB变为游离状态,其活跃性增强,迅速从细胞质转移到细胞核内,与核内相关基因位点结合,进而启动炎症相关基因的转录和表达,诱发炎症反应[30-32]。而此时巨噬细胞NF-κB信号通路的激活,进一步诱导炎症相关细胞因子、趋化分子、炎症相关介质的表达,扩大炎症反应的规模和范围[33]。
本实验结果显示,消脂方干预后小鼠体质量、葡萄糖耐量实验血糖值、HOMA-IR、AUC、胰岛素耐量实验血糖比值均明显降低,肝组织中炎症因子及相关蛋白表达水平均有改善,提示该方药可能通过抑制NF-κB炎症信号通路,减轻炎症反应,改善血糖调节能力、B细胞分泌胰岛素功能、胰岛素抵抗,增加胰岛素敏感性。
利益冲突:所有作者均声明不存在利益冲突。

