热加工对小麦蛋白结构和消化特性的影响
(马梦瑶 谢岩黎 范亭亭 高 浦
(河南工业大学粮油食品学院1,郑州 450001)
(河南省粮油食品安全检测与控制重点实验室2,郑州 450001)
小麦蛋白也称谷朊粉,是从小麦粉中分离得到的符合现代膳食营养需求的天然蛋白质[1]。小麦蛋白富含二硫键,根据其在乙醇溶液中的溶解性可分为可溶性的单体小麦醇溶蛋白和不溶性的聚集体小麦谷蛋白,麦醇溶蛋白结构有四种类型:α、β、γ和ω型;分子形状为球形,分子量小,延展性好,弹性小[2];麦谷蛋白是由多肽链的分子间二硫键形成的大分子聚合物,主要由2种亚基组成,分别为低分子量亚基和高分子量亚基,其分子内含有较多的β-折叠结构,易发生聚集作用,分子结构呈纤维状,具有弹性,延伸性小[3]。面筋蛋白是多数烘焙产品的主要原料,有助于改善加工过程中面团的流变特性,因此,面筋蛋白在一定程度上决定了小麦粉产品的质量[4,5]。小麦蛋白由于自身独特的结构而含有大量的疏水性和不带电荷的氨基酸,具有溶解性差、不易消化的特点,在实际生产和生活应用里受到限制[6,7]。因此,研究提高面筋蛋白的溶解度,改善其功能性质,拓宽其应用范围十分重要。
物理改性是利用超高压、超声波、热处理及冷冻、超微粉碎等物理方式改变食品中蛋白质空间结构与理化特性的方法, 可以显著改善蛋白质质地、口感和营养价值, 有利于人体消化吸收,提高蛋白质的利用率。面制品在冻藏过程中, 冰晶会发生迁移和重结晶, 导致面筋蛋白变性出现风味减退等问题[8]。WANG 等[9]研究结果表明,面筋蛋白在冻藏后发生解聚现象,网状结构变得疏松,热稳定性下降。黄达维等[10]研究了超声对面筋蛋白功能性质的影响,发现了当超声时间达到20 min时,可提高面筋蛋白的起泡性和乳化性。热加工是食品加工中的主要手段,研究表明热加工可使蛋白发生降解或聚集,导致含量下降[11]。但是对蛋白进行适当的热加工可以通过增加蛋白酶的接触位点来提高其功能特性[12,13]。王晓琳等[14]发现在100 ℃条件下加热5 min时,花生蛋白的乳化稳定性达到最大值。齐宝坤等[15]研究了不同加热温度(80、90、100 ℃)对大豆11S球蛋白处理0~90 min后发现,热处理会改变大豆11S球蛋白的Zeta电位和平均粒径。陶汝清等[16]研究发现热处理会导致大豆蛋白二级结构中β-折叠含量下降、无规则卷曲结构显著增加。
目前,关于热处理对面筋蛋白结构和功能特性影响的报道较多,但缺乏对麦谷蛋白、麦醇溶蛋白单体深入的研究。本研究以麦谷蛋白、麦醇溶蛋白为原料,采用不同程度的热处理,利用激光粒度分布仪、SDS-聚丙烯酰胺凝胶电泳、扫描电子显微镜、傅里叶变换红外光谱和凯氏定氮仪研究不同热处理时间对小麦蛋白粒径、亚基、微观结构、二级结构以及消化特性的影响,以期为改善面筋蛋白的功能特性及新产品的研发提供参考。
1 材料与方法
1.1 材料与试剂
麦谷蛋白(Glu);麦醇溶蛋白(Gli);胃蛋白酶(2 940 U/mg)、胰蛋白酶(300 U/mg),其他试剂均为分析纯。
1.2 仪器与设备
ALPHA 傅里叶红外光谱仪,DL-5-B低速离心机, SU3500扫描电子显微镜,BT-9300ST激光粒度分布仪,K1100全自动凯氏定氮仪。
1.3 方法
1.3.1 样品制备
Gli样品制备:用75%的乙醇溶解适量的Gli,将形成的Gli溶液放置100 ℃的水浴锅里分别加热5、15、30 min,在干燥箱里干燥36 h后得到样品A1、A2、A3。
Glu样品制备:将适量的Glu溶于少量的NaOH中,形成的Glu溶液放置在100 ℃的水浴锅里分别加热5、15、30 min,在干燥箱里干燥36 h后得到样品 B1、B2、B3。
1.3.2 粒径测定
选用BT-9300ST激光粒度分布仪进行粒度测定,以超纯水为分散剂,设定实部折射率1.46,虚部折射率0.1。
1.3.3 SDS-聚丙烯酰胺凝胶电泳
根据Laemmli[17]报道的方法, 在不连续缓冲系统上进行SDS-PAGE分析, 分别取麦醇溶蛋白、麦谷蛋白0.01 g放入小试管中,加入1 mL的样品缓冲液,混匀后放入沸水中水浴加热5 min,冷却之后离心。电泳条件:缩胶浓度6%,分离胶浓度15%,上样量10 μL,以10 μL Maker用作分子量标记,先将电压调至80 V至样品进入分离胶后再将电压调至120 V直至电泳完成。然后将胶取出,染色,脱色,照相分析。
1.3.4 扫描电镜分析
使用SU3500扫描电子显微镜观察小麦蛋白的网络结构,取干燥后的样品平整处进行喷金处理,于2 000倍放大倍数下观察结构,加速电压为1.5 kV。
1.3.5 傅里叶变换红外光谱分析
采用傅里叶变换红外光谱仪对小麦蛋白二级结构进行表征。红外光谱采用OPUS软件进行扫描,测试参数为:分辨率:32-1;扫描次数:16次;扫描范围:4 000~400 cm-1。样品粉末与溴化钾粉末按1∶50(m/m)比例混合后,置于模具中压片后进行测试。所有样品图谱采用OPUS和Peak Fit v4.12件进行校正分析,确定各子峰与各二级结构的对应关系,计算各子峰面积的质量分数。
1.3.6 体外消化率测定
小麦蛋白体外消化率的测定采用胃-胰蛋白酶两步消化法[18],样品蛋白含量和沉淀蛋白含量的测定采用GB 5009.5—2010中的凯氏定氮法。模拟胃液:0.1 g胃蛋白酶溶于1 L浓HCl(pH=1.5);模拟肠液:0.533 g胰酶溶于1 L磷酸盐缓冲液中(pH=8)。具体方法如下:称取0.5 g样品于三角瓶中,添加15 mL模拟胃液后在恒温37 ℃振荡水浴锅中以190 r/min 转速消化3 h;用0.2 mol/L的NaOH将消化液pH调至8.0,添加7.5 mL的模拟胃液后在恒温37 ℃振荡水浴锅中消化2 h。模拟消化实验结束后立即加入10 mL 20%的TCA终止反应,离心30 min后取沉淀。体外消化率=(粗蛋白含量-沉淀蛋白含量)/粗蛋白含量×100%。
1.4 数据处理
所有实验均重复3次以上,所有数据均用Microsoft Office Excel 2003进行初步整理,使用Oringin8.5软件统计分析数据,方差分析采用Duncan多重比较法进行显著性检验(P<0.05),实验所得数据以(平均值±标准差)表示。
2 结果与分析
2.1 热处理对小麦蛋白粒径的影响
由图1可知,随着加热时间的延长,麦醇溶蛋白与麦谷蛋白的平均粒径在加热30 min时分别达到了254.3、237.4 μm,可能是热处理导致蛋白质分子发生聚集,表明较高温度的热处理利于大尺寸聚集体的形成。粒径的D10、D50、D90值可以更加清晰直观地了解蛋白粒径的分布情况,D10为累积分布百分比达到10%时的粒径值;D50为累积分布百分比达到50%时的粒径值,也称为中粒径;D90表示累积分布百分比达到90%粒径值时对应的粒径。由表1可以看到,随着热处理时间的增加,麦醇溶蛋白的D10逐渐减小,在热处理30 min后麦醇溶蛋白中粒径小于15.64 μm 的颗粒只占总颗粒的10%;继续观察D50值,发现在加热处理30 min后麦醇溶蛋白和麦谷蛋白的中粒径显著升高,表明在加热过程蛋白的粒径发生了明显的变化,且D50处在130~220 μm之间,说明蛋白粒度组成中中粒径占的颗粒多为大蛋白颗,也说明颗粒粒径逐渐增大;麦醇溶蛋白与麦谷蛋白的D90值在未加热时分别达到了288.9、210.4 μm,可能是由于蛋白样品中本来就含有大颗粒物质,可以看到随着热处理时

表1 不同热处理后小麦蛋白的粒径值

注:A0~A3分别为麦醇溶蛋白热处理0、5、15、30 min;B0~B3分别为麦谷蛋白热处理0、5、15、30 min,下同。
间的增加,麦醇溶蛋白与麦谷蛋白的D90表现出大幅度的增长,蛋白颗粒的粒径的分布也逐渐向大颗粒靠近,说明热处理时间的延长会加速蛋白质分子的运动,强化蛋白质相互间的碰撞几率,增强蛋白质分子聚集现象[19]。
2.2 热处理过对小麦蛋白的SDS-PAGE分析
图2为麦醇溶蛋白与麦谷蛋白空白组和加热处理后的SDS-PAGE图。麦醇溶蛋白的相对分子质量在3×104~8×104u之间,形成的为球状单体蛋白质;麦谷蛋白是一种可溶性的多肽链蛋白质,各肽链之间通过二硫键连接,相对分子质量在105~107u之间,形成的是高分子聚合物。在SDS电泳系统中,HMW-GS(高分子量麦谷蛋白亚基)在凝胶板的上部,LMW-GS(低分子量麦谷蛋白亚基)处在中部,麦醇溶蛋白在下部[20]。从第一泳道可以明显看到在分子量75~135 ku内有三条很清晰的条带,属于高分子量麦谷蛋白亚基,分子量大且迁移速率慢;观察麦醇溶蛋白的第5~8泳道可以看到,25~48 ku之间的图谱颜色比较深,含量较多,分子量小迁移速率快。与空白组小麦蛋白相比,麦醇溶蛋白与麦谷蛋白在经过不同时间的热处理后,其电泳泳带数目和相对迁移率都没有发生显著的变化,说明小麦蛋白亚基没有发生变化。在整个加热过程中,小麦蛋白的亚基不会随着加热时间的延长而产生明显变化。范鹏辉等[21]研究冻藏时间对面筋蛋白亚基的影响,发现麦谷蛋白和麦醇溶蛋白亚基分子量大小和分布均未发生明显变化。

注:1~8泳道分别为B0、B1、B2、B3、A0、A1、A2、A3。
2.3 热处理对小麦蛋白微观结构的影响
通过扫描电子显微镜观察小麦蛋白的网状结构是了解蛋白结构变化的关键[22]。图3为不同加热时间下麦醇溶蛋白与麦谷蛋白的微观结构图。可以看出,麦谷蛋白比较均匀,表面光滑,呈现规则的纹路;而醇溶蛋白表面较凹凸不平,纹路不规则。100 ℃5 min的麦谷蛋白与麦醇溶蛋白微观结构与对照组相比有一些差异,蛋白结构出现少量破裂,完整性降低,继续延长加热时间,会发现麦谷蛋白和麦醇溶蛋白结构出现严重断裂,已不能形成连续的网状结构。可能是较高的温度处理造成小麦蛋白表面张力变大,形成凹陷甚至破裂的不规则表面,这说明热处理会破坏小麦蛋白完整的网状结构,并且随着热处理时间的增长,小麦面筋蛋白的结构会被进一步破坏[23]。

图3 热处理后小麦蛋白的微观结构图
2.4 傅里叶红外光谱分析
图4是麦醇溶蛋白与麦谷蛋白样品经过傅立叶去卷积处理和peakfit曲线拟合的酰胺Ⅰ带(1 600~1 700 cm-1)图谱,蛋白质的酰胺I带(1 700~1 600 cm-1)是蛋白质结构特有的峰形[24]。各二级结构所占比例如表2所示,麦醇溶蛋白与麦谷蛋白的二级结构以β-折叠为主,随着100 ℃热处理时间的延长,β-折叠含量增大,加热30 min后含量增加到35.95%、33.21%;而α-螺旋结构的质量分数逐渐减小;β-转角由未加热的26.92%、28.12%下降到19.67%、17.63%;在热处理30 min后,麦醇溶蛋白与麦谷蛋白的无规则卷曲结构的质量分数分别由21.80%、21.56%达到了29.78%、29.76%;说明在加热过程中α-螺旋、β-转角向β-折叠、无规则卷曲结构转变。这应该是由于小麦蛋白在加热过程中,存在于蛋白质分子相邻肽键间的氢键被破坏,维持α-螺旋的氢键断裂,发生解螺旋,α-螺旋结构的质量分数减小;一部分α-螺旋结构展开,蛋白质结构由有序趋向于无序,无规则卷曲结构的质量分数增加;另一部分α-螺旋结构在分子间相互作用下转换为β-折叠结构,β-折叠结构存在于蛋白质内部折叠区域,通常造成β-折叠结构质量分数的增加,从而改变了蛋白质的二级结构,使蛋白质结构变得疏松不紧密[25]。
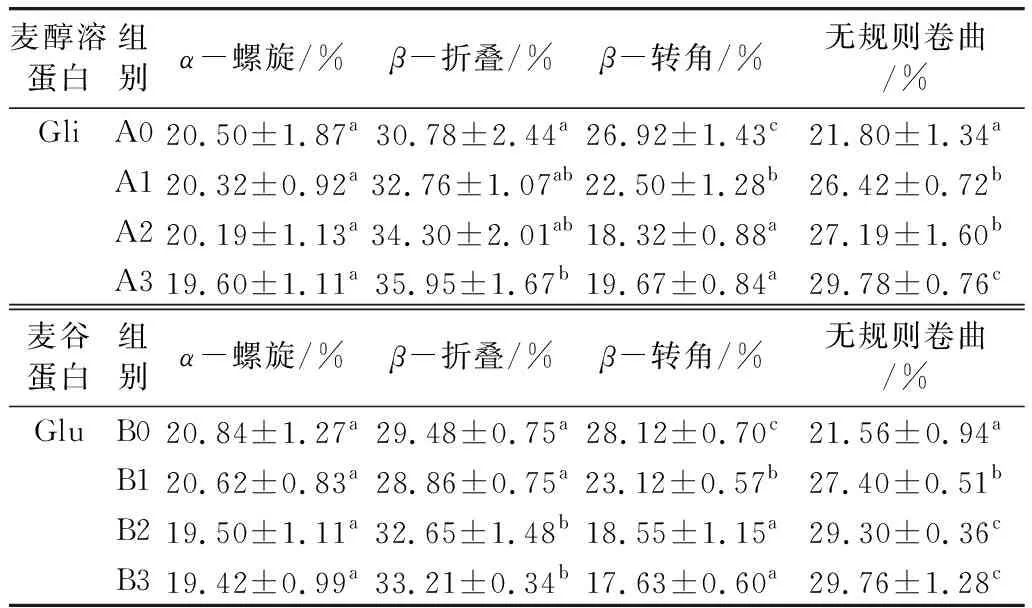
表2 热处理对小麦蛋白二级结构的影响
2.5 热处理对小麦蛋白体外消化率的影响
蛋白质在经过热处理后,会改变其结构和功能性质,导致消化特性发生改变。由图4可见,经过100 ℃的加热处理后,麦谷蛋白和麦醇溶蛋白的消化率均有增加;且小麦蛋白在热处理时间小于5 min时其体外消化率变化不大;但当热处理超过5 min时,小麦蛋白的体外消化率与热处理时间成正比。热处理破坏了蛋白质的二级结构增加其消化性[26],因为加热会导致蛋白质的疏水键、氢键、二硫键、范德华力等发生断裂重排,而这些键的断裂重排在一定程度上有利于蛋白消化,此过程需要一定的作用时间,时间越长,作用力越大。
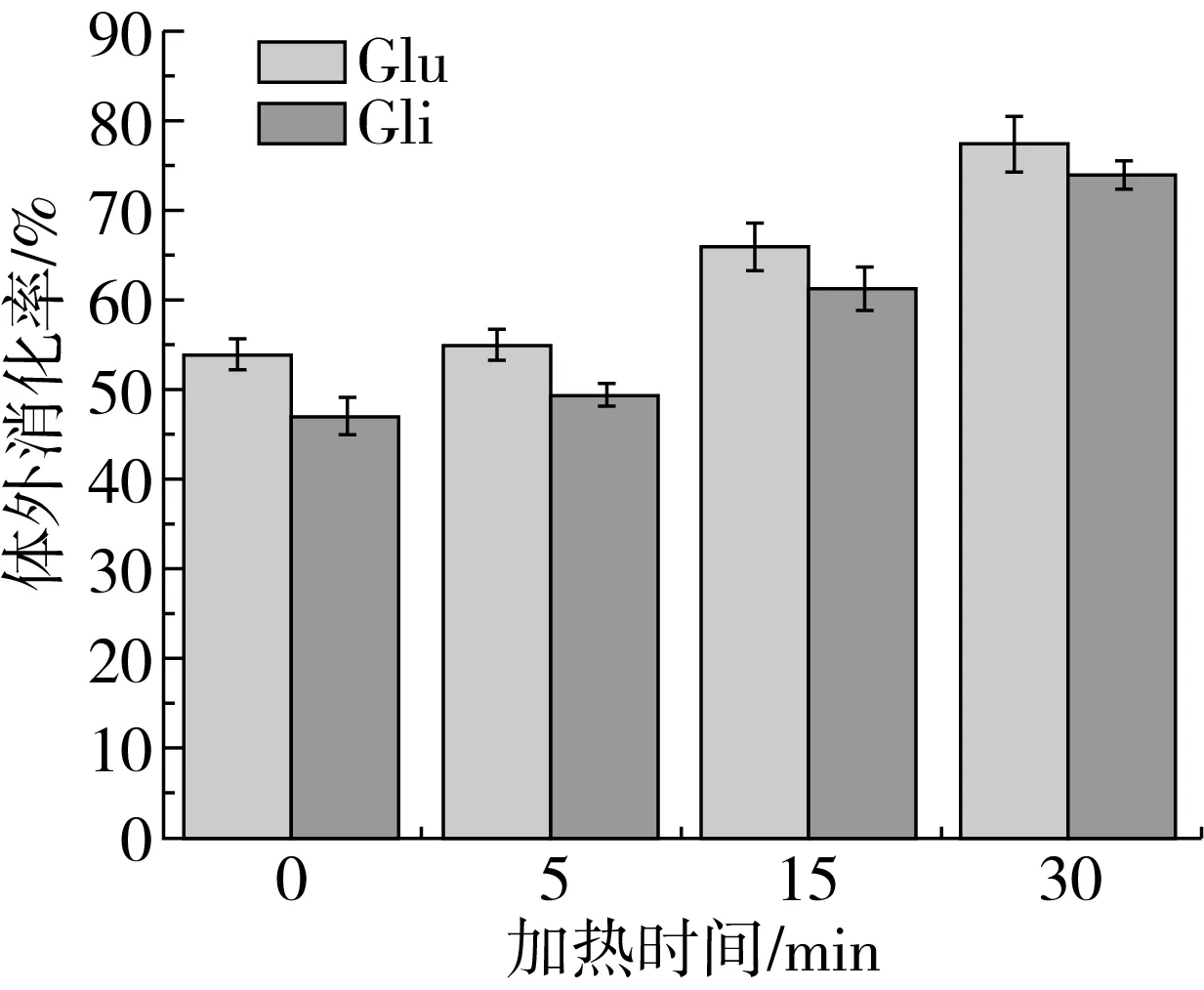
图4 热处理对小麦蛋白体外消化率的影响
3 结论
研究热处理对麦醇溶蛋白和麦谷蛋白结构特征和消化特性的影响,结果表明:小麦蛋白颗粒受热发生聚集,导致蛋白分子粒径逐渐向大颗粒转变;小麦蛋白在整个加热过程中并不会因为受热导致亚基含量发生变化;随着热处理时间的延长,小麦蛋白的微观结构从连续网状向破裂无规则状态转换;热处理会改变小麦蛋白的结构,麦醇溶蛋白与麦谷蛋白都表现为α-螺旋、β-转角质量分数减小,而β-折叠、无规则卷曲结构质量分数增加;100 ℃的热处理有利于小麦蛋白的消化吸收,且消化率与热处理时间呈正比。

