高纯铁的研发进展及展望
黄龙超,刘南君,王章洁,郑 芮,刘博宇,王文斌,单智伟
(1. 西安交通大学 金属材料强度国家重点实验室,陕西 西安 710049)(2. 陕西斯瑞新材料股份有限公司,陕西 西安 710077)
1 前 言
几个世纪以来,铁一直是应用在人类各个活动领域中最重要的元素之一。近年来,高纯铁的制备成为世界范围内的研究热点与前沿[1, 2]。究其原因,一方面,为了进一步改善钢铁的性能以及开发新型的高性能铁基合金,需要准确了解纯铁中添加元素的作用以及添加元素之间的相互作用,而其中最重要的一个前提是获得尽可能高纯度的铁母体[3, 4];另一方面,随着现代科学技术的进步,众多核心产业,如航空航天、电子信息、军事工业等对关键零部件及装备的性能要求逐渐提高,进而对包括铁在内的金属原材料质量控制的要求越来越严格,而对金属材料的深度除杂是进一步提升质量控制的有效手段之一。
铁的纯度通常用N和数字(N是英文数字nine的首字母)来表示,如3N5表示纯度为99.95%。一般将纯度为2N5~3N的铁称为工业纯铁,≥3N的称为高纯铁,≥4N的称为超高纯铁。由于对高纯铁中痕量杂质的定量分析在技术上较为困难,研究人员也使用剩余电阻率(RRRH=ρ298 K/ρ4.2 K,其中分子和分母分别表示298和4.2 K温度下的电阻率)来标示铁的纯度[5]。RRRH的数值与标称纯度之间存在一定的经验关系[6, 7],如表1所示。当RRRH≥50时称为高纯铁,≥500时可称为超高纯铁。

表1 剩余电阻率RRRH和铁的标称纯度之间的对应关系[6, 7]
尽管我国年产钢材已超10亿吨,远远领先于其他国家,然而当前我国工业界及科研单位所使用的高纯铁大多来自进口。欧美日等发达国家早在20世纪60年代以前就已广泛地展开了对高纯铁制备及高纯铁合金性能的研究,而我国在该领域的研究起步相对较晚。为了助力我国自主研发高纯铁,本文对高纯铁的性质、应用领域以及当前高纯铁的制备方法进行了系统调研,综合对比了国内外研发进展,并对我国高纯铁研发进行了展望。
2 高纯铁的基本性质及应用
2.1 高纯铁的力学和物理化学特性
研究并理解铁的本征力学和物化特性是研发高性能铁基材料的基础。铁的本征特性只有在纯度达到一定程度后才会呈现出来,为了更准确地了解铁的本征特性,需要尽可能地提高铁的纯度,并研究其性质随纯度的变化规律。
研究表明,当杂质浓度很低时,高纯铁展现出不同于一般工业纯铁的独特性能。例如,工业纯铁的韧脆转变温度约为260 K,但是当RRRH>3600时,高纯铁的韧脆转变温度低至50 K或更低[4, 8, 9],其中杂质O含量的减少,会降低铁的低温沿晶断裂敏感性[4]。再例如,工业纯铁的再结晶温度约为720 K,而当RRRH约为8700时,纯铁的再结晶温度降到530 K左右[7, 10]。有研究认为,这种再结晶温度的降低与杂质元素的减少有关,其中金属杂质元素Ga的作用相较于Ni,Mn,Co,Cr等更为显著;对于非金属杂质,N的作用可能大于C的作用[10, 11]。此外,高纯铁具有较好的耐腐蚀性,4N5及以上的高纯铁会在表面形成致密的钝化膜[12-14],使其不溶于稀盐酸、硫酸(可溶于王水)[1, 15]。另外,铁的纯度越高,畴壁越规则,磁场越大,随之而来的是矫顽力降低,磁导率增加[7, 11]。研究表明,金属磁性材料的矫顽力和磁导率并不是简单地由纯度决定的,还与杂质类型及分布、样品尺寸、晶粒尺寸等有关[7]。例如,高温固相氢还原除杂处理能使纯铁中C,N,O,S等杂质减少,促进晶粒长大,并使纯铁获得更低的矫顽力和更高的最大磁导率[11]。除此之外,杂质含量的降低使得杂质对电子的散射作用减小,因此高纯铁还具有优良的导电性能以及低温热传导率[7, 11, 16]。
2.2 高纯铁的应用
高纯铁以其独特的磁性能和机械性能,被应用于磁性器件、电磁产品[16, 17]以及军工产品[18]等。不仅如此,高纯铁作为原材料还在航空航天、电子信息、核工业设施、生物医药、食品工业、化学工业、合金靶材等领域有着广泛的应用空间[11, 15-19]。表2对高纯铁的应用领域进行了汇总。Fe-Cr合金是一个典型的应用案例,该合金具有优异的抗辐照肿胀和抗腐蚀性能,是聚变堆、四代堆结构材料的重要候选之一。然而普通纯度的Fe-Cr合金由于严重的脆化问题,无法在严苛的环境条件下服役。但研究表明,使用高纯铁制备得到的Fe-Cr合金可明显改善普通纯度Fe-Cr合金在实际服役中产生的脆化问题[15]。此外,Fe-Cr合金会随着Cr含量的增加而脆化,以工业纯铁为原料的Fe-20Cr合金在室温下非常容易脆碎,但是使用高纯铁制备的Fe-35Cr合金在室温下仍具有高达400 J/cm2的冲击韧性,且其在可锻性、可轧制性方面也表现优异。因此,原料铁纯度的提高将会显著提高Fe-Cr合金的使用范围和使用寿命,并进而解决该合金在核电材料领域应用时“脆化”这一“卡脖子”问题[15]。不仅如此,铁的纯度提升还能显著提升Cr在铁中的含量极限:普通Fe-Cr合金中Cr的质量分数(下同)超过30%时,其塑性及冲击韧性就会显著恶化;而对超高纯铁,Cr含量增加到60%以上,仍具有高的塑性,相对应的合金耐高温性能可以提高到1273 K以上,可应用于超高温环境,如飞机发动机等[1]。

表2 高纯铁的应用领域[1, 7, 11, 15-23]
此外,电子工业对高纯铁也有需求。例如,新型硅铁半导体的实用化对原料铁的纯度具有非常高的要求。β-FeSi2是一种新型的光电材料,高纯β-FeSi2为n型半导体,但过量的电负性小于Fe的杂质(如Ti,Cr,Mn等)能使其变为p型半导体[20, 21],从而使其在室温下无法获得强光[22]。要利用添加元素来控制载流子密度,就必须实现对每一种杂质元素的精确控制。
2020年,日本东北大学的Abiko教授团队[23]发现具有5N6纯度的超高纯铁对人体组织有着很好的生物相容性:在不外加涂层的情况下,哺乳动物细胞能很容易地附着在超高纯铁的表面,并发生增殖和分化。同时,由于高纯铁具有很好的耐腐蚀性,还可以避免在动物组织中产生过量的Fe2+。因此,超高纯铁有望成为一种优秀的医用生物植入材料。
3 高纯铁研发进展
3.1 国内外高纯铁制备方法
以传统的“铁矿石—烧结—高炉冶炼”为核心的制铁工艺,通常只适用于工业纯铁的制备。为了进一步提高铁的纯度,人们在此基础上发展了以超高精品铁矿为原料的“直接还原-熔分精炼”方法。这种方法不仅使用高纯度的铁矿石,还避免了焦炭、助熔剂等所含杂质的污染,可以制得纯度为3N及以上的高纯铁。除此之外,高纯铁的制备还可以通过对已有原料铁进行提纯的方法来实现。用于铁提纯的技术可大致分为两类:①湿法提纯,包括电解法、重结晶法、溶剂萃取法、离子交换法等;②火法提纯,包括固相氢还原、真空感应/电弧/电子束熔炼、电磁悬浮熔炼、悬浮区域熔炼、氢等离子体电弧熔炼、冷坩埚悬浮熔炼和固态电迁移等。这些方法都是利用杂质与基体在特定条件下的化学或物理性质的差异(例如电极电位、蒸气压和在不同相中的溶解度)来分离杂质的。纯铁中可能有80余种杂质元素,这些杂质难以通过单一方法消除,而每种提纯方法所针对的杂质元素种类、除杂效果等有所不同。关于这些技术方法的详细介绍,可参考近年发表的综述论文[6, 24-26]。
从本质上讲,纯铁的精炼就是各种制备技术和工艺的优化组合。可根据起始原料铁的纯净度、目标需求(例如纯度、特定杂质的含量),使用不同的提纯方法和策略进行制备。图1展示了4种典型的高纯铁制备方法:(a)直接还原-熔分精炼制备方法;(b)电解制备方法;(c)火法提纯制备方法;(d)湿法提纯+火法提纯的联合提纯制备方法。下面对这几种方法进行简要综述。
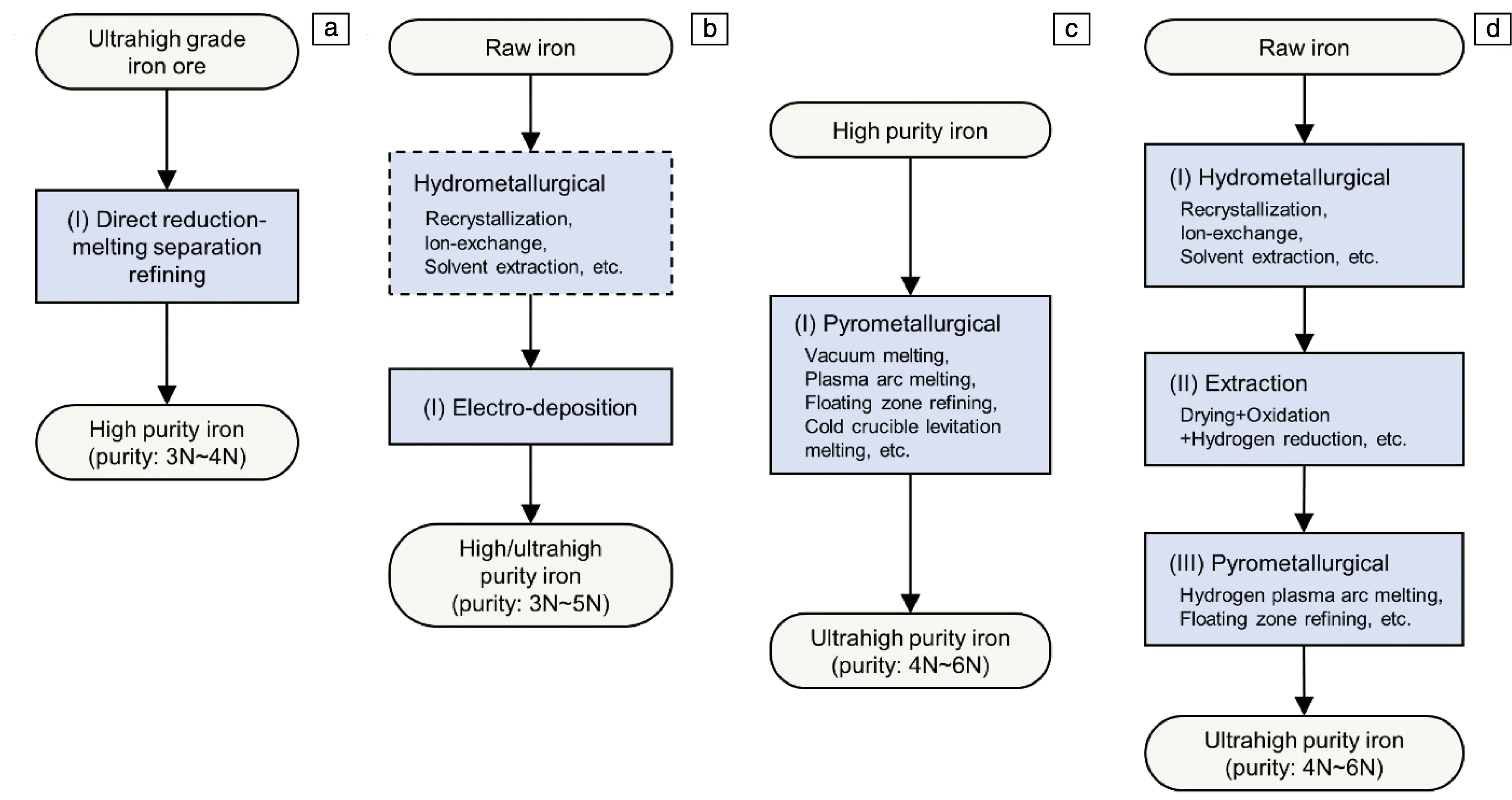
图1 典型的高纯铁制备方法:(a)直接还原-熔分精炼制备方法,(b)电解制备方法,(c)火法提纯制备方法,(d)联合提纯制备方法
3.1.1 直接还原-熔分精炼制备方法
该制备方法的第一步是使用气体或固体为还原剂,在低于铁矿石熔点温度下对超高精品铁矿进行还原得到固态还原铁;第二步是对直接还原得到的铁进行熔分-精炼,以制得纯净度高的铁。自2017年以来,东北大学的赵嘉琦、李峰等[27, 28]使用超高品位精铁矿为原料在实验室制得了标称纯度达到99.947%的高纯铁,并在此基础上进行了1万吨/年的中试实验,制备的高纯铁产品的纯度最高可达99.975%(但硫含量偏高),用该方法制备的高纯铁估算成本为每吨4000元人民币。北京科技大学的李彬等[29]在直接还原-熔分的基础上增加了炉渣精炼步骤,利用中等品位的精铁矿制备出了纯度为99.987%的高纯铁。直接还原-熔分精炼方法在成本和规模上具有很大优势,但由于直接还原铁生产过程中几乎不排除炉料中的脉石元素,因此对含铁炉料要求较高,最终产品质量依赖于铁矿质量,并且难以用来制备超高纯铁。
3.1.2 电解制备方法
电解法可分为水溶液电解和非水溶液电解,其中亚铁离子酸性水溶液电解是目前最常用的电解方法。其原理是利用[Fe/Fe2+]与其他杂质元素[M/Mn+]的电极电位差,减少绝大部分金属杂质的含量,从而实现阴极铁的纯化。使用该方法制得的铁称为电解铁。电解法具有设备简单、工艺相对成熟等优点,已成为目前工业化生产高纯铁的主要方法。早在20世纪10年代的中后期,美国麻省理工学院以及美国国家标准局等单位已经尝试使用电解法制得了纯度为3N5~4N的高纯铁[11, 30]。此后国内外也展开了大量电解法制备高纯铁的研究[31-34]。
然而,单纯使用电解法难以去除和Fe的电位差较小的Co,Ni,Cr,Mn,Cu等元素。为了得到纯度更高的电解铁,需要对阳极材料和电解液中以上几种杂质元素含量进行严格控制,对前者往往通过多次电解提高纯度,对后者常利用重结晶法、离子交换法和溶剂萃取法的湿法提纯技术对溶液进行除杂。重结晶法是通过改变温度使铁盐在溶液中因过饱和析出而实现纯化;离子交换法是利用离子交换树脂的功能基团和溶液中铁离子及杂质离子的交换、解析能力的差异使杂质分离;溶剂萃取法则是利用杂质离子在有机相和水相中的分配比不同来实现杂质分离。美国国家标准局、英国国家物理实验室和法国国家科学研究中心等单位在20世纪30~60年代[11, 35]采用对电解液重结晶、离子交换、溶剂萃取纯化的方法,制得纯度在3N5~4N5的电解铁。日本东北大学Abiko等[2]从20世纪70~90年代,通过多次电解和充分控制电解液的酸度和温度等条件,将电解铁的纯度从3N3提高至4N7。此后,日本东邦亚铅公司和日本东北大学合作制备了纯度达到5N的电解铁[36]。
上海大学印仁和、曹为民等[37, 38]在21世纪初研究了金属杂质元素与Fe共沉积的电化学行为,根据沉积类型分别提出了针对性的除杂方案。此后,北京有色金属研究总院刘琼等[39]、上海大学秦岩等[40]、武汉科技大学黄红兵等[41]详细研究了包括Fe2+质量浓度、电极电流密度等因素对电解效率及成品质量的影响,并制得了最高纯度达4N的电解铁。
3.1.3 火法提纯制备方法
用电解法制备高纯铁的过程,能有效去除原料铁中的金属杂质,但是电解铁往往会含有较多的非金属杂质,如C,N,H,O,S等。火法提纯可以大大降低非金属杂质含量。例如美国的Stein等[42]和Moore等[35]通过在高温下(低于熔炼温度)对电解铁进行干燥氢还原处理,使C,O,N,S的含量大幅度降低。美国Rengstorff等[43]对电解铁进行固相氢还原处理后又进行了真空电弧熔炼,使高纯铁中的非金属杂质总含量低于100 ppm。并且真空熔炼还可以去除一部分蒸气压较低的金属杂质,例如Zn和Mg,从而使产品的总金属杂质含量进一步降低。
为了制备超高纯铁,在大多数情况下需将火法熔炼过程作为最后一步,因此熔炼过程需要除去尽可能多的杂质。常用的熔炼制备超高纯铁的方法有氢等离子体电弧熔炼、真空冷坩埚悬浮熔炼和悬浮区域熔炼。
氢等离子体电弧熔炼是利用含氢等离子弧作热源进行熔炼,不仅可以有效地从铁中去除气态元素,对部分金属也有较好的除杂效果。例如,日本东北大学的Mimura、Isshiki[44]和莫斯科国立钢铁合金学院的Elanski等[45]详细研究了氢-氩等离子电弧熔炼对Fe的除杂作用,发现该方法不仅可以将O,N,C等含量降低到几个ppm,还对Na,Al,Si,S,Mn,Cd和Sb有着70%以上的去除率,而对P,Ca,Ge,As,Ag等杂质的去除率也达到20%~50%。
真空冷坩埚熔炼是通过感应加热方式配合带切缝的水冷铜坩埚对金属进行熔炼的技术,其基本除杂原理与真空感应加热相同,但使用时水冷坩埚与金属熔体之间会形成一层由金属熔体因坩埚冷却而形成的固体壳层,避免了坩埚对熔体的污染。配合高真空技术,有望实现小批量的超高纯铁的制备[15]。但是,氢等离子体电弧熔炼和真空冷坩埚熔炼对Fe熔点附近蒸气压低的Co,Ni,Zr,Nb,Mo等金属杂质的去除效果非常有限。
区域熔炼是一种应用广泛的深度除杂技术,其原理是利用杂质在主体金属固态和熔融态中溶解度的差异,使杂质析出或改变杂质元素的分布,从而达到提纯的目的,包括保护/还原气氛区域熔炼、氧化区域熔炼和真空区域熔炼。其中悬浮区域熔炼可以避免样品舟/坩埚对材料的污染。从20世纪50年代起,研究人员已展开了许多利用区域熔炼方法制备高纯铁的研究[11, 46, 47]。但是区域熔炼方法却很难除去在铁固/液相中分配比例接近于1的杂质,例如Ti,Co,Ni和Mo等。

3.1.4 联合提纯制备方法
除了使用高纯电解铁等作为原料通过火法提纯制备超高纯铁外,还可以采用非高纯的铁为原料通过湿法+火法联合提纯方法来制备超高纯铁。事实上,在湿法提纯技术中,电解法由于存在电解装置污染及电沉积效率低等问题,无法单独制备超高纯铁。因此,可采用其它湿法提纯技术(如溶剂萃取法和离子交换法)制备高纯铁离子溶液,然后直接对溶液进行蒸发-沉淀-烘干-氧化处理,再进行氢还原,最后使用火法提纯制备超高纯铁,如图1d所示,这种制备方法即为联合提纯制备方法。
联合提纯制备方法既利用了湿法提纯来除去原料中的金属杂质,又利用了火法提纯来去除非金属杂质和饱和蒸气压低的金属、半金属杂质,可以得到上限很高的超高纯铁。例如,日本八幡制铁株式会社的Arakawa等[52, 53]在20世纪60及70年代初以市售工业铁粉为原料,首先通过溶剂萃取法纯化铁离子溶液,然后烘干氧化,经氢还原和悬浮区域熔炼得到纯度在4N5以上的纯铁。随后,日本东北大学的Igaki和Isshiki等[10, 54]在1976年成功地使用丙烯酸阴离子交换法对3N级商业电解铁进行提纯,经蒸发烘干、氢还原和悬浮区域熔炼制得了少量RRRH>8000的超高纯铁。值得注意的是,与其他元素(Mn,Ni,Cr和Co)相比,该方法对Cu的去除效果有限。直到21世纪初,Isshiki与日本东北大学的Uchikoshi等以及匈牙利米斯科尔克大学的Kekesi等[55, 56]开发了化合价控制的阴离子交换法,提高了对Cu的去除率,并使用氢等离子体电弧熔炼方法进行了超高纯铁的提纯中试实验。但是该超高纯铁的Si含量超过12 ppm,而且在等离子体电弧熔化期间W-ThO2电极对铁造成W污染。为了解决上述问题,并进一步提高超高纯铁的制备效率,他们随后开发了一种新型的等离子体电弧熔炼制备炉[57, 58],结合控制化合价离子交换法,使用该设备对铁先进行氧化酸洗去除与氧亲和力比铁高的杂质,例如Si,Al,W,然后用氢等离子体电弧熔炼方法对铁进一步脱氧脱气,得到纯度超过5N3的批量超纯铁产品,成为工业化生产的纯度最高的高纯铁之一[59]。
3.1.5 其他高纯铁制备方法
除了上述几种制备方法外,日本日立公司的Miyake等[13, 14, 60]在20世纪90年代开发了一种离子束沉积装置,通过超高真空下电磁偏转的质量筛选系统,将铁离子筛出并沉积成高纯薄膜(薄膜应用领域),其RRRH>8000。
3.2 国内外高纯铁研发对比
从广义上讲,纯铁生产的历史可追溯至古代的铁冶炼,但现代意义上对高纯铁的最早研究来自于美国国家标准局,他们在1914年通过电解法获得了3N5的纯铁[11]。此后,西方国家广泛开展了高纯铁的提炼。20世纪60年代中后期,日本也开始了大量的高纯铁研发活动,并很快取得了一系列的研究成果(案例可参见上文)。自20世纪70年代后期,由于日本政府对钢铁产业基础研发的持续大力投入,以及西方产业转移等原因,日本逐渐取代欧美开始主导高纯铁制备的研发。使用上文所介绍的方法制备得到的高纯铁,其最高纯度纪录几乎都是由日本开创的。日本还实现了商用高纯铁的大规模生产,建立了全球主要的生产企业。例如东邦亚铅公司,用电解法可以批量制备3N~5N的高纯铁。不仅如此,在20世纪80年代后期,日本还开展了国家级的高纯金属研究计划,对新型高纯铁基合金的制备及性能测试开展了大量研究。从1994年起,在日本主导下,德国、法国、英国和美国等国家连续召开了10余届国际超高纯金属会议。
相比之下,我国高纯铁的研发起步较晚。目前我国钢铁企业主要以高炉铁水为原料生产工业纯铁,或以超高精品矿为原料,使用直接还原-熔分精炼方法制备3N以上高纯铁,但这些方法难以制备纯度更高的铁产品。虽然我国早在20世纪中期[33]就开展了电解铁的研究,陆续有单位在实验室制备出3N~4N纯度的高纯铁,然而大部分尚处在实验室阶段,没有进行大规模工业生产。目前可查到的国内高纯铁制备企业,如鄂州汉衍新材料有限公司,主要以工业废铁屑和高浓度含铁溶液为原料,生产纯度约3N的电解铁片和铁粉,产能约1000吨/年[61]。除此之外,鲜有使用其它方法批量制备高纯铁的报道。2009年,北京有色金属研究总院的孙辉等[62]提出了利用萃淋树脂将溶剂萃取的高选择性和色层法的高效性结合起来的萃取色层法,将三氯化铁溶液的纯度提高到了99.99%,但仍未见其后续高纯铁精制的报道。综上所述,我国超高纯铁的研发和生产目前尚处于空白。
图2是对1940年以来高纯铁制备相关的文献调研结果的分析汇总,横轴是发表时间,纵轴是高纯铁的纯度。其中部分论文的纯度是以RRRH的数值表示的,已根据表1将其换算成标称纯度。值得注意的是,标称纯度是用100%减去提供者分析的杂质总量所得的值,而不同文献中检测的杂质种类、数量以及方法存在差别,因此相同的标称纯度对应的真实纯度可能存在较大差别。在本文中,一律按照原文献给出的数值来进行引用。如图2所示,尽管自1990年以来,我国加大了对高纯铁的研发,但就获得的纯度而言,仍与发达国家存在较大差距。
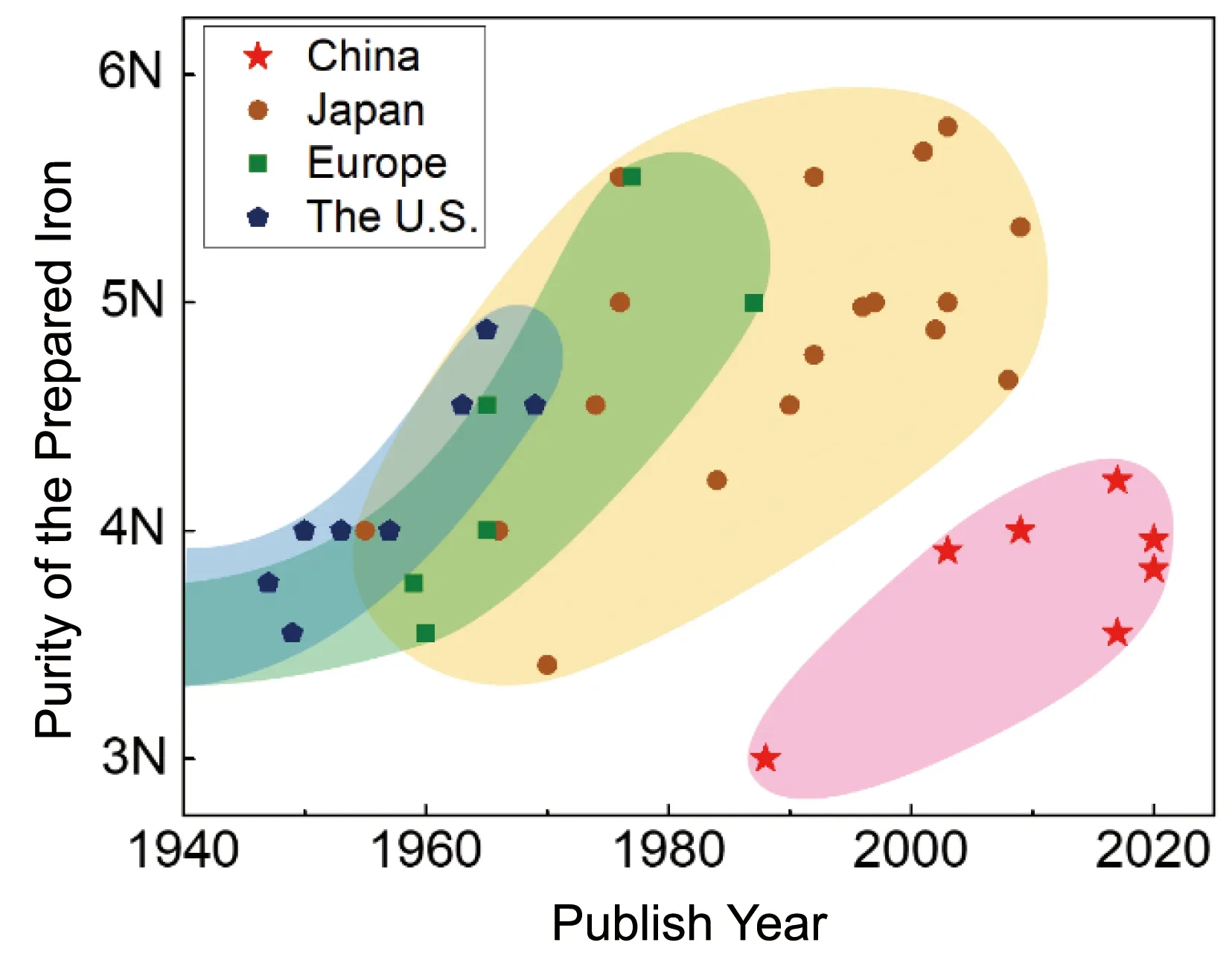
图2 中国、日本、欧洲及美国之间的高纯铁研发对比(数据来自参考文献[5, 10-15, 27-30, 35, 36, 41-43, 46-64])
基于上述原因,当前我国工业界及科研单位所使用的标称纯度3N5及以上的高纯铁均需进口。根据笔者团队对包括阿法埃莎(中国)、顾特服(上海)、中诺新材、河北覃邦新材、合肥科晶、北京研邦新材、天津高科新材、威海元素金属等在内的高纯金属销售公司调研,当前进口的3N5电解铁价格在6万元/吨以上,且随着纯度的增加,价格呈指数式增加,如图3所示。一方面,生产工艺和成本直接影响了市场定价,另一方面,缺乏本土竞争可能导致高纯铁的价格数倍于其制造成本。这一现象导致了我国企业及科研单位研发生产高纯铁产品时“成本高昂—产品规模小”、“竞争力差—市场需求少—研发动力不足—高价进口致使产品成本高”的非良性循环。因此,自主研发低成本、可规模化生产的高纯铁制备技术,建立新的价格-纯度关系(图3),不仅有利于推动高纯铁相关的基础和应用研究,而且对打破国外垄断,保障相关领域的战略物资安全具有重要意义。
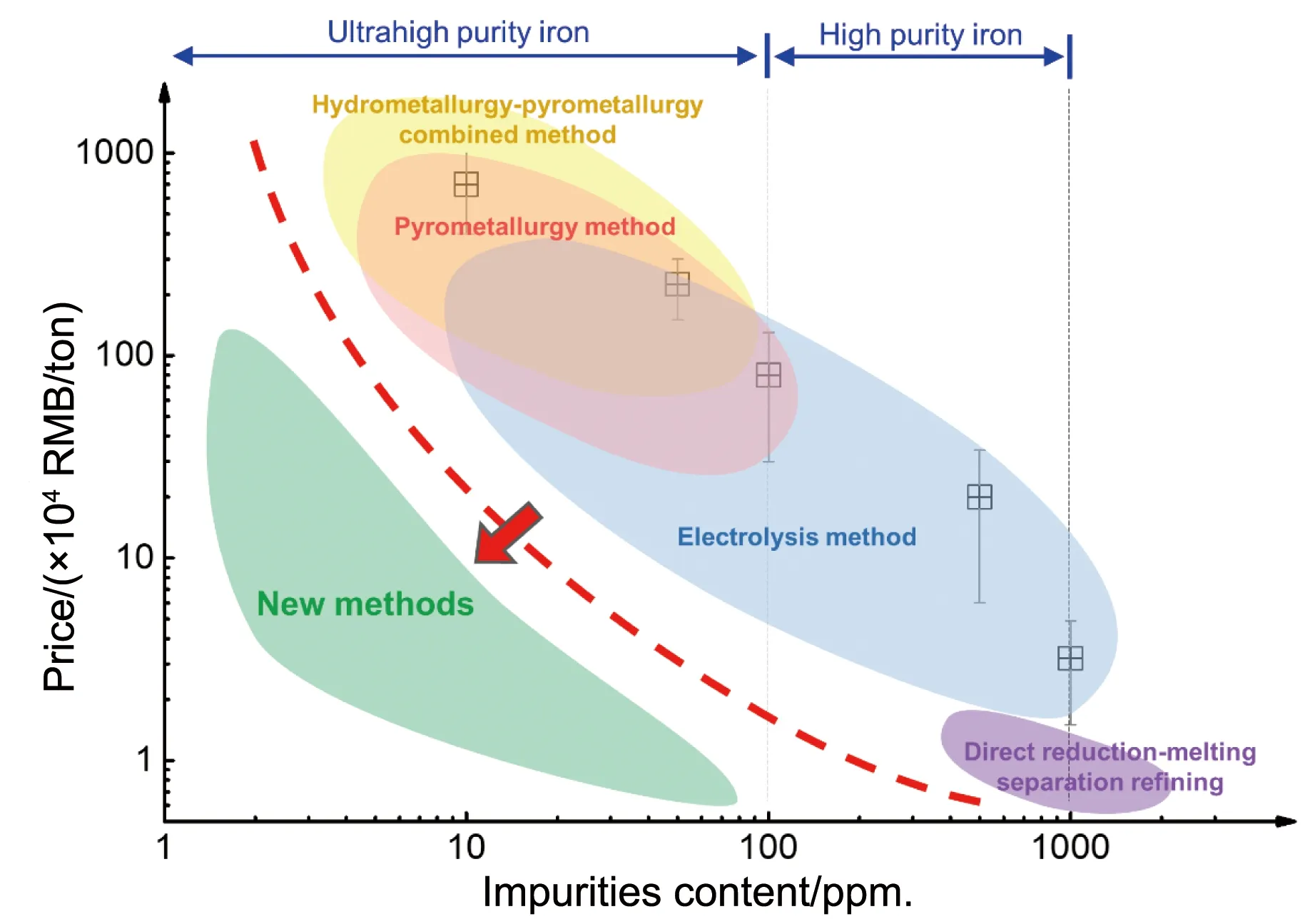
图3 高纯铁制备方法及对应的产品纯度与市场价格的关系
研究表明,合金的设计成分和实际成分往往存在差异,如镍基高温合金和镁合金等[65, 66],这也是国产合金在性能和寿命上与国外同类产品存在较大差距的原因之一。图4是作者总结的理想合金制备与现实中合金制备区别的示意图。理想情况下,合金的母元素和添加元素都应该是纯净的,冶炼工艺和环境也是洁净的,得到的合金是符合设计要求的高品质合金(图4a)。然而,实际情况往往是,合金的母元素和添加元素都含有种类和含量不同的杂质,冶炼工艺流程也会引入一定杂质,结果是得到的合金在化学成分和性能上都偏离了设计的初衷,往往使得合金的性能劣化(图4b)。
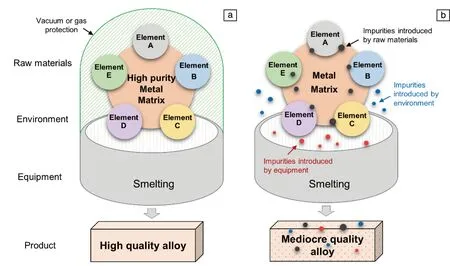
图4 合金冶炼过程示意图:(a)理想合金冶炼,(b)实际合金冶炼
4 高纯铁研发展望
4.1 高纯铁研发趋势
从世界范围看,未来高纯铁的研发重点有以下几个:
第一,加强高纯铁的基础研究,开发基于高纯铁的新材料,并探索其潜在应用领域。尽管目前已有研究表明,高纯铁及高洁净铁基合金具有非常独特的性能和诱人的应用前景,但研究的系统性亟待提升,对于铁的本征特性以及微量杂质对高纯铁性能影响的研究仍有很多未解之谜,进而阻碍了高性能铁基材料的设计、制造及规模化应用。就研究目的而言,可归结为以下两个方面:一方面,要尽可能地去除铁中的有害杂质元素;另一方面,要根据使用目的甄别出有用的添加元素及其最优含量,进而设计制备出能满足需求的高性能铁基产品。
第二,加大高纯铁绿色低成本制备技术的开发。尽管目前已可以制备出高纯铁和超高纯铁,但成本居高不下,制备工艺复杂,很难在工业上得到规模化应用。例如,日本东北大学Abiko课题组通过超高真空技术+冷坩埚熔炼制备的纯度为5N6的超高纯铁,其成本达到了100万美元/公斤以上[23]。此外,用现有的离子交换法+提取+氢等离子体电弧熔炼的联合方法制备超高纯铁,步骤繁杂,且每一步都存在样品被污染的可能,所以每一步都需要进行严格控制,如采用超纯净的烧杯、烧瓶、去离子水以及测试设备等,造成其制备成本高昂,且纯度难以被进一步提高。解决上述问题的潜在途径包括:① 开发不同于传统纯化原理的新纯化技术;② 对常规提纯方法进行优化组合,这需要对每一个工艺步骤进行高效且精良的除杂及污染控制。
第三,高精度分析检测技术的研发。准确测定高纯铁中各种杂质含量,对于检验高纯铁的针对性除杂方案的有效性至关重要。随着高纯铁中痕量元素含量的降低,对其杂质检测技术的要求也随之提高。当前采用的痕量元素分析方法主要有光谱法、质谱法和中子活化分析法,这些方法对某些杂质的分析可以量化至微克和纳克量级。但每种方法所针对的最优检测杂质种类和检出限都有不同。剩余电阻率法(即RRRH法,见上文)是测定样品整体纯度的有效方法,但是该方法不能给出杂质的种类和含量,也不能反映材料中的杂质偏聚。此外,测定超高纯铁中痕量元素时,一般需采用化学预分离技术将其分离出来,在这个过程中也有可能引入新的杂质。因此,提出新型精确的杂质分析方法、设计高效的分析方法组合、优化杂质分析过程中的过程控制等,是未来发展的方向之一。
4.2 高纯铁工业化制备展望
我国当前致力于迈进“高端制造”的行列,高纯原材料有望为传统材料的提质升级提供新的发展机遇,同时自主研发高纯原材料也有助于国家工业基础的战略安全。与欧美日等国家相比,我国高纯铁研发当前处于跟跑阶段,在工业化制备3N以上高纯铁及超高纯铁的技术领域全面落后于发达国家。要实现技术上的追赶超越,需要做好至少3个方面的工作:第一,实现3N以上高纯铁的工业化生产。立足国内现状,在已有的高纯铁制备技术的基础上,不断地改进方法、工艺和控制过程,在保证纯度的前提下,实现高纯铁的低成本化生产。通过价格优势实现高纯铁产品的国产化替代,并通过技术迭代实现纯度的不断提升。第二,超前布局行业标准和国家标准,并通过制定相应的法规和政策,倒逼企业进行技术改造和产品质量提升。第三,积极开拓高纯铁的应用市场,以市场需求牵引高纯铁技术的不断进步。为此,需要在国家层面上积极布局高纯铁及其衍生产品制备和性能的基础研究。
4.2.1 制备技术的研发策略
要按照目标纯度来遴选高纯铁的制备技术。首先,对于3N~4N级别的高纯铁,我国当前已具备在实验室进行制备的技术,接下来需要重点考察这些技术的工业化可行性及其改进措施。从当前已有的除杂原理和制备工艺来看,水溶液电解法仍将会是未来一段时间内实现工业化批量制备3N~4N高纯铁的主力方法。通过提高原料铁的纯度,以及优化电解液的成分、浓度及纯度、电解液pH值、电解液温度、电极的电流密度、阴极材料、电极板间距以及电解槽附带的电解液搅拌、过滤循环系统的参数等,可一定程度上改善电沉积效率和减少杂质元素与Fe的共沉积。此外,通过开发非水溶液电解技术有望实现对已有电解产业的换道超车。在水溶液电解中,由于Fe2+/Fe沉积反应的标准电势比氢释放反应的标准电势更负,因此不可避免地会发生氢气析出的副反应,同时带来阴极局部pH升高。附着在沉积物上的氢气泡会导致沉积的铁不致密且表面粗糙,内部容易产生夹杂。此外,水溶液电解过程中Fe2+易氧化生成Fe3+,容易形成胶状物阻碍电解液流动,同时也造成溶液内Fe2+的浓度不稳定,降低电解效率。采用不含活性氢离子的二甘醇二甲醚作为氯化亚铁的溶剂,在合适的电压参数下可制备出致密且光滑的电解铁[67];利用混合熔盐电解法,可避免水溶液带来的问题,且具有提纯效率高、提纯效果好、成本低及易实现大规模连续化生产等优点[24, 68]。因此应当加大对有机溶剂电解法和熔盐电解方法制备高纯铁技术的研究。
其次,对于纯度≥4N的超高纯铁的制备,可以借鉴前述的火法提纯和联合提纯制备方法。例如,“高真空+半连续拉锭的感应加热冷坩埚熔炼+区域提纯+电迁移”的技术路线有望同时实现高效的提纯和连续化的生产,是未来实现超高纯铁规模化制备的一个重要发展方向。但是要注意,采用的提纯步骤越多,发生污染的风险越大,因此应尽量采用短流程的制备工艺。
最后,除了化学纯净的超高纯铁,还应根据高纯铁的最终用途,采取针对性措施以去除对预期用途有害的杂质。例如,制备用于国防尖端精密仪器、航天飞船元件的具有极佳真空气密性兼优良电磁性能的军工纯铁,可以用特定工业纯铁或者高纯电解铁为原料,采用真空熔炼或氢等离子体电弧熔炼等方法对其进行非金属及其他间隙杂质的去除。
4.2.2 相关标准的建立及相关产业的发展
实现高纯铁的产业化制备是一个系统工程,除了在技术层面探索高纯铁的制备方法之外,还应该注重与其相关的国家标准、行业标准以及相对应的分析检测方法的更新和建立。
首先,亟需建立高纯铁的标准。当前我国最新的原料纯铁国标GB/T 9971-2017,所规范的最纯的铁是牌号为YT4的工业纯铁,在仅分析10种杂质元素含量(不包括O,N等)的情况下,纯度要求仍小于3N,这对于规范高纯铁和超高纯铁是远远不够的。在新标准的制定上应以基础研究的成果为根本依据,充分借鉴发达国家的标准制定原则,兼顾现有生产能力和未来发展的需求。同时,新的标准不仅应包括对高纯铁产品纯度的定义,也要对杂质元素的波动范围做出规定。
其次,亟需更新相应的杂质检测技术标准。例如,当前国标GB/T 9971-2017中对于P的检测,使用的标准是GB/T 223.59和GB/T 223.62,其中前者所规定的方法是铋(锑)磷钼蓝分光光度法,但这种方法对钢铁中P的定量灵敏度不足,因此不适用于高纯铁中P的定量分析。采用氢氧化铍共沉淀分离后的钼酸盐-孔雀石绿(MoP-MG)和钼酸-亮绿色(MoP-BG)吸光光度法可以定量测量高纯铁中的痕量P(<1 μg/g)[69]。
最后,要实现完全自主的高纯金属工业化制备,还要不断发展其他相关的高技术产业,包括但不限于高真空冶炼设备的设计和制造、高纯试剂及容器的研发和制造等。据报道,北京有色金属研究总院和中国原子能科学研究院已成功制备了第一台国产化的电子束区域熔炼炉,并且已使用该设备成功对HfI4(碘化铪)棒进行了提纯,获得了高纯金属Hf[70],这使我国向完全自主化生产超高纯金属(包括高纯铁)迈进了一大步。
5 结 语
高纯原材料在高端制造领域的巨大应用潜力使得其越来越多地受到科学界和产业界的关注。铁作为应用最广泛、资源最丰富的金属元素之一,如何制备高纯及超高纯铁也成为了当今的研究热点。当前制备高纯铁的主要方法大致可分为4种,包括直接还原-熔分精炼制备方法、电解制备方法、火法提纯制备方法和联合提纯制备方法。我国在高纯铁研发领域仍显著落后于欧美日等发达国家,当务之急是研发低成本、可工业化生产的高纯铁制备技术。实现高纯铁的自主制备,不仅可以降低我国企业使用成本、提高产品性能,还能将技术经验推广至其他高纯金属的制备,提高我国基础材料的战略安全性,同时助力我国从原材料大国到原材料强国的升级,提高我国制造业产品的核心竞争力。
致谢:感谢国家自然科学基金项目(52031011,51971167)、国家重点研发计划项目(2017YFB0702001)和西安市科技计划项目(2017xasjl014)的资助;感谢陕西斯瑞新材料股份有限公司的郭创立、孙君鹏、周斌等在资料检索、行业信息搜集等方面提供的帮助。

