宫腔镜子宫内膜息肉切除术治疗子宫内膜息肉的临床效果
周娟
子宫内膜息肉是临床中常见的妇科疾病,一般因患者局部子宫内膜受到激素持续刺激导致,进而出现带有炎症的息肉,轻症者会出现下腹疼痛、经期异常等症状,严重者则可能导致患者不孕,对患者身心健康有严重影响。子宫内膜息肉可发生在青春期后的任何年龄,但在35岁以上的女性中很常见[1-2]。目前临床发病机制尚不清楚,但与炎症因素和内分泌因素有关。既往治疗子宫内膜息肉多采用手术,主要是传统的刮宫和子宫切除术。传统的开放式刮宫手术能够达到清除治疗的效果,但是其手术创口较大,对患者身体造成的危害也比较大大,术后不良反应发生率高,术后恢复缓慢。宫腔镜子宫内膜息肉切除术是近年来兴起的一种治疗方法,具有创伤小、术后恢复快等优点[3-4];大多数子宫内膜息肉患者经宫腔镜治疗后,术中出血量明显减少,患者住院时间缩短,预后效果良好,术后很少出现并发症或者息肉复发情况。本研究选取在本院经手术治疗的96例子宫内膜息肉患者作为对象展开研究,探讨宫腔镜子宫内膜息肉切除术治疗子宫内膜息肉的临床效果,具体报道如下。
1 资料与方法
1.1 一般资料
对本院2018年7月—2020年2月收治的96例子宫内膜息肉患者的临床资料进行回顾性分析。根据手术方式将整体样本分为两组,其中对照组40例,予以常规刮宫术,观察组56例,采取宫腔镜子宫内膜息肉切除术。观察组患者年龄28~53岁,平均年龄(38.57±3.58)岁,平均病程(2.57±1.04)年,月经量增多32例,阴道异常出血12例,单发息肉31例,多发息肉25例。对照组患者年龄26~54岁,平均年龄(39.45±3.52)岁,平均病程(2.63±1.07)年,月经量增多28例,阴道异常出血11例,单发息肉22例,多发息肉18例。两组患者的年龄、月经量及出血原因比较差异无统计学意义(P>0.05),可进行比较研究。
1.2 纳排标准
(1)纳入标准:①均符合足子宫内膜息肉的临床诊断指标,获得病理诊断数据[5];②所有患者及其家属对本研究涉及内容知情且同意参与。(2)排除标准:①患有恶性肿瘤者;②合并凝血功能障碍者;③合并免疫功能障碍者;④近期使用其他方法治疗对本研究结果造成影响者;⑤存在精神疾病以及认知能力障碍的患者。
1.3 方法
1.3.1 对照组 予以患者进行常规刮宫术,具体内容如下:手术于患者月经干净后3~7 d进行,术中体位为膀胱取石位,常规消毒,铺无菌毛巾,取阴道扩张器充分扩张阴道,获得宫颈手术场,对宫颈进行消毒,取棒状宫颈扩张器扩张宫颈,然后取刮匙轻轻放入宫腔,依次刮去子宫内膜息肉,同时采用负压吸引患者宫腔,确保无息肉残留,将息肉放入标本袋内检查。
1.3.2 观察组 予以宫腔镜子宫内膜息肉切除术治疗,详细内容如下:患者完善术前相关检查,手术于经期结束3~7 d进行,术前给予200 μg米索前列醇,经阴道用药,用于软化宫颈、扩张宫颈口。给予腰硬联合麻醉,指导患者取膀胱截石位,常规消毒铺无菌巾,采用0.9%生理盐水作为膨宫液,用窥镜暴露宫颈,用宫颈钳钳住宫颈前唇,依次用4~7号扩张器扩张宫颈,宫腔镜通过宫颈口放置。待子宫扩张满意,子宫扩张液清除后,检查宫颈内口、子宫前后壁、子宫底及双侧输卵管开口是否有充血、出血、增生、赘生物或异物,确定息肉的位置、大小、性质和数量,在宫腔镜下切除息肉,彻底搔刮宫腔,重新置入宫腔镜进行复检,确定息肉完全切除后结束手术。将取出息肉装入标本袋送检。
术后两组均给予止血和抗感染药物治疗,且口服地屈孕酮治疗,从术后第7天开始让患者口服地屈孕酮(生产企业:Abbott Biologicals B.V.;进口药品注册证号:H201702211;规格:10 mg/片),10 mg/次,2次/d,经期停药,从月经后第14天开始继续服用,共用药3个月,6个月后复查。
1.4 观察指标
(1)观察两组患者手术情况及术后复发率,其中手术指标包括手术时间、术中出血量、住院时间,并在术后6个月观察和统计出现病情复发的患者例数,计算病情复发率。(2)观察两组患者手术前及术后6个月的月经量和子宫内膜厚度。(3)观察并评价两组患者的临床治疗情况,具体指标如下:①显效:手术治疗后患者各项临床症状明显改善或者完全恢复,经宫腔镜检查后无息肉残留;②有效:治疗后患者各项临床症状有所缓解,经宫腔镜检查发现极少量息肉;③无效:治疗后患者各项临床症状无改善甚至出现加重现象。临床治疗效率=(显效+有效)/总例数×100%。(4)观察两组患者术后并发症发生情况,包括腹痛、宫腔粘连、感染、子宫穿孔。
1.5 统计学分析
2 结果
2.1 两组手术指标、术后复发率比较
两组患者手术时间、住院时间比较差异无统计学意义(P>0.05),观察组术中出血量、复发率均低于对照组(P<0.05),见表1。

表1 两组患者手术指标、术后复发率比较
2.2 两组患者月经量及子宫内膜厚度比较
术前两组月经量、子宫内膜厚度比较差异无统计学意义(P>0.05);术后6个月复查,观察组月经量、子宫内膜厚度均低于对照组(P<0.05),见表2。
表2 两组患者月经量及子宫内膜厚度比较()
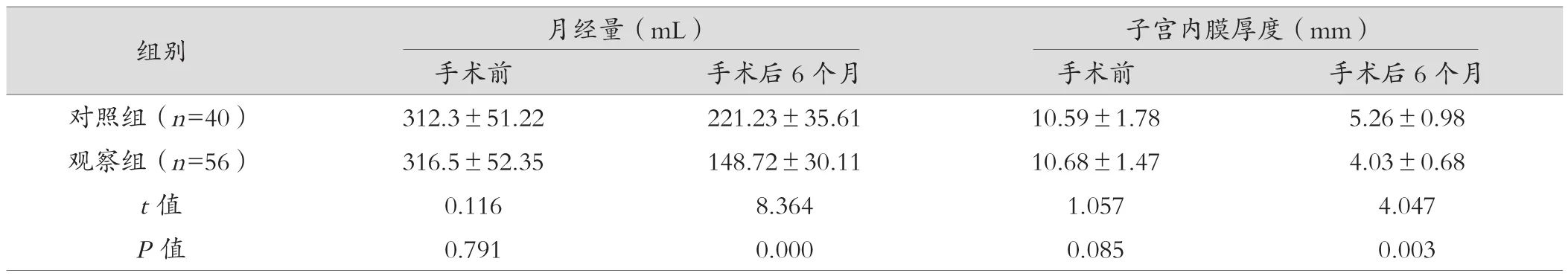
表2 两组患者月经量及子宫内膜厚度比较()
组别 月经量(mL) 子宫内膜厚度(mm)手术前 手术后6个月 手术前 手术后6个月对照组(n=40) 312.3±51.22 221.23±35.61 10.59±1.78 5.26±0.98观察组(n=56) 316.5±52.35 148.72±30.11 10.68±1.47 4.03±0.68 t值 0.116 8.364 1.057 4.047 P值 0.791 0.000 0.085 0.003
2.3 两组患者临床治疗效率对比
观察组临床治疗效率为97.50%,远高于对照组的78.57%,观察组临床治疗效果更好(P<0.05),见表3。

表3 两组患者临床治疗效率对比
2.4 两组并发症发生率比较
观察组患者术后腹痛、宫腔粘连、感染、子宫穿孔等并发症发生率均低于对照组(P<0.05),见表4。

表4 两组并发症发生率比较[例(%)]
3 讨论
子宫内膜息肉是比较常见的妇科疾病,主要包括两种类型:一种是子宫内膜炎症时形成的炎性息肉,另一种是雌激素过度刺激或长期大剂量使用时子宫内膜增生而产生的息肉。诱发因素是年龄的增长、肥胖、高血压、糖尿病、HPV感染、乳腺癌术后长期应用他莫昔芬等。我国多项研究表明,大约15%的不孕者均与子宫内膜息肉有关[6],诱发因素包括:内膜息肉常造成输卵管口被阻塞,阻碍了精子进入到输卵管中与卵子结合;子宫内膜息肉占据子宫空间无法使胚胎成功着床。因此彻底清除子宫内膜息肉,对女性的健康和孕育都有重要的意义。宫腔镜是诊断子宫内膜息肉的金标准,可直接观察到患者子宫内的状态,直观的观察子宫内膜息肉的大小、数量和性状,精准的为刮诊、活检做定位,提高活检及刮诊成功率[7]。
如果经B超检查发现子宫内膜息肉直径在1 cm以内,且无明显症状或只有少量阴道异常出血,可以选择通过药物保守治疗,药物治疗包括孕激素药物[8]。如果经B超检查发现1cm以上的息肉或患者有明显异常出血、月经异常情况,需立即就医,临床主要治疗方法是子宫内膜息肉切除术。宫腔镜手术可以清晰观察到宫腔内情况及病灶大小、具体位置,将病灶组织彻底清理,不会破坏子宫内膜,不影响患者的生育能力,比诊刮术创伤小,术中出血少,没有病灶残留,有利于术后恢复正常,且并发症少;宫腔镜手术可彻底切除息肉,宫角、微小的息肉也会被清除干净,达到根治的目的,因此复发率低。本研究中,观察组术中出血量及复发率均低于对照组,说明宫腔镜子宫内膜息肉切除术可降低术中出血量,利于患者恢复[9]。
子宫内膜息肉切除术常见的并发症是感染、清除不彻底、子宫穿孔,并发症的发生与息肉的大小、手术创伤关系密切。在宫腔镜的引导下可准确定位息肉位置、大小及与周围组织的关系,在宫腔镜引导下进行息肉切除,操作准确性高,可降低子宫穿孔、清除不彻底的发生率[10-11]。本研究中,观察组患者术后腹痛、宫腔粘连、感染、子宫穿孔的并发症发生率均低于对照组,足以说明宫腔镜子宫内膜息肉切除术可降低并发症发生率。采用宫腔镜子宫内膜息肉切除术不会影响正常的子宫内膜和卵巢,切除后子宫内膜修复较快,可降低内膜厚度,促进月经恢复正常[12]。本研究中,观察组月经量和子宫内膜厚度均低于对照组,说明宫腔镜子宫内膜息肉切除术有利于术后恢复,对育龄期女性健康意义更大。观察组患者的手术时间、住院时间均明显短于对照组,观察组术中出血量、复发率均低于对照组,说明观察组患者治疗恢复的速度更快(P<0.05);观察组临床治疗效率为97.50%,远高于对照组的78.57%,说明观察组临床治疗效果更好(P<0.05);观察组患者术后腹痛、宫腔粘连、感染、子宫穿孔的并发症发生率均低于对照组,说明观察组手术治疗手段安全性更高(P<0.05)。宫腔镜子宫内膜息肉切除术可准确的定位内膜息肉位置,在保留内膜的完整度且不损伤卵巢功能的条件下将息肉彻底清除干净,可降低术后复发率;同时明确息肉具体位置有助于临床进行有效的治疗,改善患者的生育能力,降低患者不孕率。
综上所述,宫腔镜子宫内膜息肉切除术是治疗子宫内膜息肉的有效方法,有利于患者的康复,降低复发率和并发症发生率,值得推广应用。

