羟基磷灰石同步去除地下水中氟、铁和锰性能
李喜林, 刘思初, 吴美林, 高梦晴, 谷 庆, 刘思源, 李嘉宁, 王 健
(辽宁工程技术大学 土木工程学院, 辽宁 阜新 123000)
1 研究背景
近年来,受矿山开采、水岩作用及人类环境破坏的影响,我国的甘肃、辽宁省等许多地区地下水存在氟、铁、锰离子同时超标的问题,对以地下水为饮用水水源的居民生活健康带来了极大的困扰[1-2]。当氟浓度超过允许限值时,会引起牙齿和骨骼氟中毒、甲状腺、肝脏损害[3]。地下水中的铁和锰超标会出现遗传性慢性疾病、影响人体的中枢神经系统和呼吸系统[4]。因此,寻找经济、安全、高效的同步除氟去铁锰技术对解决居民饮水安全健康问题具有重要的现实意义。
目前地下水除氟的方法主要有沉淀法、电凝聚法、电渗析法、吸附法、纳滤、离子交换法等[5];去铁锰的主要方法包括生物法、吸附法、膜技术以及接触氧化法等[6]。吸附法由于具有材料来源广泛、成本低廉、环境友好以及工艺操作简单等优点而备受关注[7]。羟基磷灰石(Ca10(PO4)6(OH)2,HAP)是钙磷灰石的一种矿物形式,作为新型吸附剂,具有良好的生物相容性和吸附性能[8]。Avram等[9]运用沉淀法合成了低晶度、大比表面积的羟基磷灰石来去除矿山废水中的重金属,通过微观分析证明了其良好的吸附性能。胡家朋等[10]运用制备的HAP处理水溶液中的氟离子,通过不同反映参数的影响试验证实了HAP对F-良好的去除效果。Popa等[11]运用合成的HAP去除酸性矿山废水中的铁、锌、锰重金属离子,去除效果依赖于羟基磷灰石的剂量和反应接触时间,去除率分别达到了99.8%、83.4%和24.7%。
由此可见,HAP对水中氟离子及铁锰离子均有较好的吸附效果,但目前同步除氟去铁锰研究却鲜见报道,同步吸附去除机理研究不足。
基于此,采用辽宁省阜新市含氟、铁、锰实际地下水为研究对象,用溶胶-凝胶法制备HAP,开展HAP对地下水中F-、Fe2+、Mn2+同步去除效果研究,建立吸附等温模型和动力学方程。对反应前后的HAP进行微观表征并分析吸附机理,对HAP的再生循环性能进行研究,为高氟高铁锰地区地下水净化提供可靠参数。
2 试验材料与研究方法
2.1 羟基磷灰石的制备
采用溶胶-凝胶法制备HAP[12],配置一定体积的P2O5醇溶液和Ca(NO3)2·4H2O醇溶液并混合,控制Ca/P原子比为1.67,加入氨水调节pH至8。在室温下使溶液充分混合,制成溶胶,陈化3 d,放入干燥箱内100 ℃干燥24 h,用马弗炉600 ℃热处理2 h,自然冷却后研磨过筛,用2%醚化淀粉制成3 mm的羟基磷灰石小球。所用化学物质和试剂均为分析纯。
2.2 吸附试验
地下水水样取自辽宁省阜新市大庙村某水井,不同季节检测实际污染地下水水质的参数如表1所示。模拟水样采用NaF、FeSO4·7H2O、MnSO4·H2O和去离子水配制。pH采用精密pH计(PHS-3C型)进行测定,溶液中F-浓度采用氟离子选择电极(PF-2-01型)测定,Fe2+和Mn2+浓度采用原子吸收分光光度计(Z-2000型)测定。

表1 实际地下水水样的水质参数
2.3 羟基磷灰石微观表征分析
采用N2吸附-脱附法及比表面积与孔隙度分析仪(Brunaure-Emmett-Teller, BET,康塔Atuosorb-iQ型)测试HAP比表面积与孔径;采用X射线衍射仪(X-ray diffraction, XRD,岛津XRD-6100型)进行HAP物相分析;采用扫描电子显微镜(scanning electron microscope, SEM,日本电子JSM-7500F型)观察HAP的表观形态;采用X射线能谱仪(energy dispersive spectrometer, EDS,FYFS-2002E型)对不同元素定性定量分析;采用傅立叶变换红外光谱仪(Fourier transform infrared spectrometer, FTIR,IRPrestige-21型)分析样品吸附前后官能团的变化。
3 结果与分析
3.1 羟基磷灰石同步除氟去铁锰影响因素研究
3.1.1 投加量的影响 在150 mL水样中控制不同投加量的HAP,在室温下反应120 min,不同投加量对F-、Fe2+、Mn2+去除率的影响见图1。由图1可知,在投加量为50~600 mg时,F-、Fe2+、Mn2+的去除率均随投加量的增加而增大;这是因为吸附剂投加量越大,各离子可吸附活性位点就越多,Liang[13]等在研究玻璃衍生羟基磷灰石除氟性能时也得到了相同的结论。投加量达到600 mg(即4 g/L)之后,试验水样中各离子的去除率均保持稳定,根据张连科等[14]的研究结果,继续增加投加量时,大量未反应的活性吸附位点之间会发生聚集和重叠,使HAP的比表面积和吸附容量减少,各离子更快达到吸附饱和状态。综合考虑认为,最佳投加量为600 mg(即4 g/L),对应F-、Fe2+、Mn2+去除率分别为80.3%、99.4%和99.1%。

图1 HAP不同投加量对F-、Fe2+、Mn2+去除率的影响
3.1.2 反应时间的影响 在150 mL水样中加入600 mg HAP,室温下振荡不同反应时间,不同反应时间对F-、Fe2+、Mn2+去除率的影响见图2。由图2可以看出,随着吸附时间的延长,HAP对各离子的去除率先逐渐升高后变得平稳,通常认为HAP达到了吸附饱和,各离子去除率不再增加[15]。在150 min时F-的去除率最高,150 min之后,F-的去除率略有降低,李新云等[16]认为这应该是吸附饱和后,吸附质和吸附剂之间相互碰撞产生了脱附现象。对Fe2+、Mn2+离子,吸附时间为120 min时HAP对Fe2+、Mn2+去除率达到最大,之后延长吸附时间,吸附去除率未见明显变化。这说明Fe2+、Mn2+相比F-不易脱附。考虑去除效果,最佳反应时间确定为150 min,此时F-、Fe2+、Mn2+的去除率分别为82.8%、99.6%和99.4%。

图2 不同反应时间对F-、Fe2+、Mn2+去除率的影响
3.1.3 反应温度的影响 在150 mL水样中加入600 mg HAP,pH值为7,反应时间为150 min,控制反应温度20~50 ℃,反应后分别测定F-、Fe2+、Mn2+浓度,不同反应温度对F-、Fe2+、Mn2+去除率的影响见图3。由图3可以看出,反应温度在20~35 ℃时,随着反应温度升高,F-、Fe2+、Mn2+去除率均逐渐增大,由于反应温度升高使试验水样中各离子的运动速率升高,增大了吸附剂与试验水样中各离子的接触几率,表明HAP的吸附是一个吸热过程。当反应温度大于35 ℃时,各离子去除率均保持平稳,El Khal等[17]在研究HAP去除水中Pb2+时发现温度升高使HAP内部结构产生膨胀效应,大量离子进一步渗透,使HAP的吸附更快达到饱和。综合比较认为,最佳反应温度为35 ℃,此时F-、Fe2+、Mn2+去除率最高分别为84.6%、99.9%和99.8%。

图3 不同反应温度对F-、Fe2+、Mn2+去除率的影响

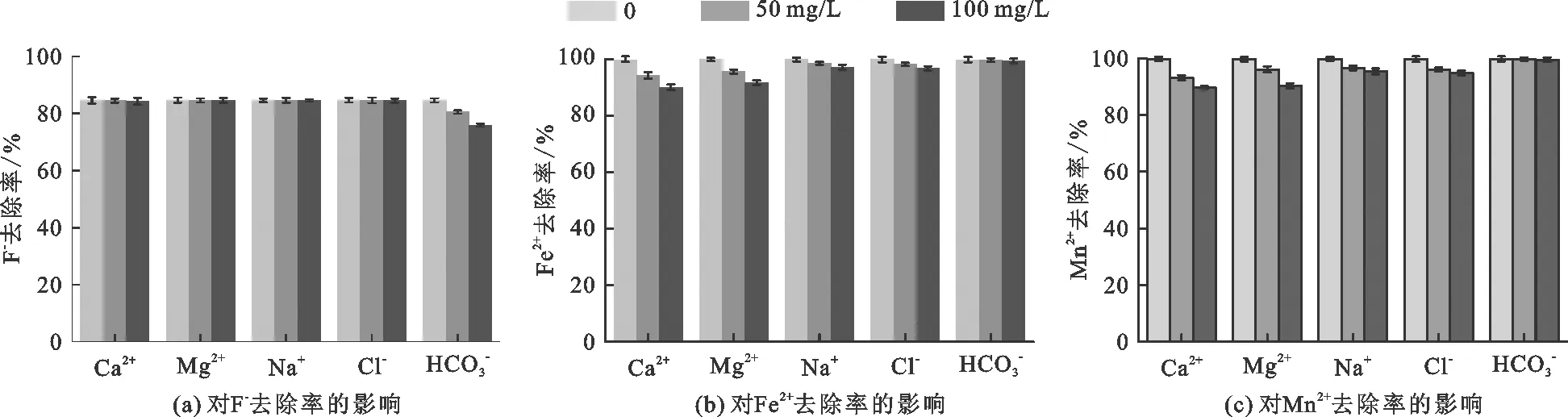
图4 不同浓度的其他离子共存对F-、Fe2+、Mn2+去除率的影响
3.2 吸附等温线
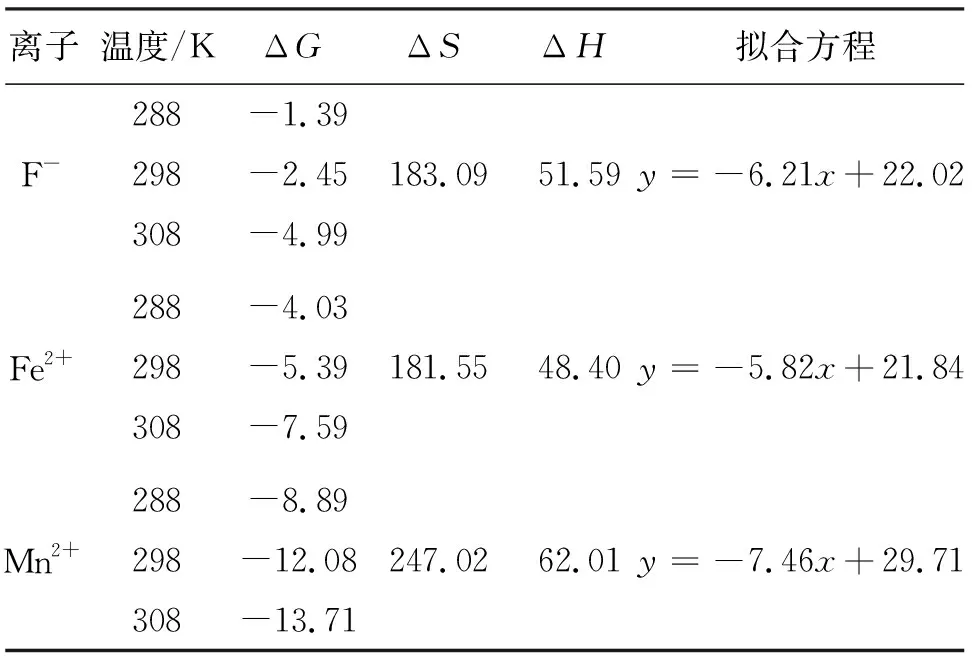
运用Langmuir和Freundlich等温模型[15]对HAP同步除氟去铁锰的数据进行拟合,拟合结果见表2。由表2可以看出,Langmuir方程拟合后的R2值比Freundlich方程拟合后的R2值高,说明HAP对F-、Fe2+、Mn2+的吸附更符合Langmuir模型,属于单层吸附。表2中KL为表示吸附有利条件的Langmuir常数,0 表2 HAP吸附F-、Fe2+、Mn2+的吸附等温拟合参数 在室温条件下,HAP对F-、Fe2+、Mn2+吸附容量分别为7.60、11.64、9.16 mg/g,将HAP与其他相关文献吸附剂吸附容量进行对比,结果见表3,HAP吸附F-、Fe2+、Mn2+相关热力学参数见表4。 表3 HAP与相关文献的吸附剂在去除F-、Fe2+、Mn2+方面吸收能力比较 由表3看可出,HAP可以被认为是一种潜在的高效吸附剂,可用于同步去除水溶液中的F-、Fe2+和Mn2+离子,且具有较高的吸附容量。为了探究HAP体系反应温度对F-、Fe2+、Mn2+离子的热力学吸附过程,通过焓变(ΔH)判断体系的热量变化、熵变(ΔS)判断体系混乱程度的变化、自由能变化(ΔG)判断吸附过程的热力学性质。由表4可看出,F-、Fe2+、Mn2+离子的热力学回归方程的斜率均为负,且ΔH>0,ΔS>0,ΔG<0,上述各参数特征说明HAP对F-、Fe2+、Mn2+离子的吸附是自发的吸热熵增过程。 表4 HAP吸附F-、Fe2+、Mn2+相关热力学参数 运用准一级动力学和准二级动力学方程[20]对HAP同步除氟去铁锰的数据进行拟合,拟合结果见表5。由表5中看出,应用准二级动力学方程拟合后的R2值高于应用准一级动力学方程拟合后的R2值,因此,准二级动力学可以更好地描述HAP对F-、Fe2+、Mn2+同步吸附过程,且准二级动力学模型表明吸附由表面反应过程控制,而非吸附质扩散过程控制[21]。 表5 HAP吸附F-、Fe2+、Mn2+的吸附动力学拟合参数 HAP的N2吸附-脱附等温线见图5。 图5 HAP的N2吸附-脱附等温线 通过N2吸附-脱附方法测定出HAP的孔径为5.08 nm,在2~50 nm范围内,孔隙属于介孔,介孔有利于HAP对F-、Fe2+、Mn2+的同步吸附[22],BET比表面积为21.68 m3/g。 HAP吸附前后XRD衍射图谱如图6所示。由图6可以看出,在2θ为26°、32°、33°、40°、47°处的特征结晶峰证实了HAP结构的形成[18],HAP与复合水样反应后出现新衍射峰,形成的新化合物为Ca5(PO4)3F、Fe10(PO4)6(OH)2和Mn10(PO4)6(OH)2。 图6 HAP吸附前后XRD衍射图谱 图8为HAP处理复合试验水样反应前后SEM图和EDS图,由图8可以看出,HAP表面颗粒呈现多孔形态(图8(a)),这为HAP的吸附增加了吸附位点;处理试验水样后HAP表面有絮状物质产生并附着在HAP表面(图8(b)),说明HAP对F-、Fe2+、Mn2+进行了表面物理吸附。HAP主要由Ca、O、P元素组成(图8(c)),吸附反应后图谱(图8(d))中出现了F、Fe、Mn元素,吸附后Ca、P和O原子重量百分比明显降低。 图8 HAP吸附F-、Fe2+、Mn2+前后的SEM图和EDS能谱图 HAP(Ca10(PO4)6(OH)2)结构表面有大量的OH-、Ca2+和PO43-,PO43-与Fe2+、Mn2+发生表面络合作用,在XRD衍射图谱中显示形成新的络合物;之后Ca2+与之进行离子交换反应。由准二级动力学可知,HAP对Fe2+的吸附量(11.64 mg/g)大于对Mn2+的吸附量(9.16 mg/g),Zhu等[24]认为这与离子电负性有关,Fe2+(1.83)、Mn2+(1.55)的电负性比Ca2+(1.00)大得多,Fe2+的吸附速率大于Mn2+,且电负性越大的离子越优先占据吸附位,因此Fe2+、Mn2+更易与Ca2+进行离子交换作用,并占据PO43-的空位,使Fe2+、Mn2+更好地固定在HAP上,这与邹雪艳等[25]研究纳米羟基磷灰石去除溶液中的Pb2+时的机理类似。王晓等[26]也认为HAP粉体中的Ca2+通过离子扩散、离子交换以及表面络合的方式实现了对Cd2+等重金属离子的去除。与此同时,带负电的F-与表面带正电的HAP产生静电吸引力,陈芳琳等[27]研究认为HAP表面的羟基(-OH)易于缺失并形成阴离子吸附位点,F-先被吸附到HAP表面,后与HAP中大量的OH-进行离子交换作用,从而达到了同步除氟去铁锰的目的。综合分析,HAP对地下水中F-、Fe2+、Mn2+的同步去除过程为物理吸附、以离子交换反应体现的化学吸附以及表面络合反应。 通过最佳静态条件,使用0.1 mol/L Na2CO3和0.1 mol/L HNO3作为洗脱液[28],对吸附后的HAP小球进行了5次再生循环的测试,各循环次数后对F-、Fe2+、Mn2+的去除率变化如图9所示。 图9 HAP对各离子去除率随再生循环次数的变化 由图9可看出,随着再生循环次数的增加,HAP对各离子去除率逐渐降低,这是因为HAP小球再生循环使用时洗脱不充分,导致尚有离子留存于吸附位点中,降低了对离子的吸附性能。观察到在5次循环之后,HAP小球仍能保持其形状,没有重量明显减少的情况,这对于回收是非常有利的。这些结果表明,HAP具有良好潜在应用的再生稳定性和可重复利用性能。 为了研究HAP小球对实际地下水的吸附性能,将HAP小球放入150 mL实际地下水水样中,进行3次试验,反应后分别检测F-、Fe2+和Mn2+浓度,结果如图10所示。由图10可见,反应后F-、Fe2+、Mn2+浓度降至约0.66、0.23、0.07 mg/L,均达到《生活饮用水卫生标准》(GB 5749—2006)[29]的要求,因此,HAP可成为含有高氟铁锰的地下水修复优良的吸附剂。 图10 HAP对实际地下水中F-、Fe2+、Mn2+的吸附效果 (2)Langmuir吸附等温模型和准二级动力学方程更好地描述了F-、Fe2+、Mn2+在HAP上的同步吸附过程。热力学分析结果说明HAP对F-、Fe2+、Mn2+的同步吸附是一个自发的吸热熵增过程。 (3)通过微观表征进一步表明了F-与HAP中的OH-发生了吸附和离子交换反应,金属离子Fe2+、Mn2+与HAP中的Ca2+发生了物理吸附、以离子交换体现的化学吸附以及与PO43-发生的表面络合反应。 (4)HAP小球5次的吸附再生循环试验,验证了HAP同步去除F-、Fe2+、Mn2+稳定的再生性和可重复利用性。HAP对实际地下水水样的吸附结果均达到《生活饮用水卫生标准》(GB 5749—2006)的要求。

3.3 吸附动力学分析

3.4 比表面积孔隙度分析

3.5 X射线衍射分析

3.6 红外光谱分析

3.7 扫描电镜分析

3.8 吸附机理分析
3.9 羟基磷灰石的再生循环及在实际地下水中的应用


4 结 论


