内蒙古锡林郭勒盟犊牛腹泻大肠杆菌的分离鉴定及药物敏感性试验
王 娜,戴伶俐,乌云塔娜,钢托亚,赵世华,达来宝力格
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;2.呼伦贝尔市新巴尔虎右旗动物疫病预防控制中心,内蒙古 新巴尔虎右旗 021300)
近年来,我国出台了许多畜牧业扶持政策,推动畜牧业迅速发展,牛产业成为畜牧业发展的重点。犊牛群作为牛场的后备力量,其健康与否直接影响牛场的整体经济效益。犊牛腹泻是危害犊牛健康生长的最常见疾病。据文献报道,我国大部分省份的规模化养牛场几乎都有犊牛腹泻发生,给养殖场造成经济损失。
大肠杆菌是引起犊牛腹泻的主要病原,1~3日龄犊牛易感,发病初期常表现为腹泻、脱水、生长缓慢,严重者可致死[1]。2015年新疆4个地区6个养殖场有千余头犊牛因腹泻死亡,发病率高于40%,死亡率高于50%,经实验室检测病原菌为大肠杆菌,大多数菌株携带鞭毛及肠毒素基因[2];2017年1月新疆博乐牛场的30日龄以内的犊牛出现腹泻症状,该牛场犊牛腹泻的发病率为73%,死亡率为35%,并从新鲜的粪便样品中分离到6株大肠杆菌,1株大肠杆菌(XJ-B1)可使小鼠产生腹泻及死亡症状,且XJ-B1为多重耐药菌[3];2017年9月黑龙江某牛场2~14日龄犊牛出现腹泻症状,发病率为5%,死亡率为100%,经实验室诊断该病原为大肠杆菌和A型产气荚膜梭菌[4];2018年河北某牛场犊牛出现腹泻症状,经实验室检测该病原为大肠杆菌[5];2019年内蒙古通辽市某牛场出现犊牛腹泻病,经实验室检测确定病原为大肠杆菌,血清型为O17,且为多重耐药菌[6];2019年赣西某肉牛养殖场的犊牛出现腹泻症状,发病率为60%,经临床和实验室诊断确定该病原为大肠杆菌,该菌对环丙沙星较敏感,治疗后数日无新增病例[7]。
该研究从腹泻犊牛的肛拭子中分离到2株大肠杆菌,并对分离菌进行了鉴定和药物敏感试验,为后期的群体治疗提供了参考依据。
1 材料与方法
1.1 试验材料
1.1.1病料在内蒙古锡林郭勒盟多伦县某养殖场采集2头腹泻犊牛的肛拭子样品2份,装入采样袋,依次编号为XM-GSZ-1、XM-GSZ-2,低温保存。
1.1.2主要试剂伊红美蓝琼脂培养基、麦康凯琼脂培养基购自广东环凯有限责任公司;35种药敏片购自杭州滨和微生物有限责任公司。
1.1.3实验动物体重为25 g健康昆明小鼠18只,由内蒙古大学实验动物中心提供。
1.1.4主要仪器生化培养箱SPX-16B购自吉林省安可有限责任公司;恒温水浴锅SH-WB-6GDN3购自韩国三兴有限责任公司;恒温摇床TS-2112B购自上海比朗仪器制造有限责任公司;涡旋振荡器VM-10购自大韩科学有限公司;PCR仪ABI9902购自美国伯乐有限责任公司;电泳仪HE99X购自美国伯乐有限责任公司;全自动凝胶成像仪购自Type T2A美国伯乐有限责任公司。
1.2 方法
1.2.1细菌分离培养在无菌条件下将肛拭子分别接种于伊红美蓝琼脂培养基、麦康凯琼脂培养基,37℃培养16~24 h,观察菌落形态、颜色及菌体形态。将革兰阴性杆菌菌落转接于LB液体培养基中,37℃培养16~24 h,取1 mL菌液提取基因组,剩余菌液保种。
1.2.2菌株鉴定
1.2.2.1表型鉴定大肠杆菌在伊红美蓝琼脂培养基上为圆形紫黑色大菌落,表面光滑湿润,并有典型的金属光泽;在麦康凯琼脂培养基上为圆形微红色菌落,中心为桃红色,周围呈浑浊圈,表面光滑整齐。
1.2.2.2生理生化鉴定通过硝酸盐还原试验、VP试验、MR试验及糖发酵等试验进行大肠杆菌生理生化鉴定[8]。
1.2.2.316Sr DNA鉴定使用细菌基因组提取试剂盒提取大肠杆菌DNA,-20℃保存。参考文献设计引物27F和1492R[9],送至上海生工生物有限责任公司合成。以27F和1492R为引物进行PCR扩增,PCR反应条件:94℃,5 min;94℃,30 s,55℃,30 s,72℃,90 s,30次循环;72℃,7 min。PCR产物送到上海生工生物有限责任公司测序。使用NCBI或EBI比对序列,利用软件MegAlign构建菌株系统发育树。
1.2.3大肠杆菌分型鉴定参照《食品安全国家标准 食品微生物学检验 致泻大肠埃希氏菌检验》(GB 4789.6—2016)[10]设计大肠杆菌分型引物。
1.2.4小鼠毒力测定挑取纯化菌落接种于3 mL LB液体培养基,37℃培养16~18 h,12 000 r/min离心2 min,弃上清,用0.85%的生理盐水洗菌3次,并将菌浓度调至5×108CFU/mL,腹腔注射200 μL/只。每组6只小鼠,雌、雄各半,观察1周。
1.2.5药敏试验使用35种药敏片进行体外抑菌试验,每种药敏片设置3个重复,参考CLSI(2009)标准进行结果判定[11]。
2 结果与分析
2.1 菌株培养特性
该试验从2份肛拭子中分离到2株大肠杆菌(XM-GSZ-1、XM-GSZ-2),这2株菌株在伊红美蓝琼脂培养基上为圆形紫黑色大菌落(见图1A和图1B),直径1~2 mm,表面光滑湿润,并有典型的金属光泽;在麦康凯琼脂培养基上呈圆形微红色菌落(见图1C和图1D),中心为桃红色,周围呈浑浊圈,直径2~4 mm,表面光滑整齐。
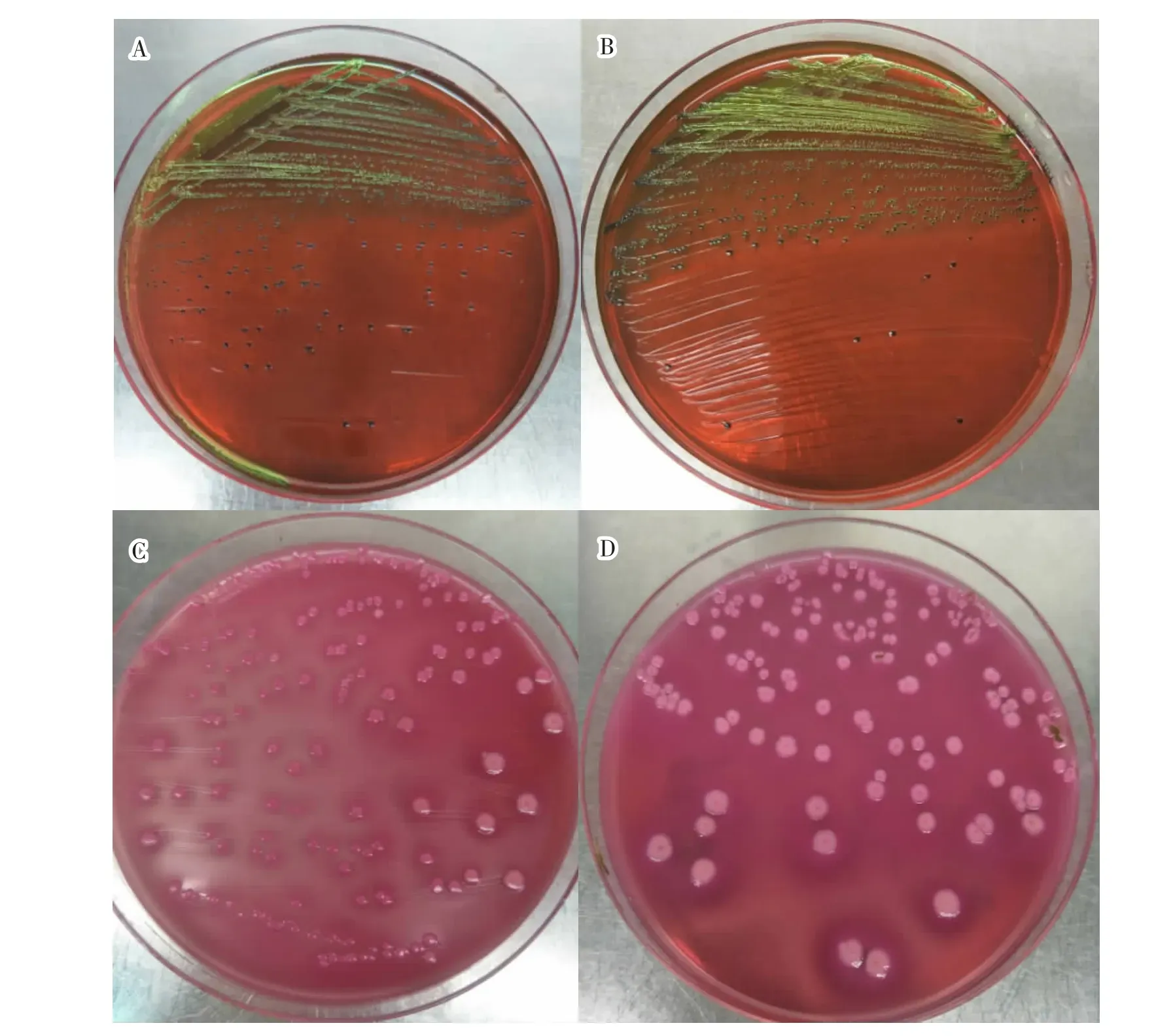
图1 分离菌株菌落形态
2.2 菌株鉴定
2.2.1菌株生理生化鉴定菌株生理生化鉴定严格按照细菌新型生化鉴定管使用说明书进行操作。由表1可知,这2株菌MR试验和硝酸盐还原试验为阳性,VP试验、苯丙氨基酸羧酶试验为阴性,且具有运动性,参照伯杰细菌鉴定手册,这2株菌符合大肠杆菌的理化特性,初步判定为大肠杆菌。

表1 菌株生理生化鉴定
2.2.2菌株16Sr DNA鉴定以菌株XM-GSZ-1和XM-GSZ-2基因组DNA为模板进行PCR扩增,获得1 500 bp的扩增产物(见图2),经上海生工生物有限责任公司测序,通过NCBI比对构建系统发育树(见图3)及进行同源性分析(见图4)。同源性分析可知,分离株XM-GSZ-1与MT649857.1 Escherichia coli stain的相似度为99.2%,与MN094119.1 Escherichia coli strain的相似度为98.4%;XM-GSZ-2与MN094119.1 Escherichia coli strain的相似度为100%,与MT649857.1 Escherichia coli strain的相似度达到99.1%,因此,鉴定这2株菌株为大肠杆菌,且分离的这2株大肠杆菌的同源性为98.1%。
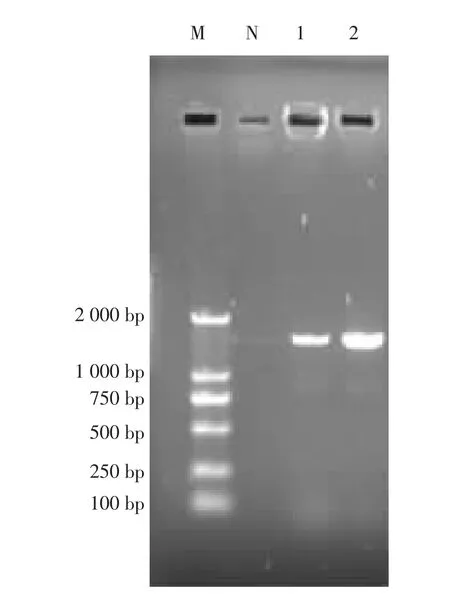
图2 菌株PCR产物扩增电泳图

图3 菌株系统发育树

图4 菌株序列同源性分析
2.2.3菌株大肠杆菌分型引物鉴定由图5可知2株大肠杆菌均含有It基因和stp基因,依据《食品安全国家标准 食品微生物学检验 致泻大肠埃希氏菌检验》(GB 4789.6—2016)[10],确定该2株腹泻大肠杆菌为ETEC型(产肠毒素大肠埃希菌)。

图5 菌株ETEC分型引物扩增电泳图
2.3 小鼠毒力鉴定
攻毒后12 h,小鼠精神呆滞,被毛粗乱,呼吸困难。菌株XM-GSZ-1试验组在攻毒后14 h有2只小鼠出现死亡,菌株XM-GSZ-2试验组在攻毒后12 h有2只小鼠死亡,72 h内12只小鼠全部死亡,对照小鼠未出现任何临床症状,因此,判定这2株大肠杆菌为强毒株。
2.4 体外药敏试验
体外药敏试验显示(见表2),这2株菌对氨苄西林、氨曲南、头孢唑啉、四环素、氧氟沙星、左氧氟沙星、复方新诺明等21种药物表现为耐药;对头孢哌酮、头孢曲松、克林霉素、多黏菌素B、米诺环素等10种药物表现为中度敏感;对头孢西丁、万古霉素、环丙沙星及呋喃妥因4种药物表现为敏感。
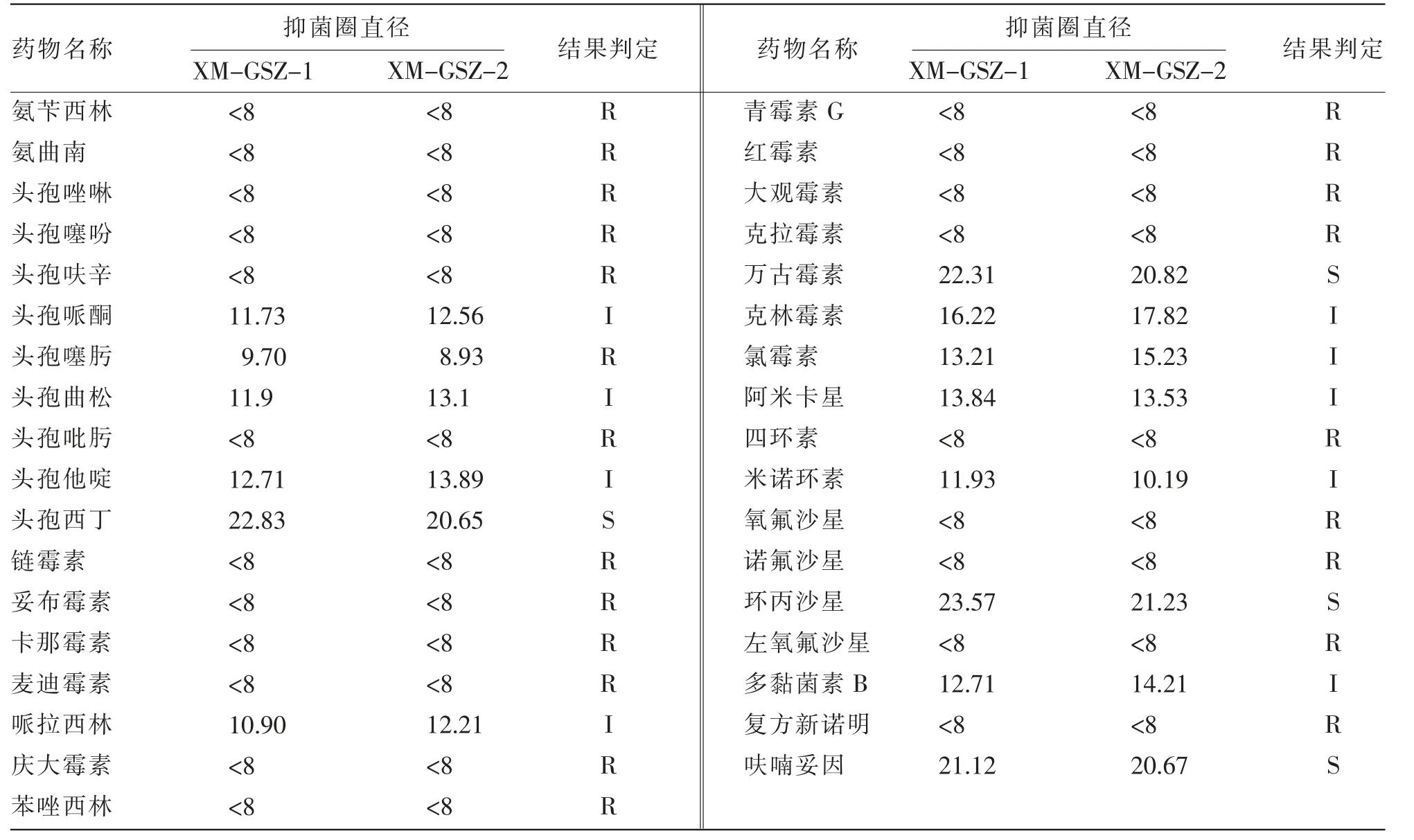
表2 分离菌株体外药敏试验结果 单位:mm
3 讨论
该试验通过菌株分离培养、生理生化试验及分子生物学技术确定该菌为大肠杆菌。根据《食品安全国家标准 食品微生物学检验 致泻大肠埃希氏菌检验》(GB 4789.6—2016)[10]确定分离菌株为产肠毒素致病性大肠杆(ETEC)。ETEC是一种常见的引起人畜腹泻的致病性大肠杆菌,且是养殖场腹泻的最常见病原菌[12]。研究发现,ETEC主要依靠菌毛定殖于肠道黏膜,然后经肠毒素的作用,使肠道产生炎症损伤,宏观症状为肠黏膜完整性被破坏,微观症状为肠黏膜上皮细胞脱落、白细胞等炎症细胞明显增加,从而引发犊牛腹泻脱水,对犊牛的生长发育造成不利影响,严重者可致死[13-14]。另外,也有研究表明ETEC感染幼畜的严重程度常取决于日龄、自身状况、生活及饮食环境等,食物传播是主要的传播途径,犊牛因误食污染的草料、水等引发感染[15]。有研究表明,新生犊牛出生12 h内,推迟摄取初乳,会减少IgG在机体的被动转移,能延迟肠内细菌的定植,使犊牛断奶前免受致病菌感染[16]。
考虑养殖场滥用抗生素的实际情况,细菌极可能产生耐药性,所以该试验设计体外药敏试验。分离菌株对21种药物表现为耐药性,对头孢西丁、万古霉素、环丙沙星及呋喃妥因4种药物表现为敏感,临床治疗过程中,使用环丙沙星能获得较好的效果。

