红花草莓FamiR156a及其靶基因FaSPL13A的克隆与表达分析
岳静宇,刘 明,雷家军,薛 莉
(沈阳农业大学园艺学院,沈阳110161)
草莓为蔷薇科(Rosaceae)草莓属(Fragaria)多年生草本植物,是世界上重要的浆果类果树作物之一,其果实中含有丰富的维生素和人体必需的矿质元素,具有较高的营养价值和经济价值,被誉为“水果皇后”。草莓属植物均开白花,红花草莓是利用开白花的栽培草莓(F.×ananassa)与开红花的沼委陵菜(Potentillapalustris)远缘杂交而获得的[1],由于其花瓣呈现红色系的多种不同颜色而增强了观赏性[2-3]。目前有关草莓的花青苷合成和转录调控已经进行了大量的研究,花青苷是红花草莓花瓣和果实的主要呈色物质[4-5]。杨肖芳等[6]证实了越心草莓组培苗突变体调控花青苷合成途径的关键基因是FaMYB10和FaMYB1,其表达发生显著下调使花青苷积累显著减少而导致草莓果实着色变浅。XUE等[7]研究表明,红花草莓果实中积累的色素化合物与栽培草莓果实一致,FpANS、FpBZ1和FpUGT75C1基因是导致红花草莓杂交后代中白色花瓣中花青苷缺失的重要因子,同时,FpFLS和FpDFR基因的相互作用可能会进一步抑制花青苷的合成。miRNAs是转录后水平参与花瓣花青苷的合成,但在红花草莓花瓣着色过程中有哪些miRNAs参与,还未见报道。
植物miRNA由非编码核基因转录而来,是一类内源性非编码小RNA,长度为20~24nt,是生物体内各种生理过程的一种重要调控因子,miRNAs通过转录后水平上的负调控作用,在植物发育调控、逆境应答、信号转导及激素调节等方面发挥关键调节作用。研究表明,miRNAs可以通过其靶基因来调控花色和花青苷的积累。在拟南芥中,miRNAs参与拟南芥花青苷的生物合成,miR156可以通过定向切割拟南芥和水稻中的SPL转录本来负调控花青苷的积累[8-9];在杨树中,过表达miR156b的转基因植株,其花青苷、黄酮和黄酮醇的含量比野生型显著上升[10]。红花草莓是一种可食用的观赏花卉,花色是其重要的观赏性状。近年来,深度测序及生物信息学的迅速发展,为解析花色形成的分子机理提供了研究手段,这对加快我国红花草莓分子育种进程具有较大的理论和实践意义。本研究基于第二代高通量测序技术开展miRNAs和降解组测序研究,筛选到可能调控红花草莓花色形成的差异FamiR156s和靶基因。在此基础上,进行生物信息学分析、基因克隆和时空表达模式分析,以期为miRNAs调控红花草莓花色提供理论依据。
1 材料与方法
1.1 材料
试材取自沈阳农业大学草莓资源圃,以本课题组自育的红花草莓品种四季红为试验材料。红花草莓花蕾发育可以划分为3个阶段,随着花蕾的发育,花瓣颜色逐渐加深。幼蕾期(L)萼片闭合,花瓣浅白色;转色期(Z)萼片微开,花瓣显现并开始着色;大蕾期(D)萼片张开,花瓣闭合但颜色最深。所有样品经过液氮冷冻处理后,存放于-80℃冰箱中保存备用。
1.2 方法
1.2.1 红花草莓FamiR156a及靶基因序列的获取 从红花草莓四季红花蕾发育不同时期的miRNA测序和转录组数据库,筛选得到红花草莓不同花蕾发育阶段差异表达的miRNA家族并下载其成熟体和前体序列;基于红花草莓花瓣发育阶段的降解组数据库,分析这些差异表达的miRNAs可能的靶基因。
1.2.2 核酸提取及cDNA的合成 利用植物基因组DNA快速提取试剂盒(Aidlab)提取红花草莓基因组DNA,应用改良CTAB法提取红花草莓样品的总RNA[11]。用1%琼脂糖凝胶电泳鉴定核酸是否有降解,超微量核酸测量仪(Nanodrop 2000c spectrophotometer,Thermo scientific)检测核酸浓度及质量(OD260/OD280和OD260/OD230),最终确定所需的RNA及DNA的完整性。以提取的总RNA为模板,分别利用miRNA和基因反转录试剂盒miRNA 1st Strand cDNA Synthesis Kit(by stem-loop)(Nazyme,MR101-01/02)和HiScript®Ⅲ1st Strand cDNA Synthesis Kit(+gDNA wiper)(Nazyme,R312-01)对筛选出的FamiR156a及其相应靶基因FaSPL13A进行反转录,用于克隆和时空表达模式分析。
1.2.3 克隆及过表达载体构建 根据测序数据得到的FamiR156a的成熟体序列和前体序列,以及FaSPL13A基因全长序列,利用诺唯赞官网小程序软件(CEDesign 1.04),分别设计全长引物,酶切位点选择BamH1和Sal1(表1)。

表1 试验所用引物序列Table 1 The sequence of the primers used in this study
克隆用试剂盒为PrimeSTAR®HS(Premix)(TAKARA),FamiR156a前体克隆以DNA为模板,靶基因FaSPL13A克隆以cDNA为模板。FamiR156a前体克隆体系为Premix 25μL,ddH2O21μL,FamiR156-F(10μmol·L-1)1.5μL,FamiR156-R(10μmol·L-1)1.5μL,DNA 1μL(<200ng),PCR扩增程序为98℃10s、57℃5 s、72℃7s,30个循环;靶基因FaSPL13A克隆体系为Premix 25μL,ddH2O 21μL,FaSPL13A-F(10μmol·L-1)1.5μL,FaSPL13A-R(10μmol·L-1)1.5μL,cDNA 1μL(<200ng),PCR扩增程序为98℃10s、57℃5 s、72℃75s,30个循环。将得到的目的片段切胶,胶回收试剂盒FastPure®Gel DNA Extraction Mini Kit纯化(购自Nazyme,DC301),-20℃备用。
以pRI 101-AN为原始载体,质粒提取试剂盒EasyPure®Plasmid MiniPrep Kit(购自TransGen Biotech,EM101)提取质粒,-20℃备用。FlyCut®BamH1/FlyCut®Sal1(购自TransGen Biotech)双酶切重组质粒。FlyCut Buffer使用前充分混匀,50μL体系:FlyCut Buffer 5μL,质粒DNA<2μg,BamH1 1μL,Sal1 1μL,加ddH2O至50μL。PCR控温:37℃15min;加5μL 10×Loading Buffer终止反应并用移液枪吸打混匀,瞬时离心后,1%琼脂糖凝胶电泳15min,1μL质粒加1μL 6×Loading Buffer作为对照,将位置正确的条带进行切胶回收纯化。
选择PEasy®-Basic Seamless Cloning and Assembly Kit(购自TransGen Biotech,CU201)将目的片段与线性载体连接,并转化到大肠杆菌Trans1-T1感受态细胞中。待长出单菌落后,随机挑取菌点进行阳性克隆检测,根据琼脂糖凝胶电泳结果将位置正确且明亮的条带对应的菌液37℃,200r·min-1过夜培养,摇菌后进行半定量检测,选择明亮条带对应的菌液于生工生物工程(上海)股份有限公司进行测序,Marker为北京全式金生物技术有限公司Trans 2K®DNA Marker。
1.2.4 FamiR 156a及FaSPL13A序列分析 在sRNAanno(http://www.plantsrnas.org/)[12]上获取其他物种miR156s的前体序列信息,通过NCBI获取其他物种上SPL13A的氨基酸序列,与本试验测序获得的序列信息一起利用TBtools[13]进行序列比对及系统进化树的构建,分析它们的结构及功能。
1.2.5 实时荧光定量分析 利用Primer 3 Web(https://primer3.ut.ee/)在线设计靶基因定量引物,miRNA design V1.01软件设计miRNA反转录茎环引物及定量引物(表1),通过琼脂糖凝胶电泳检测引物特异性。靶基因实时荧光定量试剂盒为ChamQUniversal SYBR qPCR Mastter Mix(购自Nazyme,Q711),选择FaDBP为内参基因[7];miRNA实时荧光定量试剂盒为miRNA Universal SYBR®qPCR Mastter Mix(购自Nazyme,MQ101-01/02),以U6为miRNA内参。qRT-PCR设置3次重复,幼蕾期花瓣为对照,采用2-ΔΔCt方法计算相对表达量。
1.2.6 冻融法农杆菌GV3101转化 利用DNAMAN8.0对测序结果进行比对,选择测序结果正确的菌液,进行质粒DNA农杆菌GV3101感受态细胞(购自TransGen Biotech)的转化。待出现单菌落后,挑菌划线进行二转,二转的菌落出现后进行菌液PCR检测。
2 结果与分析
2.1 测序数据筛选
根据红花草莓花蕾发育阶段转录组和降解组测序分析,发现了差异表达的4个SPL基因为miR156s的靶基因,包括FvH4_4g29640.1(图1A)、FvH4_4g23650.1(图1B)、FvH4_6g26530.1(图1C)和FvH4_5g08580.1(图1D)。相同的靶基因可能被不同的miRNAs调控,不同miR156s成员与SPLs的表达趋势不同(图2),FvH4_4g29640.1可能被8种差异的miRNA156s调控,但大部分miRNA156s与SPL靶基因表达趋势相同(图2A、图2B和图2C),只有FvH4_5g08580.1(FaSPL13A)与其对应的4个miR156s成员(ath-miR156a-5p_L+2、ppe-miR156f-5p_L+1、ppe-miR156c、mdm-miR156a等为相反关系对)(图2D)。而且FvH4_5g08580.1降解组质谱图的峰值高、波峰位置与mdm-miR156a预测的剪切位点一致(图1D)。基于此,本研究筛选mdm-miR156a与FaSPL13A(FvH4_5g08580.1)进行克隆与表达分析。
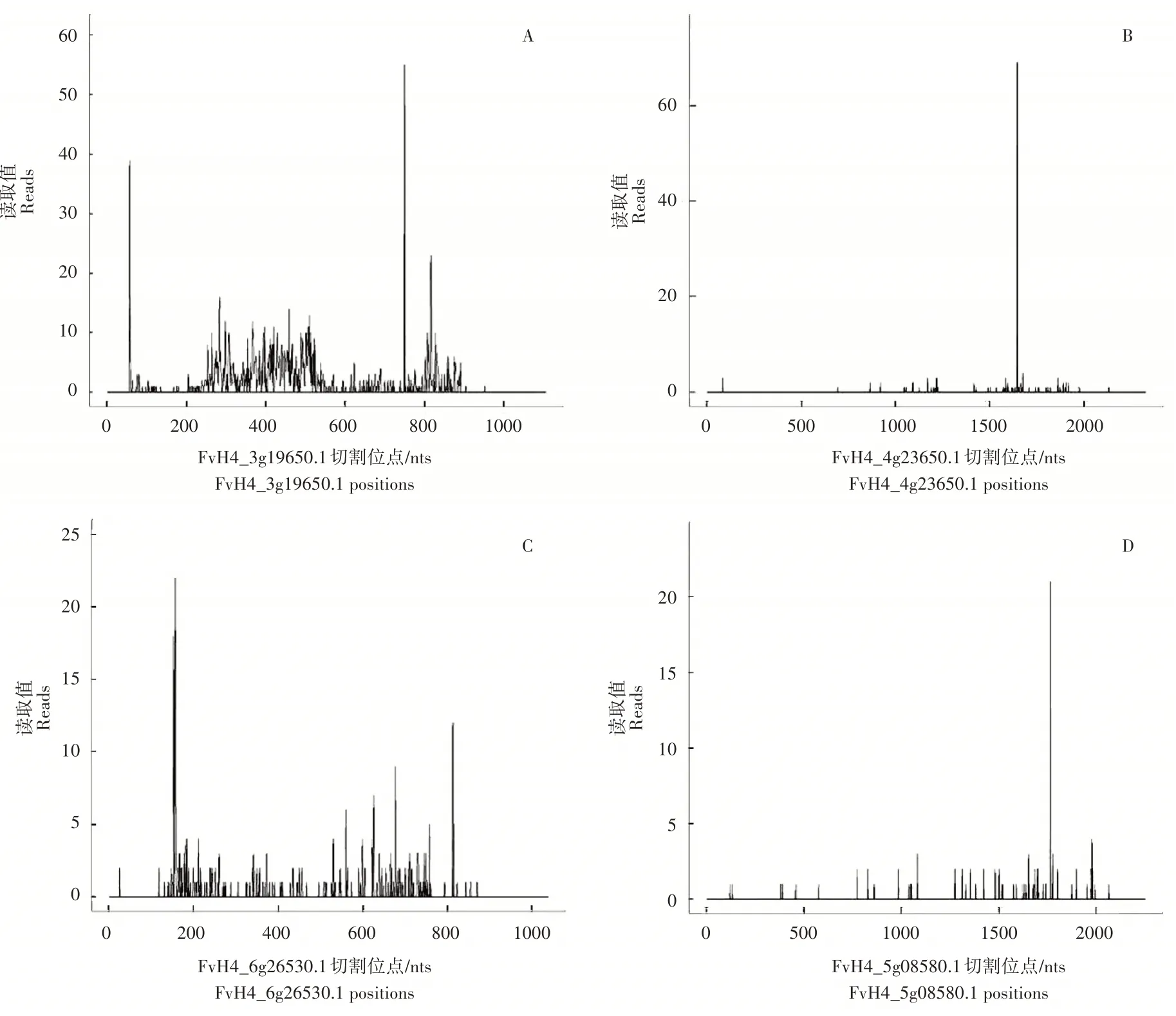
图1 降解组测序mdm-miR156a介导的SPL基因T-plot示意图Figure 1 T-plot indicating the cleavage events mediated by mdm-miR156a in SPL genes based on degradome sequencing
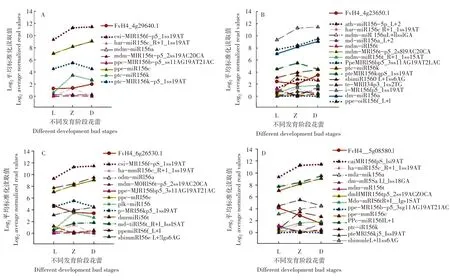
图2 4个差异SPL基因与不同miR156s成员的表达趋势Figure 2 The regulation trend of four SPL genes associated with miR156s
2.2 pre-FamiR156及FaSPL13A编码区的克隆及序列分析
基于miRNA测序结果得到FamiR156a 104 bp的前体序列,序列信息为:CGGATCCTGGGGTGACAGATAG AGAGTGAGCACGCAAAGCTTCGAGCATGAAACACAGCATGCAAGAAAACACCATGTGTGCACACTCTCTTCTGT CACCTCC。基于降解组测序结果和NCBIORFfinder得到FaSPL13A基因长度为1236 bp的编码区序列。
将双子叶植物表达载体pRI 101进行质粒的提取及双酶切,得到纯化后的线性载体,并与克隆得到的线性片段一起进行连接转化到大肠杆菌感受态细胞中,暗培养至长出单菌落,挑菌进行阳性克隆检测(图3 A和图3 B),琼脂糖凝胶电泳结果鉴定条带位置正确,过夜摇菌后再进行一次菌液PCR,选择条带明亮且位置正确的菌液测序,测序结果序列一致,表明过表达载体构建完成可用于农杆菌转化,农杆菌转化阳性克隆检测琼脂糖凝胶电泳条带明亮(图3C),位置正确,能够用于后续的遗传转化试验。
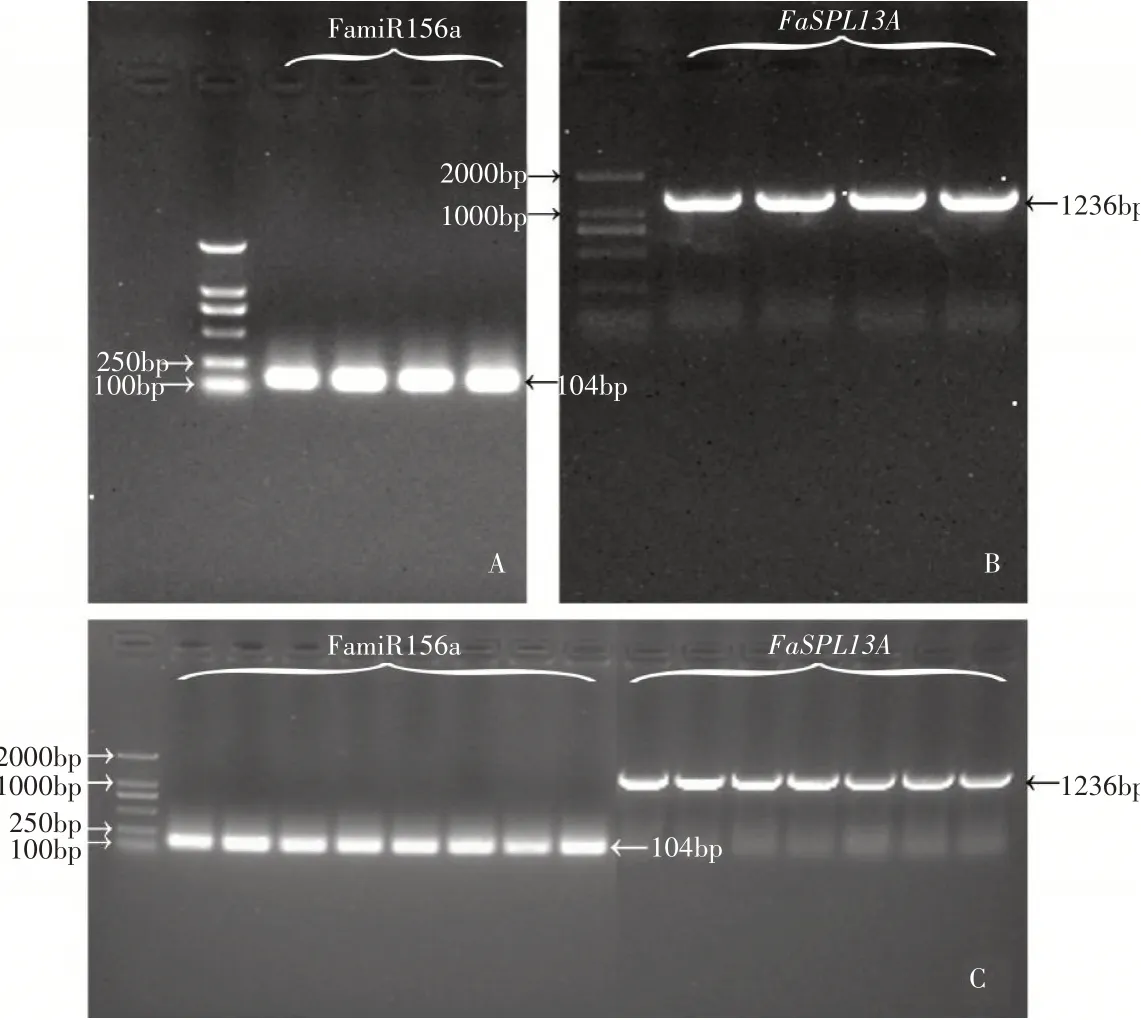
图3 琼脂糖凝胶电泳阳性克隆检测Figure 3 The results of positive clone detection by agarose gel electrophoresis
2.3 红花草莓FamiR156-FaSPL13多序列比对及系统进化树的构建
利用TBtools软件进行多序列比对并采用最大似然法(maximum likeihood method,ML),对红花草莓FamiR156a前体序列和FaSPL13A的氨基酸序列与其他植物一起进行系统进化树的构建。多序列比对修剪后输出结果表明,FamiR156a前体序列与其他不同物种相似性为46.68%,与蔷薇科的苹果、桃同为一个分支,这也佐证了FamiR156a的前体克隆得到的序列是可靠的(图4A)。FaSPL13A的氨基酸序列与其他物种同源序列相似程度为54.64%,由进化树结果可知,红花草莓与森林草莓和月季聚类在同一小分支上,说明它们同源性更高,也进一步证明了红花草莓FaSPL13A基因克隆的正确性(图4B)。
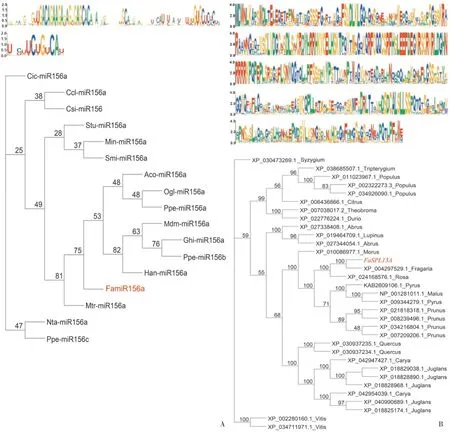
图4 不同物种中miR156s前体序列(A)及SPL13A的同源氨基酸序列(B)的多序列比对及系统进化树Figure 4 Multiple sequences alignment and phylogenetic tree of different species via miR156s precursor sequences(A)and the SPL13A homologous amino acid sequences(B)
2.4 红花草莓FamiR156a-FaSPL13A时空表达模式分析
转录组及降解组测序结果可知,随着红花草莓花蕾的生长发育,花瓣颜色逐渐加深,从幼蕾期、转色期到大蕾期,FamiR156a的表达量逐渐升高,而FaSPL13A的表达呈下降趋势(图5),经过qRT-PCR验证,红花草莓花瓣3个发育阶段的表达量趋势与测序结果一致,说明在红花草莓花瓣呈色进程中,FamiR156a负调控其靶基因FaSPL13A的表达。
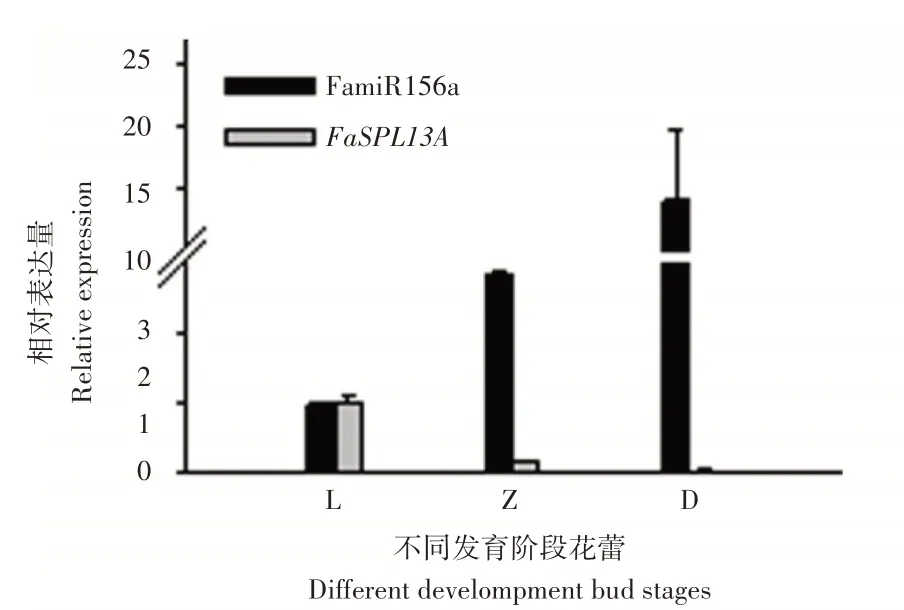
图5 花蕾不同发育阶段的花瓣qRT-PCR趋势Figure 5 The petal expression trends of qRT-PCR at different developmental bud stages
3 讨论与结论
本研究基于高通量miRNA和降解组测序数据,筛选到了差异的miR156s和对应的差异表达的靶基因SPLs。通过对这些差异互作的miR156-SPLs进行表达模式趋势分析,筛选到了呈相反关系的FamiR156a-FaSPL13A。将获得的FamiR156a及其靶基因FaSPL13A进行克隆,构建完成了过表达pRI-101-AN-FamiR156a及pRI-101-AN-FaSPL13A载体,用冻融法转化农杆菌GV3101感受态细胞,经抗生素筛选及阳性克隆检测,目的片段位置及序列长度正确,可用于后续的遗传转化研究,从而为阐明红花草莓花瓣花青苷合成调控机理奠定分子基础。
目前关于红花草莓花色形成相关的miRNAs的研究还尚未见报道。本研究基于测序结果的生物信息学分析及本课题组前期成果,克隆到了可能调控红花草莓花青苷合成的FamiR156a及靶基因FaSPL13A编码区序列,并构建了过表达载体,为进一步确立miRNA转录后水平调控红花草莓花色奠定了基础。前人研究表明,作为植物中一个保守miRNA家族成员,miR156s能够靶向SPLs基因调节植物发育的各个方面,在植物发育中起着重要作用[14-16]。miR156和SPL基因的不同家族成员已被确定[17-18],miR156的丰度表现出组织特异性[18-19],作为一种进化上高度保守的植物miRNA,与靶基因SPL共同调节植物开花过程中花青苷的积累。
目前,已发现苹果中15个SPL家族成员和柑橘中10个SPL基因家族成员为miR156s的假定靶点[20-22]。将柑橘中的CiSPL5基因过表达,转化拟南芥促进了其转基因植株的开花[21],csimiR156a通过抑制靶基因CsSPL来促进柑橘的外植体体细胞胚的发生[23-24]。miR156对AtSPL13的抑制对于拟南芥从子叶期到营养叶期的正常萌发后转换至关重要[25]。LcSPL1可以与荔枝(LitchichinensisSonn.)中花青苷生物合成的关键调控基因Lc-MYB1相互作用负调控花青苷的生物合成,而miR156a在荔枝果实着色过程中差异表达,随着果实颜色加深其表达量逐渐升高,其靶基因LcSPL1表达量降低,也证实了miR156-SPL在荔枝花青苷合成中起调节作用[26]。

