CmWRKY15-1启动子的克隆及功能验证
付雨涵,张 新,金芮冰,毛洪玉
(沈阳农业大学林学院,沈阳110161)
随着我国花卉事业不断的发展,许多病害也在大面积传播和蔓延,其中菊花白色锈病危害严重,传播迅速,严重影响菊花的观赏和生产价值[1-2],利用基因工程技术改良菊花抗病性可有效解决菊花白色锈病的危害。WRKY蛋白参与生长发育过程,如胚胎发生、毛状体发育、衰老以及植物对各种生物和非生物胁迫的反应,其在植物抗逆过程中起重要作用,被认为是N端含有WRKYGQK组成的高度保守序列[3]。前期研究表明,WRKY是SA诱导系统获得抗性信号转导的重要转录因子,NPR1也处于SA信号转导途径、植物病原菌互作通路的重要部分[4]。因此,在SA通路中WRKY可能依赖于NPR1起作用[5]。
有许多方法可以用来探索已知序列的侧翼序列,如反向PCR[6]、TAIL-PCR[7-8]、接头PCR[9]等。其中,TAILPCR操作简单、效率高并且对已知序列的要求少,所以这种方法被广泛用于启动子的克隆、T-DNA插入位点的鉴定[10]。目前,通过改进提出了一种更高效的HiTAIL-PCR,它可以抑制非特异产物和小片段的产生,并且通过试验成功率在90%以上[11]。
本课题组前期研究表明,CmWRKY15-1基因在菊花受堀氏菊柄锈菌侵染后上调表达,与菊花白色锈病的抗病性显著相关,在超表达转基因植株中,增强了植株的抗病性,而沉默植株中SA通路相关抗病基因的表达则受到了抑制[12-13],但其分子机制还不清楚。因此,本研究通过HiTAIL-PCR技术克隆出CmWRKY15-1基因上游侧翼序列,通过GUS染色和接菌处理表明CmWRKY15-1基因启动子具有很强病原菌诱导活性,并通过酵母单杂技术验证NPR1与CmWRKY15-1启动子之间的调控关系,为探究CmWRKY15-1的抗病机制提供相关理论依据。
1 材料与方法
1.1 材料与试剂
菊花抗病品种C029无菌苗由林学院组培室提供。植物表达载体pCAMBIA1301由沈阳农业大学林学院孙晓梅教授惠赠;La taq聚酶、10×Buffer II(MgCl2plus+)、dNTP、各种限制性内切酶、T4连接酶及根癌农杆菌EHA105均购于Takara公司;克隆载体pEASY-T1 SimpleCloning Kit和感受态细胞Trans-T1 Phage Chemically Competent Cell购于万泽有限公司。
酵母单杂所用诱饵载体pAbAi、猎物载体pGADT7购于淼灵质粒平台;Y1H Gold酵母感受态购于北京梓熙有限公司;金担子素及各种培养基购于酷莱博有限公司;Matchmaker Insert Check PCRMix 1购于Takara公司。
1.2 CmWRKY15-1启动子的克隆及生物信息学分析
利用HiTAIL-PCR技术步移CmWRKY15-1启动子序列,根据YAO等[11]设计侧翼引物(表1),HiTAIL-PCR分为3轮扩增,预扩增、第1轮PCR、第2轮PCR。将最后一轮PCR产物连入克隆载体上,转入大肠杆菌,测序验证。将获得的序列通过Plant CARE和PLACE软件进行分析[14-15]。

表1 CmWRKY15-1启动子序列扩增引物及载体构建所需引物Table 1 Primers for CmWRKY15-1 promoter amplification and vector construction
1.3 植物表达载体的构建
以菊花C029为模板,设计3对启动子5’端缺失的短截体引物(表1),分别为677bp、1182bp、1485bp。利用PCR将上述CmWRKY15-1基因启动子上游引入KpnI,下游引入NcoI。然后,通过T4连接酶将其连入用KpnI/NcoI酶切后的pCAMBIA1301骨架上,构建CmWRKY15-1启动子控制GUS报告基因表达的表达载体,命名为pCmWRKY15-1::GUS-1、pCmWRKY15-1::GUS-2、pCmWRKY15-1::GUS-3。然后利用农杆菌介导法分别将三个载体质粒转入EHA105农杆菌中,菌液进行PCR验证。
1.4 菊花C029的瞬时遗传转化
菊花C029的瞬时遗传转化参照高歌等[16]的方法进行。将含有pCmWRKY15-1::GUS-1、pCmWRKY15-1::GUS-2、pCmWRKY15-1::GUS-3质粒的农杆菌培养到OD600=0.8~1.0,用离心后收集的菌体重悬制备侵染液(1mmol·L-1MgCl2,10mmol·L-1MES,200μmol·L-1AS),用此菌液侵染菊花C029的组培苗60min,后暗培养3d,鉴定转基因阳性植株。
1.5 GUS组织化学染色
将鉴定后的转基因植株,在沈阳农业大学后山林学院基地进行接菌处理,分别在病原菌诱导0,24,48,72h对菊花叶片进行GUS染色,37℃浸泡过夜。然后用无水乙醇对其脱色,更换2~3次直到叶片完全脱色,并进行观察拍照。
1.6 诱饵载体的构建
将CmWRKY15-1基因启动子序列分为两段,分别构建诱饵载体。根据启动子序列设计两对引物(表2),利用PCR将两段启动子上游引入SacI,下游引入Xhol。然后将其分别插入SacI/Xhol酶切过后的pABAi载体骨架上,转化大肠杆菌DH5α,提取质粒酶切验证,阳性克隆送测。将其命名为pCmWRKY15-1-AbAi-1、pCmWRKY15-1-AbAi-2。
1.7 Y1HGold酵母菌株的构建
用BstBI单酶切pCmWRKY15-1-AbAi-1、pCmWRKY15-1-AbAi-2及阳性对照质粒p53-AbAi。把线性化的载体分别转入Y1HGold酵母感受态中,转化后的菌液涂在SD/-Ura缺陷培养基上,30℃倒置培养3~5d。待长出菌落后,挑取少量用Matchmaker Insert Check PCR Mix1进行阳性菌落的鉴定。
1.8 诱饵酵母中报告基因本底表达水平的测定
在SD/-Ura缺陷培养基上挑取pCmWRKY15-1-AbAi-1、pCmWRKY15-1-AbAi-2诱饵克隆和阳性对照克隆,分别加入0.9%NaCl中进行重悬并稀释OD600到0.002。把稀释好的菌液涂布在ABA浓度为0,100,200,500ng·mL-1的SD/-Ura缺陷培养基上,30℃倒置培养3~5d。
1.9猎物载体p GADT7-CmNPR1的构建
根据转录组数据库[13]设计引物(表1),利用PCR将CmNPR1上游引入BamHI,下游引入EcoRI。然后将其分别插入BamHI/EcoRI酶切过后的pGADT7载体骨架上,转化大肠杆菌DH5α,提取质粒酶切验证,阳性克隆送测。
1.10 p GADT7-NPR1猎物载体共转化入诱饵菌株制作的感受态
将p53-AbAi空载,pCmWRKY15-1-AbAi-1与pCmWRKY15-1-AbAi-2制作成感受态,然后将猎物载体pGADT7-CmNPR1通过共转化的方法转入诱饵菌株制作的感受态,将转化好的菌液涂布在SD/-Leu固体培养基上(ABA浓度为200ng·mL-1),30℃倒置培养3~5d。
2 结果与分析
2.1 CmWRKY15-1基因上游启动子序列的扩增
根据CmWRKY15-1的DNA序列设计3条特异性引物与4条通用引物进行3轮PCR扩增。第1轮预扩增4对引物均无条带,第2轮、第3轮扩增只有mLAD3引物有清晰的条带,且条带位置符合3rd PCR产物比2nd PCR产物稍短(图1)。将第3轮mLAD3引物扩增的条带进行切胶回收,胶回收后与pEASY-T1 Simple Cloning Kit连接,转化大肠杆菌T1感受态,进行菌液PCR验证,挑选阳性克隆,均测序成功。

图1 HiTAIL-PCR扩增产物Figure 1 The amplification product of HiTALL-PCR
2.2 CmWRKY15-1启动子的顺式作用元件分析
通过HiTAIL-PCR的方法得到了CmWRKY15-1的启动子序列1485bp,通过软件分析,其中除了含有CAAT-box和TATA-box启动子必备核心元件、脱落酸响应元件ABRE、MYB识别元件等,还包含了许多与植物抗逆有关重要元件如病原菌诱导元件W-box、GT1-motif、防御应激元件TC-rich repeats、SA诱导元件As1/ocs(图2),这说明CmWRKY15-1基因在逆境胁迫中可以发挥作用,并且响应病原菌的诱导。

图2 CmWRKY15-1基因启动子作用元件分析Figure 2 The cis-acting element analysis of CmWRKY15-1 gene promoter
2.3 CmWRKY15-1启动子控制GUS基因的表达载体构建
以菊花C029的DNA序列为模板,克隆CmWRKY15-1基因启动子3段5’端缺失短截体,分别为677,1182,1485bp(图3)。用这3段启动子序列分别替换pCAMBIA1301的35S启动子序列,构建pCmWRKY15-1::GUS-1、pCmWRKY15-1::GUS-2和pCmWRKY15-1::GUS-3植物表达载体。

图3 CmWRKY15-1基因启动子序列3段的5’端短截体Figure 3 The 5′-end short truncation of the three segments of the promoter sequence of CmWRKY15-1 gene
2.4 CmWRKY15-1启动子的表达分析
利用瞬时遗传转化的方法将pCmWRKY15-1::GUS-1、pCmWRKY15-1::GUS-2和pCmWRKY15-1::GUS-3这3个植物表达载体转化到菊花C029上,分别获得了3种转基因植株。当病原菌诱导0h时,用GUS染色液对这3种转基因植株进行染色,可以看出基本没有蓝色出现;当病原菌诱导48h时,叶片上的蓝色面积最大且颜色深,而72h时蓝色变浅。说明在病原菌诱导48h时,启动子的活性最高(图4)。还可以看出,pCmWRKY15-1::GUS-3转基因植株无论在哪个时间点出现蓝色都最多,其次是pCmWRKY15-1::GUS-2,最少的是pCmWRKY15-1::GUS-1,这说明启动子越长,活性越大。在病原菌诱导前后,菊花野生型叶片均没有蓝色出现。

图4 CmWRKY15-1启动子病原菌诱导表达特性的GUS组织化学染色分析Figure 4 GUShistochemical staining analysis of CmWRKY15-1 promoter pathogenic bacteria inducible expression characteristics
2.5 诱饵酵母菌株的获得
将CmWRKY15-1启动子根据所含顺式作用元件分为两部分,以菊花C029 DNA为模板,克隆出677bp和808bp的条带,将其分别构建诱饵载体。将构建好的诱饵载体分别用SacI和Xhol进行双酶切,分别得到两条与预期相符的条带(图5A和图5B),且测序结果与CmWRKY15-1启动子比对相同,说明诱饵载体pCmWRKY15-1-AbAi-1、pCmWRKY15-1-AbAi-2构建成功。将构建成功的诱饵载体用BstBI进行线性化,胶回收产物转入Y1HGold酵母感受态中,吸取100μL的菌液在SD/-Ura的缺陷培养基上涂板,30℃培养3~5d,并对长出的单菌落进行菌落PCR验证。由图5C可知,对转入片段为677bp启动子序列的酵母菌株进行菌落PCR,结果为1.35kb+677bp,即2027bp;转入片段为808bp启动子序列的菌落PCR结果为1.35kb+808bp,即2158bp,这表明成功获得诱饵酵母菌株。

图5 诱饵载体酶切鉴定及诱饵菌株PCR鉴定Figure 5 identification of Bait Vector by restriction enzyme digestion and identification of Bait strain by PCR
2.6 金担子素的抗性筛选
挑取上述两种菌株的阳性酵母菌落,用0.9%NaCl液体重悬细胞,直至OD600到0.002。将重悬后的菌液涂布在ABA浓度达到200ng·mL-1的培养基上时,无菌落长出,可以彻底抑制酵母菌株的生长(图6),所以后续互作试验时金担子素的浓度为200ng·mL-1。

图6 本底水平表达Figure 6 Background level expression
2.7 猎物载体的构建
以菊花C029的cDNA为模板,克隆出CmNPR1基因序列1600bp,插入pGADT7载体上,构建pGADT7-CmNPR1猎物载体。将构建好的猎物载体重组质粒用BamHI和EcoRI进行双酶切后获得1600bp的小片段和约5700bp的大片段(图7),且测序结果与CmNPR1的目的序列相符合,说明猎物载体pGADT7-CmNPR1构建成功。
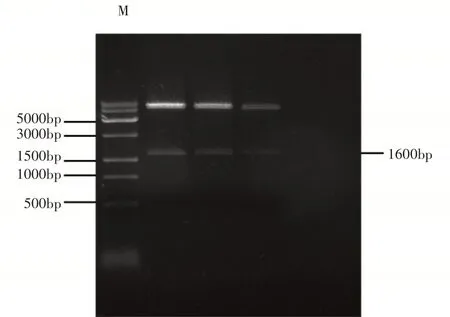
图7 猎物载体酶切鉴定Figure 7 Restriction digestion identification of prey vector
2.8 CmNPR1与CmWRKY15-1启动子之间的调控关系
将猎物载体pGADT7-NPR1共转化入pCmWRKY15-1-AbAi-1与pCmWRKY15-1-AbAi-2及阳性对照诱饵菌株中在含有200ng·mL-1ABA的SD/-Leu培养基中培养,3~5d后pCmWRKY15-1-AbAi-1与pCmWRKY15-1-AbAi-2与猎物载体共转化培养基均有菌落长出(图8),这表明CmNPR1与CmWRKY15-1启动子之间存在调控关系。

图8 诱饵载体与猎物载体共转化示意图Figure8 Co-transformation of bait vector and prey vector
3 讨论与结论
由堀氏菊柄锈菌引起的菊花白色锈病是在世界范围内危害菊花最严重的病害之一,其最经济有效的防治方法就是发掘抗性基因、培育抗性品种[17-18]。越来越多的研究表明,WRKY转录因子在植物受到各种胁迫的环境中进行转录调节。WRKY转录因子可以通过复杂的基因网络在SA、JA等通路上调节多种生物功能,包括病原体触发免疫的受体、特异性相互作用的染色质调节剂和信号传递等[19-21]。前期研究表明CmWRKY15-1通过影响SA信号在菊花抗白色锈病中起重要作用,是一个正调控转录因子,并且我们通过RNA-Seq获得差异表达基因NPR1,它是SA通路上一个重要的候选基因,在对CmWRKY15-1沉默后NPR1的转录水平也显著降低[12-13]。
HiTAIL-PCR技术与传统的TAIL-PCR相比获得的片段特异性更高且都是大片段,成功率达到了90%以上,现应用也更加广泛[22-23],陈红运等[24]通过HiTAIL-PCR技术获得转基因木瓜的侧翼序列,张顺仓[25]通过热不对称PCR克隆了木聚糖酶基因。本研究通过HiTAIL-PCR技术克隆了CmWRKY15-1的启动子,通过软件分析在CmWRKY15-1的启动子中发现了一个与NPR1互作的SA诱导元件As1/ocs[26-28],GUS染色可以看出CmWRKY15-1启动子有很强的病原菌诱导活性,这些结果表明NPR1可能通过结合CmWRKY15-1的启动子来激活其表达。已有研究发现,NPR1可以通过与WRKY基因启动子的相互作用来激活下游抗病基因的表达[29-30],CHUN等[31]发现,AtWRKY18是通过调节抗病蛋白NPR1/NIM1增强发育调节的防御反应。因此,本试验把含有CmWRKY15-1启动子诱饵载体的酵母菌株与NPR1猎物载体共转化,酵母单杂结果表明NPR1可以结合CmWRKY15-1启动子序列,参与防御菊花白色锈病的过程,但CmWRKY15-1与NPR1是否在蛋白水平上相互作用仍需要进一步的试验探究。

