拮抗菌株SY-15的鉴定及其抑菌活性分析*
黄华毅 扈丽丽 陈刘生 赵丹阳 黄咏槐
(广东省林业科学研究院/广东省森林培育与保护利用重点实验室,广东 广州 510520)
杨树是我国防风固沙、水土保持、农田保护和维护生态平衡的主要树种之一,具有速生丰产的特点。近年来,杨树腐烂病等病害的发生呈逐年上升的趋势,严重危害了杨树的健康,阻碍了杨树产业的可持续发展。杨树腐烂病是一种分布广泛、危害严重的枝干性病害,其病原菌是金黄壳囊孢菌Cytospora chrysosperma,有性型为Valsa sordida(Nits.),在我国东北、西北、华北等地区都有分布,发病时枝干塌陷腐烂,形成环斑,严重时造成整株死亡。杨树腐烂病的发病地区发病率一般能达到50%,有些调查甚至能达到90%,特别是在春季,可以造成大面积的杨树林死亡,导致严重的经济损失[1-2]。
目前,杨树腐烂病的防治还是以物理防治、化学防治,同时结合抗病品种的选育为主。化学防治具有见效快、防治效果好的特点,结合物理防治能进一步提高防治效果[3]。使用化学药剂对环境污染大,病原菌易产生抗药性,施药不当还容易引起杨树产生药害,而利用自然界存在的微生物资源有效抑制病原菌的生长从而防治植物病害,是目前替代或减少化学农药使用的重要手段之一,具有环境友好和安全性高的优点[4]。以往研究表明,很多类型的微生物资源能有效抑制杨树腐烂病病原菌金黄壳囊孢菌的生长,具有进一步开发利用的潜力,如鳞柄白鹅膏Amania virosa、细鳞环柄菇Leoiota clypeolaria、绒白乳菇Lactarius vellereus、长枝木霉Trichoderma longibrachiatum、绿木霉Trichoderma virens、吡咯伯克霍尔德氏菌Burkholderia pyrrocinia、解淀粉芽孢杆菌Bacillus amyloliquefaciens、苏云金芽孢杆菌B.pumilus、短小芽孢杆菌B.pumilus、萎缩芽孢杆菌B.atrophaeus、枯草芽孢杆菌B.subtilis等[5-12]。
拮抗菌株SY-15 是从杨树根际土壤中分离获得的一株拮抗细菌,前期研究表明该菌株与金黄壳囊孢菌对峙培养后表现出了较强的拮抗活性。本研究基于传统方法和分子生物学的手段对拮抗菌株SY-15 进行了鉴定,并进一步分析了其对多种植物病原真菌的抑菌活性,为该菌株的进一步开发利用和杨树腐烂病的生物防治奠定技术基础。
1 材料与方法
1.1 试验材料
供试拮抗菌株SY-15 分离自健康杨树根际土壤,供试植物病原真菌:金黄壳囊孢菌、迂回壳囊孢菌C.ambiens和黑腐皮壳菌C.mali均由北京林业大学提供。
1.2 试验方法
1.2.1 培养基 LB 培养基用于细菌菌株的平板培养和斜面保存;LB 液体培养基:用于细菌菌株菌液的制备;优化培养基(葡萄糖22.64 g·mL-1,蛋白胨11.93 g·mL-1, 大豆粉5.00 g·mL-1,KH2PO41.00 g·mL-1,MgSO4·7H2O 0.50 g·mL-1,NH4Cl 3.00 g·mL-1,Na2HPO41.00 g·mL-1,酵母浸粉1.86 g·mL-1,pH 7.0~7.2)[11]:用于芽孢杆菌的发酵培养。
1.2.2 拮抗菌株SY-15 的鉴定 参照《常见细菌系统鉴定手册》[13-14]的方法对菌株的形态学指标和生理生化特性进行鉴定,包括革兰氏染色、接触酶、淀粉水解、厌氧生长、明胶液化等指标。
1.2.3 16S rDNA 基因序列测定和比对分析 采用菌落PCR 法扩增16S rDNA[15]:挑取单菌落至装有200 μL 双蒸水的EP 管中,100 °C 煮沸10 min后,12 000 r·min-1、2 min 离心取上清液,即为菌株的基因组DNA。以提取的菌株基因组DNA 为模板,利用引物63f:5′-CAGGCCTAACACATGCAAGTC-3′,1387r:5′-GGGCGGWGTGTACAAGGC-3′[16],进行PCR 扩增。扩增体系为20 μL,含有10×TaqE 缓冲液2 μL、dNTP 1.6 μL、正反向引物各1 μL、DNA Taq 聚合酶0.1 μL、DNA 模板1 μL,ddH2O 补足至20 μL。扩增条件:94 °C 4 min;94 °C 1 min,55 °C 1 min,72 °C 1.5 min,35 个循环;72 °C 10 min。引物合成和测序由英潍捷基(上海)贸易有限公司完成。
采用BLAST 方法在GenBank 数据库中进行相似性搜索和同源性比较,采用ClustalX 1.8 进行序列匹配分析,通过MEGA 5.0 软件,采用Neighbor-Joining 法构建系统发育,用Bootstrap(重复抽样1 000 次)分析评估树的稳定性。
1.3 项目测定
1.3.1 拮抗菌株SY-15 无菌培养滤液抑菌活性测定 挑取活化后的SY-15 单菌落,接种至盛有100 mL LB 培养液的三角瓶中(规格250 mL),于28 °C、200 r·min-1的条件下振荡培养24 h 得到种子液。按1%(v·v-1)的量将种子液接入装有100 mL 优化培养基的三角瓶(规格500 mL)中,于28 °C、200 r·min-1条件下振荡培养5 d。4 °C、10 000 r·min-1的条件下离心30 min 后收集上清液,再用0.22 µm 微孔滤膜过滤,得到无菌培养滤液。
无菌培养滤液对病原真菌的抑菌活性的测定采用带药平板法[17]。将SY-15 的无菌培养滤液以1 ∶10(v·v-1)的比例与加热冷却至40~50 °C 的PDA 混合,倒平板,在不同的平板中央分别接入直径6 mm的病原真菌菌饼,28 °C 倒置培养,每隔12 h 测量病原菌菌落直径,直至对照组菌落直径长至培养皿直径的3/4 以上为止。以不加无菌培养滤液的平板作为对照,每个处理设3 个重复,采用十字交叉法测量病原菌菌落直径,计算抑菌率。抑菌率的计算采用如下公式:抑菌率(%)=[(对照组扩展直径—处理组扩展直径)/对照组扩展直径]×100。
1.3.2 拮抗菌株SY-15 产真菌细胞壁裂解酶特性测定 将活化后的SY-15 单菌落分别接种至脱脂牛奶培养基、茯苓粉培养基、胶体几丁质培养基、羧甲基纤维素培养基和脂酶检测培养基平板中央,然后将平板倒置培养于30 °C 恒温培养箱中,连续观察7 d。观察脱脂牛奶培养基、茯苓粉培养基和胶体几丁质培养基平板中央菌落周围有无透明圈出现,出现透明圈则说明菌株能产生蛋白酶、β-1,3-葡聚糖酶和几丁质酶,反之,则说明不能产生[9,13];将浓度为1 mg·mL-1的刚果红染液对羧甲基纤维素培养基平板进行染色,静置染色15 min 后,用移液枪缓慢吸去刚果红染液,再利用适量的浓度为1 mol·L-1的NaCl 溶液洗涤平板,洗涤15 min 后静置5 min,最后观察羧甲基纤维素培养基平板中拮抗菌菌株周围是否出现透明圈,出现则说明有纤维素酶产生,反之,则说明没有纤维素酶产生[18];观察脂酶检测培养基平板中生长的拮抗菌菌落周围是否出现模糊的晕圈,出现则说明有脂酶产生,反之,则说明无脂酶产生[13]。
1.3.3 拮抗菌株SY-15 挥发性气体抑菌活性测定 采用二分皿法测定挥发性气体的抑菌活性[17]。每隔12 h 测量病原菌菌落直径,直至对照组菌落直径长至培养皿半径的3/4 以上为止,计算相对抑菌率。相对抑菌率的计算采用如下公式:相对抑菌率(%)=[(对照组扩展直径—处理组扩展直径)/对照组扩展直径]×100。
1.4 数据分析
采用Excel 2010 和SPSS 20.0 软件对数据进行统计分析。
2 结果与分析
2.1 拮抗菌株SY-15 的鉴定
拮抗菌株SY-15 在LB 平板上呈灰色或灰白色,不透明,菌落圆形、光滑,边缘隆起、完整,不产色素。菌体为杆状,大小约(1.02~2.70)μm×(3.55~7.66) μm,有芽孢,具鞭毛,革兰氏阳性菌。兼性厌氧型,能够利用葡萄糖、D-木糖和柠檬酸盐,能水解葡萄糖产气,明胶液化,硝酸盐还原、硫化氢反应、氧化酶反应、接触酶反应、Voges-Proskauer 反应、卵磷脂酶活性、淀粉水解均呈阳性,而吲哚反应、甲基红反应和苯丙氨酸脱氨酶活性均呈阴性。菌株能在温度范围10~45 °C,pH范围4~8 和NaCl 浓度范围0.2%~5%之间生长(表1)。菌株SY-15 的16S rDNA PCR 扩增得到一段大小为1 307 bp 的基因片段,系统发育分析(图1)结果显示,菌株SY-15 与Bacillus subtilisJK0316S(KF135455.1)接近。综合菌株SY-15 的形态学特征、生理生化特性及16S rDNA 序列分析结果,最终将菌株SY-15 鉴定为枯草芽孢杆菌Bacillus subtilis。

图1 菌株SY-15 16S rDNA 序列的系统发育树Figure 1 Phylogenetic tree of strain SY-15 based on 16S rDNA sequence analysis
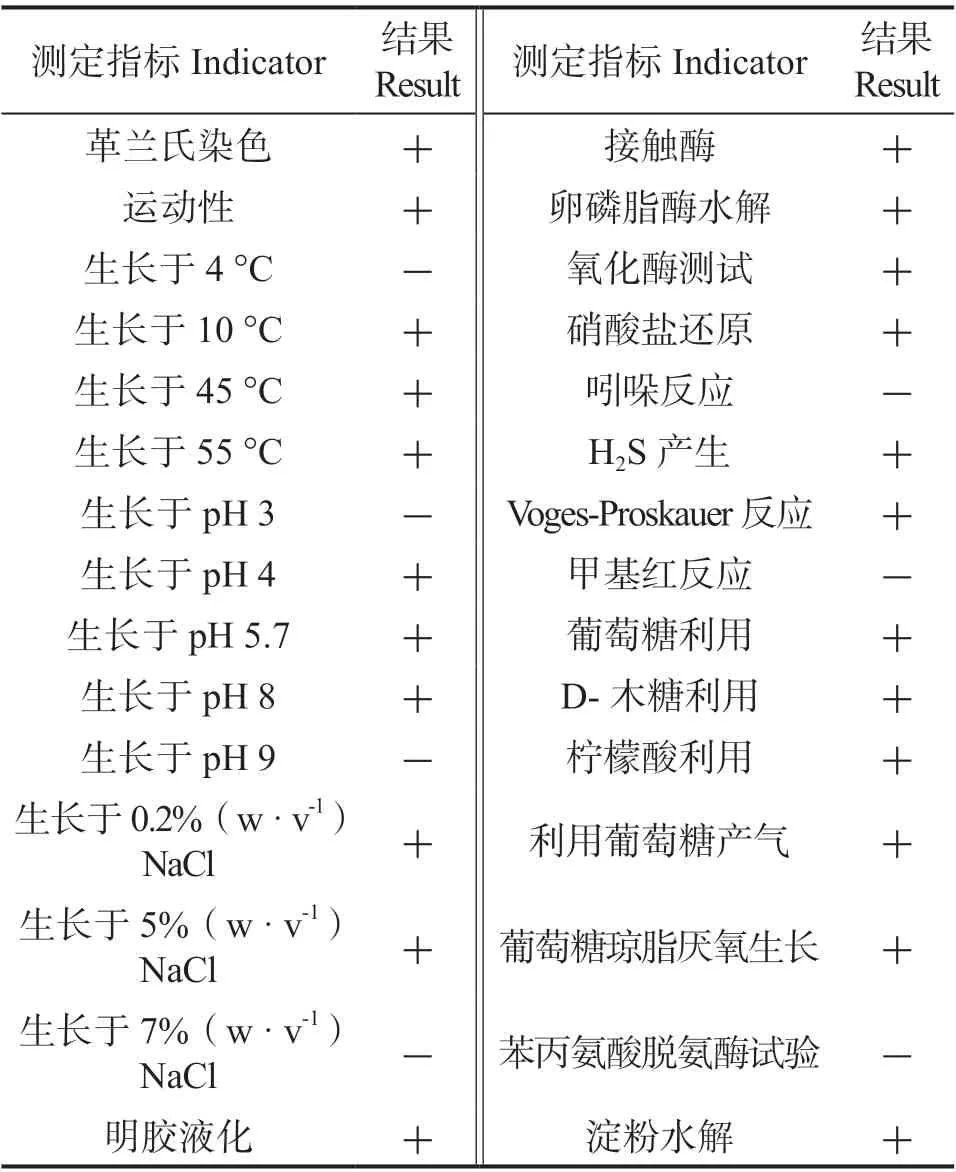
表1 菌株SY-15 的培养条件和生理生化特性Table 1 Culture conditions and physiology-biochemical characteristics of strain SY-15
2.2 拮抗菌株SY-15 无菌培养滤液的抑菌活性
拮抗菌株SY-15 无菌培养滤液对3 种植物病原真菌的抑菌活性测定结果显示,SY-15 的无菌培养滤液均能明显抑制金黄壳囊孢菌、迂回壳囊孢菌和黑腐皮壳菌菌丝的生长(图2A)。在处理12 h时,拮抗菌株SY-15 的无菌培养滤液表现出的抑菌活性最强,随着处理时间的延长,无菌培养滤液对金黄壳囊孢菌的抑菌活性较为稳定,对迂回壳囊孢菌和黑腐皮壳菌的抑菌活性呈现先减弱后保持稳定的特点,最后在处理60 h 时,SY-15 的无菌培养滤液对金黄壳囊孢菌、迂回壳囊孢菌和黑腐皮壳菌的抑菌率分别达到88.89%、60.39%和53.02%(图3)。
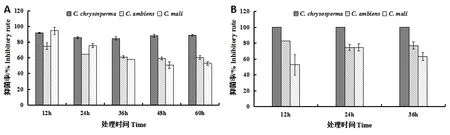
图2 拮抗菌株SY-15 的无菌培养滤液(A)和挥发性气体(B)在不同处理时间对植物病原真菌的抑菌活性Figure 2 Antifungal activities of sterile culture filtrate (A) and volatiles (B) of strain SY-15 in different treatment times against fungal phytopathogens

图3 拮抗菌株SY-15 的无菌培养滤液对植物病原真菌的抑菌活性(60 h)Figure 3 Anifungal activities of sterile culture filtrate of strain SY-15 against fungal phytopathogens (60 hours)
2.3 拮抗菌株SY-15 产细胞壁裂解酶特性
5 种细胞裂解酶活性检测结果显示,只有蛋白酶(图4A)和纤维素酶(图4B)的检测平板中菌体周围产生透明圈,而其他裂解酶检测的平板中菌体周围未见透明圈或晕圈出现,分别说明了拮抗菌株SY-15 能产生纤维素酶和蛋白酶,而不能产生几丁质酶、β-1,3-葡聚糖酶和脂酶。

图4 拮抗菌株SY-15 产生蛋白酶(A)和纤维素酶(B)Figure 4 Production of protease(A) and cellulase(B) by strain SY-15
2.4 拮抗菌株SY-15 挥发性气体的抑菌活性
拮抗菌株SY-15 挥发性气体对3 种植物病原真菌的抑菌活性测定结果显示,SY-15 的挥发性气体均能明显抑制金黄壳囊孢菌、迂回壳囊孢菌和黑腐皮壳菌菌丝的生长(图2B)。拮抗菌株SY-15的挥发性气体能完全抑制金黄壳囊孢菌的菌丝生长,在不同处理时间对迂回壳囊孢菌的抑菌活性较为稳定,而对黑腐皮壳菌的抑菌活性呈现先升后降的变化,最终在处理36 h 时,SY-15 的挥发性气体对金黄壳囊孢菌、迂回壳囊孢菌和黑腐皮壳菌的抑菌率分别达到100%、76.98%和63.41%(图5)。

图5 拮抗菌株SY-15 的挥发性气体对植物病原真菌的抑菌活性(36 h)Figure 5 Anifungal activities of volatiles of strain SY-15 against fungal phytopathogens(36 hours)
3 结论与讨论
芽孢杆菌属是目前研究和应用最为广泛的生物防治菌株资源之一,其资源广泛分布于自然界的各种环境中,生长速度快、营养需求简单、抗逆性强、易于在植物体表面定殖与繁殖、抑菌谱广、对人畜无害、不污染环境,且制剂生产的工艺简单、制剂稳定、储存时间长、施用方便,不仅符合人们对环境和健康的需求,而且为农林业的可持续发展提供了保障[4]。目前已有多种类型的芽孢杆菌被发现能有效抑制杨树腐烂病病原菌金黄壳囊孢菌的生长。徐明等[10]通过筛选获得了4 株能抑制金黄壳囊孢菌生长的芽孢杆菌,分别为1 株枯草芽孢杆菌,2 株解淀粉芽孢杆菌和1 株苏云金芽孢杆菌。金海强等[19]研究报道了一株解淀粉芽孢杆菌Y-S-Y12 对金黄壳囊孢菌具有高效抑菌活性。REN 等[8]筛选获得了一株杨树内生拮抗细菌短小芽孢杆菌JK-SX001 能有效抑制金黄壳囊孢菌的生长。前期对峙培养实验结果表明拮抗菌株SY-15 能有效抑制金黄壳囊孢菌的生长,本研究基于形态学特征、生理生化特性和16S rDNA 序列分析将菌株鉴定为SY-15 为枯草芽孢杆菌。
大量的研究报道表明芽孢杆菌属的拮抗菌具有很好的抑菌广谱性,同时通过产生抑菌活性物质来抑制或杀死病原菌是芽孢杆菌表现出抑菌活性的重要机制之一,包括通过核糖体途径合成的蛋白类抑菌物质,通过非核糖体途径合成的脂肽类物质和挥发性气体,其中蛋白类物质中还包含了一些细胞壁裂解酶类,已报道主要有几丁质酶、纤维素酶、蛋白酶、脂肪酶和β-1,3-葡聚糖酶,这些细胞壁裂解酶的作用机制是通过裂解病原菌细胞壁,导致病原菌细胞裂解,从而导致病原菌细胞死亡[4]。田爱霞[20]研究发现蜡样芽孢杆菌B.cereusTJB-8 能有效抑制金黄壳囊孢菌、细极链格孢菌Alternaria tenuissima、胶孢炭疽菌Colletotrichum gloeosporioides、尖孢镰刀菌Fusariumoxysporum、禾谷镰刀菌F.graminearum和立枯丝核菌Rhizoctonia solani,其能产生具有抑菌活性的蛋白类物质、脂肽类物质和挥发性气体,能产生β-1,3-葡聚糖酶和蛋白酶。黄华毅等[21]报道发现枯草芽孢杆菌STO-12 产生的蛋白类物质、脂肽类物质和挥发性气体对细极链格孢菌、胶孢炭疽菌和杨树腐烂病菌的生长均表现出一定的抑菌活性,同时发现该菌株能产生纤维素酶和蛋白酶。HUANG 等[12]研究发现枯草芽孢杆菌ZSH-1 的无菌培养滤液、蛋白类物质、脂肽类物质和挥发性气体对7 种植物病原真菌(胶孢炭疽菌、尖孢镰刀菌、细极链格孢菌、金黄壳囊孢菌、葡萄座腔菌、毛霉和犁头霉)均具有不同的抑菌活性,同时其能产生纤维素酶、β-1,3-葡聚糖酶和蛋白酶。本研究结果表明枯草芽孢杆菌SY-15 的无菌培养滤液均能明显抑制金黄壳囊孢菌、迂回壳囊孢菌和黑腐皮壳菌菌丝的生长,说明该菌株能产生非挥发性气体的抑菌活性物质来抑制多种植物病原真菌的生长,这些抑菌活性物质很有可能也是蛋白类和脂肽类物质,同时本研究发现SY-15 能产生纤维素酶和蛋白酶,进一步说明了SY-15 能产生蛋白类的细胞壁裂解酶。此外,通过二分皿法也证明了菌株SY-15 能产生具有抑菌活性的挥发性气体,其能有效抑制金黄壳囊孢菌、迂回壳囊孢菌和黑腐皮壳菌的生长,其中对金黄壳囊孢菌的抑菌活性达到100%。
本研究对拮抗菌株SY-15 的种类进行了鉴定,并进一步分析了其抑菌活性,研究结果表明,基于形态学特征、生理生化特性和16S rDNA 序列分析,最终将拮抗菌株SY-15 鉴定为枯草芽孢杆菌。拮抗菌株SY-15 的无菌培养滤液和挥发性气体均能有效抑制金黄壳囊孢菌、迂回壳囊孢菌和黑腐皮壳菌的菌丝生长。此外,还发现菌株SY-15能产生蛋白酶和纤维素酶。研究结果显示出了拮抗菌株SY-15 的较高研究和应用价值,是一株潜在的防治杨树腐烂病及其他植物病害的生防菌株资源。本研究虽然初步分析了枯草芽孢杆菌SY-15的抑菌活性和抑菌活性物质,但对于其具体的抑菌机理及抑菌活性物质种类目前还不清楚,有待后续开展深入的研究。

