ReOx/CeO2 催化甲醇选择氧化制甲酸甲酯动力学研究
刘俊龙,胡玉婷,高智伟,万建东,詹 建,师瑞娟*
1.阜阳师范大学化学与材料工程学院,安徽阜阳,236041;2.环境污染物降解与监测安徽省重点实验室,安徽阜阳,236041;3.阜阳踏诺生物科技有限公司,安徽阜阳,236041
甲酸甲酯是C1化学领域一种重要的中间物分子[1],通过甲酸甲酯可以生产甲酸、乙酸、碳酸二甲酯等50多种产物[2]。目前甲酸甲酯全球年产能超过1 000万吨,产量已超过800万吨,随着下游产物的不断开发,需求不断扩大,产量也逐年提高。目前工业上甲酸甲酯的主要生产方法有两种,一种是甲醇羰基化法[3],该方法是采用甲醇钠作催化剂,在液相条件下催化甲醇和CO反应生产甲酸甲酯。但是甲醇钠催化剂对CO原料气体中的杂质,尤其是CO2和H2O非常敏感,会导致甲醇钠催化剂失活以及后续分离困难。另一种甲酸甲酯的生产方法是甲醇气相脱氢法[4-5],该过程主要利用Cu基催化剂,在气相条件下,通过甲醇直接脱氢实现。但是,甲醇脱氢反应是热力学限制反应。虽然高温条件有利于转化率的提高,但是反应是吸热过程,耗能较高,并且高温条件下甲酸甲酯又会产生严重的分解反应。
甲醇选择氧化制甲酸甲酯是热力学有利的反应,可以突破直接脱氢热力学的限制,实现甲醇原料的高转化率,是一条有希望的甲酸甲酯合成路线。但是,在氧气存在条件下甲醇容易深度氧化生产CO2,因此寻找一种温和条件下高选择性的甲醇选择氧化制甲酸甲酯催化剂是该路线的关键。V2O5/TiO2[6]、MoO3/SnO2[7]、Au-Pd[8-9]、Cu-Pd[10]、Au-Ag[11]以及纳米多孔Au[12]等催化材料被发现对该反应有催化效果,但这类催化剂受到操作温度窗口窄、产物收率低、贵金属资源稀缺等诸多因素的影响,目前均处于研究阶段,没有成功的工业化的案例。
前期研究发现ReOx/CeO2催化剂表现出较好的甲醇选择氧化制甲酸甲酯反应活性和选择性[13]。该催化剂和传统的钼钒基催化剂相比具有较宽的温度操作窗口(180~260 ℃)和产物选择性,但是对双功能催化机理和构效关系认识不够深入。本文在前期工作基础上拟对ReOx/CeO2催化剂催化甲醇选择氧化制甲酸甲酯进行宏观动力学研究,以期对反应机理和工业应用做重要的参考。
1 实验部分
1.1 催化剂的制备
将0.202 g NH4ReO4加入2 mL去离子水中搅拌溶解,再称取2 g CeO2粉末加入上述溶液中,充分搅拌均匀;然后在空气气氛下110 ℃放置12 h烘干;最后在马弗炉内450 ℃焙烧6 h,即得 ReOx/CeO2样品。
1.2 催化剂的表征
X射线衍射(XRD)测试在Rigaku D/MAX-2500/PC型X射线粉末衍射仪上进行。采用Cu Kα射线(λ = 0.154 05 nm)作为光源,Ni滤波,管电压为40 kV,管电流为200 mA,扫描范围2θ=10°~80°,扫描速率5°/min。通过扫描电子显微镜(SEM)观察样品的形貌和粒径大小,表征在Carl Zeiss Sigma 500型扫描电镜上进行,加速电压20 kV。
1.3 催化反应实验
催化剂的活性测试是在内径为6 mm的石英微型固定床反应器中进行。制得的催化剂压片成型,并破碎筛分到40~60目,取10~20 mg的催化剂用于测试。反应中引入组成为CH3OH/O2/He=5.5/10.6/83.9(体积比)混合气。用Agilent 6890N气相色谱仪在线分析反应尾气,采用TCD检测器分析CO2;在HP-FFAP毛细管柱上采用FID检测器分析MeOH(CH3OH)及MF(HCOOCH3)。
2 结果与讨论
2.1 催化剂的结构
为确定催化剂材料的物相特征,对CeO2和ReOx/CeO2样品分别进行了XRD表征,结果如图1所示。从图1中可以看出CeO2样品在28.5°、33.0°、47.4°和56.3°处分别出现了4个较强的衍射峰,表明该样品是典型的萤石结构CeO2。ReOx/CeO2样品的XRD谱图表现出和CeO2样品类似的特征,没有新的明显的衍射峰出现,说明Re在载体上很好的分散,没有良好结晶状态的物种生成。
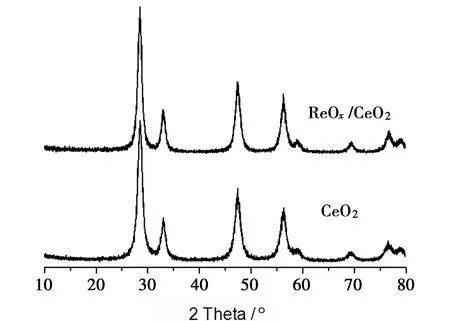
图1 ReOx/CeO2和CeO2样品XRD
扫描电子显微镜是表征固体材料形貌和大小的有效的手段,由图2(a)可以看出,在低倍的扫描电镜照片中大部分是块状结果的材料,其中夹杂少量团聚结构。放大后从图2(b)中可以看出,块状晶体上分散有从几个纳米到几十个纳米不等的接近于球形的颗粒状固体。据此可以认为载体氧化铈是颗粒较大的固体上面均匀分散着纳米尺寸的ReOx颗粒。

图2 ReOx/CeO2样品的扫描电镜照片
2.2 催化反应活性
反应条件:240 ℃,MeOH/O2/He = 5.5/10.6/83.9 vol%。
图3是在ReOx/CeO2催化剂上甲醇选择氧化性能随温度的变化曲线。从图3中可以看出,在180 ℃时ReOx/CeO2催化剂上仅有3.6%的甲醇转化率,主要催化反应产物为甲酸甲酯,其选择性可以达到80%以上,伴随有少量甲醇脱水产物二甲醚的生成[13];而深度氧化产物CO2几乎检测不到。随着反应温度不断升高甲醇的转化率和甲酸甲酯的选择性也逐渐升高,当温度达到240 ℃时甲酸甲酯的达到最高接近90%的选择性,而当温度超过240 ℃后甲酸甲酯的选择性会不断下降;相对应的是CO2的选择性随温度升高不断增加,当温度升高到 260 ℃时CO2的选择性已经超过10%。

图3 ReOx/CeO2催化甲醇选择氧化反应活性和产物选择性随温度的变化曲线
从以上反应结果可以看出,ReOx/CeO2催化剂在一定条件下可以有效地催化甲醇选择氧化生成甲酸甲酯,当温度较低(<180 ℃)时由于催化活性较低,甲醇转化率不高,同时存在甲醇脱水生成二甲醚的竞争反应,而在高温条件下(>260 ℃)又会深度氧化生成CO2,因此最佳的操作条件在220~250 ℃范围。
2.3 催化反应动力学
宏观动力学研究是探讨化学反应机理,探索反应条件的重要研究手段。一般宏观动力学研究是通过实验获得反应的活化能(Ea)、指前因子(A)以及反应级数等这些化学动力学中的重要参数。典型的多相催化过程一般包含反应物分子向固体催化剂表面扩散、表面吸附活化、表面反应生成产物分子和产物分子从催化剂表面脱附等一系列连续步骤。为了研究催化活性一般要把反应条件控制在表面反应为速控步骤,即所谓的本征动力学。因此,为了使得反应条件控制在本征动力学范围,首先考察了外部扩散的影响。实验分别考察了220 ℃和230 ℃两个典型温度点,甲醇含量4.0%~10.0%,空速1 685~3 370 ml·g-1·h-1(以甲醇计)等条件下对甲醇转化率的影响,结果列在表1。从表1中可以看出,在固定空速条件下,甲醇转化率随原料中甲醇含量接近等比例变化。同样,当固定原料气中甲醇含量,空速从1 685 ml·g-1·h-1增加一倍改变到3 370 ml·g-1·h-1时,相应的甲醇转化率也降低接近一半。实验结果表明,在相同的温度条件下,改变原料中甲醇含量和改变反应空速单位质量催化剂上获得的甲醇转化量接近,说明实验条件范围内表面反应是速度控制步骤,消除了外扩散的影响。后面的动力学实验都在该范围内进行操作。

表1 外部扩散对ReOx/CeO2催化反应的影响
为了保证实验结果的可靠性,分别做了MeOH/O2=0.37,0.55和2三个不同醇氧比条件下的动力学实验。结果表明:在220~250 ℃范围内,随温度升高甲醇转化和产物生成速率均不断升高。为了更为直观地分析催化剂的催化效率,把反应速率折算成单位质量的Re(gRe)单位时间内(s)催化反应的效果来计量反应速率常数k,并把lnk对1/T作图得出Arrhenius曲线。
lnk=lnA-Ea/RT
(1)
式中,k为反应速率常数,A为指前因子,Ea为活化能,R为普适气体常数,T为热力学温度。结果见图4—图6,曲线线性拟合结果列在表2。
从图4—图6中可以看出,在220~250 ℃温度范围内,三个不同MeOH/O2条件下的lnk对1/T均能呈现出良好的线性关系。根据Arrhenius公式(1),通过线性的斜率和截距分别求出反应的活化能Ea和指前因子A。结果发现(表2)甲醇反应的平均活化能为80.3 kJ·mol-1,平均指前因子为3.1×106mol·gRe-1·s-1,而生成物甲酸甲酯和CO2的平均活化能分别为92.9 kJ·mol-1和107.9 kJ·mol-1,平均指前因子分别为1.64×107mol·gRe-1·s-1和3.79×107mol·gRe-1·s-1。值得一提的是随着MeOH/O2增加,反应生成CO2的活化能和指前因子逐渐降低。一种可能的原因是在生成甲酸甲酯和CO2的过程中存在一种甲酸根吸附态的共同中间物,该中间物和甲醇反应会生成甲酸甲酯,和氧气反应会深度氧化生成CO2,随MeOH/O2增加不利于CO2生成。

表2 不同MeOH/O2条件下反应的活化能(Ea)和指前因子(A)
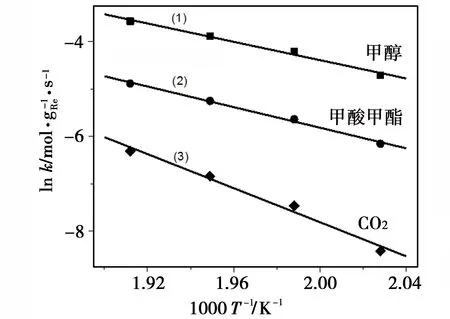
图4 MeOH/O2=0.37的Arrhenius曲线

图5 MeOH/O2=0.55的Arrhenius曲线

图6 MeOH/O2=2的Arrhenius曲线
结果表明,ReOx/CeO2催化剂上CO2的生成反应的活化能比生成MF高出15 kJ·mol-1,说明高温对CO2的生成有利,这也很好地解释了随温度的升高CO2的选择性逐渐增加。说明了甲醇脱氢是一个分步的过程,随温度的升高有利于深度脱氢反应的发生,但不利于选择氧化。
宏观动力学研究的另一项重要参数是反应级数。对于多物种参与的反应而言,动力学实验设计中一般控制某一种物质的浓度远小于其他物质浓度的方法测定反应级数。由于反应过程的转化率较小(一般<1%),高浓度物种在反应中近似不变,通过反应速率方程可求出反应级数。
实验首先测定了O2的反应级数,通过改变原料混合气中O2的分压分别测定MeOH、MF和CO2的反应速率,然后把各物种的反应速率取对数后对O2分压的对数作图(logr-logp(O2)图),结果如图7所示。从图7可以看出,各物种的反应速率对数和O2分压的对数值呈现良好的线性关系。通过线性的斜率可以得出O2对MeOH、MF和CO2这三种物种的反应级数分别为0.11,0.15和0.51(表3)。可见,O2对MeOH和MF近似为0级反应,而对CO2近似为0.5级。
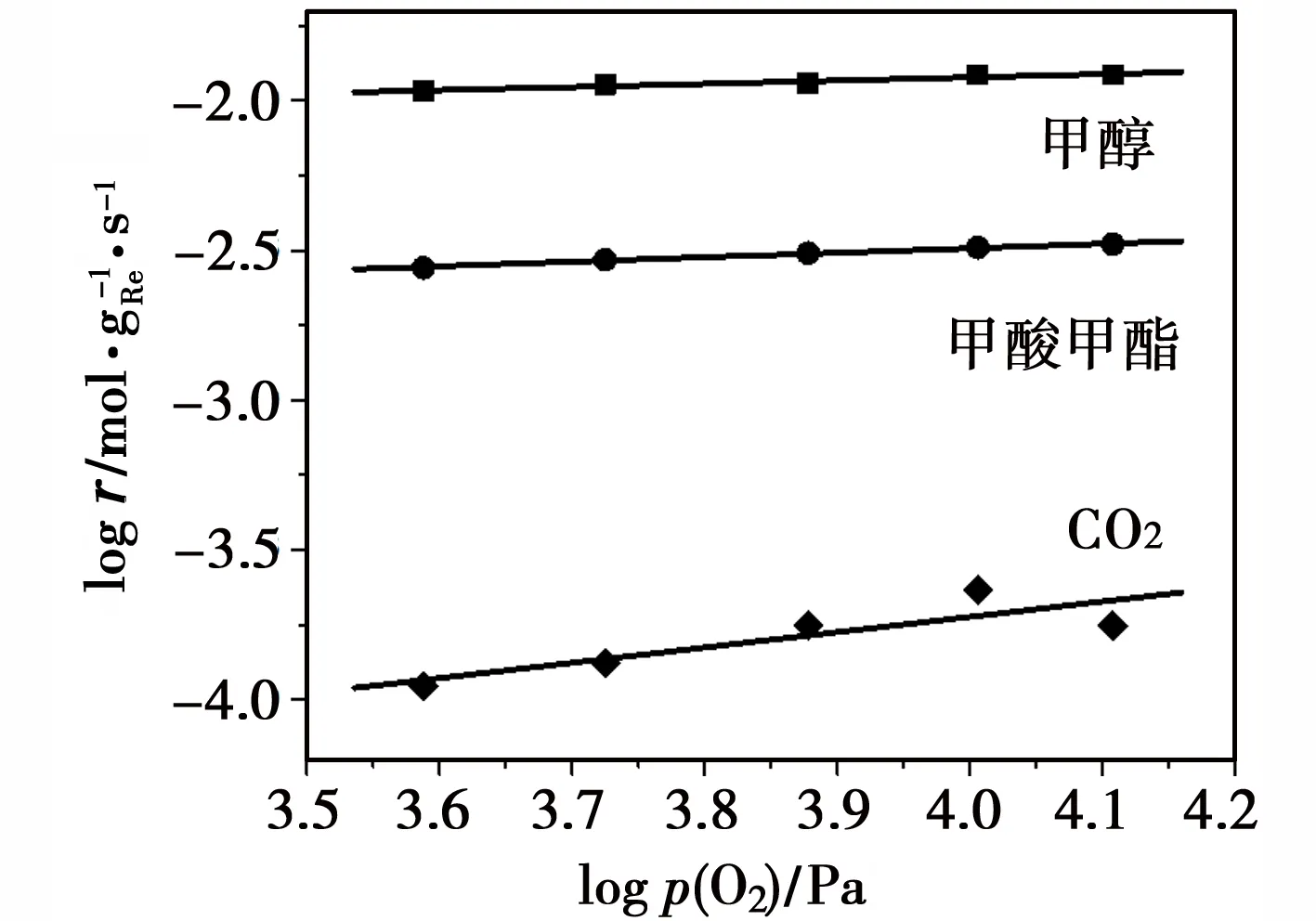
图7 logr对logp(O2)的变化关系

表3 MeOH、O2和H2O对MeOH、MF和CO2的反应级数
按同样的方法考察了MeOH的反应级数。同样测定MeOH、MF和CO2的反应速率然后对MeOH的分压作对数曲线,结果如图8所示。从图8可以看出,MeOH、MF和CO2三种物种的反应速率对MeOH的分压的对数曲线均呈现出良好的线性关系,通过线性的斜率可以得出MeOH对MeOH、MF和CO2这三种物种的反应级数分别为0.28,0.05和0.17(表3)。可见,MeOH对MF 和CO2均可以近似为0级反应,说明在反应条件下气相MeOH的浓度对反应速率影响较小,与反应结果吻合。
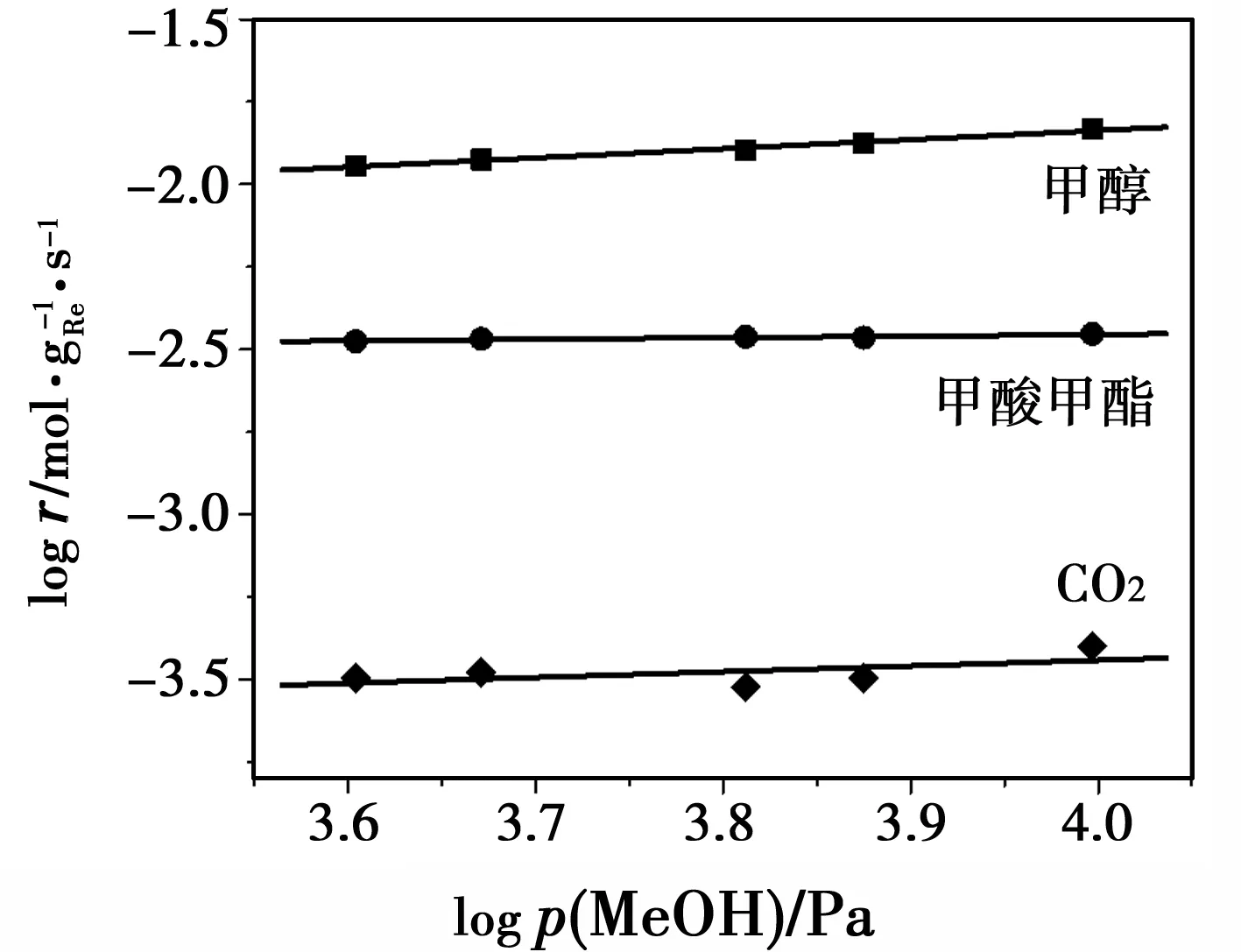
图8 logr对logp(MeOH)的变化关系
水分子是甲醇选择氧化反应的生成物之一,水分子具有较强的极性,在很多固体表面都能表现出较强的吸附性能。因此,水分子的存在对反应速率会有重要的影响。本文对水分子对反应速率的影响也做了系统的考察,通过鼓泡法在原料混合气中引入水蒸气,然后改变水蒸气的分压考察对反应速率的影响,实验结果对数曲线如图9所示。从图9中可以看出,MeOH和MF的反应速率对H2O的分压的对数曲线均呈现出良好的线性关系。但是该线性的斜率向下,说明随着气相中H2O浓度的增加,催化反应速率在降低,反映出H2O分子对反应的抑制作用。通过线性的斜率可以得出H2O对MeOH和MF的反应级数分别为-0.33,-0.36(表3)。

图9 logr对logp(H2O)的变化关系
3 结 论
ReOx/CeO2催化剂可以有效地催化甲醇选择氧化合成甲酸甲酯。在200~250 ℃可以获得近90%的甲酸甲酯选择性。
完全氧化生成CO2反应比选择氧化生成MF具有更高的活化能,反应的操作温度不宜过高。完全氧化需要更多的氧分子,O2分子对生成CO2具有更高的反应级数,选择氧化应控制O2浓度。MeOH对生成MF和CO2均表现出近0级反应,MeOH浓度对反应影响不大。水分子具有负的反应级数,水分子的存在对生成MF反应具有明显的抑制作用。MeOH和MF的反应速率方程可分别表达为:
rMeOH=3.1×106·exp(-9 658.4/T)pMeOH0.28pH2O-0.33
rMF=1.6×107·exp(-11 173.9/T)pH2O-0.36

