PDK4对山羊肌内脂肪细胞脂代谢的影响
张浩 张亚楠 李鑫 王佳美 王永 朱江江 熊燕林亚秋
(1. 青藏高原动物遗传资源保护与利用教育部四川省重点实验室,成都 610041;2. 西南民族大学畜牧兽医学院,成都 610041)
肌内脂肪(intramuscular fat,IMF)含量是影响肉质的重要指标,它的提高有助于提高肉的嫩度及多汁性并改善肉质及风味[1]。脂肪组织是一类结缔组织,包括前体脂肪细胞、脂肪细胞、巨噬细胞、内皮细胞、成纤维细胞以及白细胞等不同的细胞类型[2]。而通过控制脂肪沉积水平进一步提升肉质水平是改善肉质的重要手段,也是当前畜牧工作者关注的热点。
丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase,PDKs)是一类三磷酸腺苷酶,通过编码具有组氨酸激酶结构域来抑制丙酮酸脱氢酶复合体的活性,从而控制丙酮酸脱羧转化为乙酰辅酶5A[3]。PDKs具有PDK1、2、3和4这4种同工酶[4],其中PDK4在各种代谢过程中发挥重要作用,比如在肝脏中可以通过PPARα或TR-RXR异二聚化使PDK4表达上调,且PPARα激活后存在PDK4的优先表达[5];人骨骼肌中PDK4在机体长期运动、短期高强度和长期低强度运动之后其 mRNA显著增加[6],说明PDK4影响骨骼肌代谢;同时PDK4与高血糖、胰岛素抵抗、过敏和癌症在内的代谢疾病有关[7]。除此之外,PDK4在脂代谢中的作用也有报道,章琳俐等[8]通过RNA-seq揭示PDK4是鸭肉风味相关的候选基因,可能调节鲜味氨基酸和脂肪酸形成。Yamaguchi等[9]指出PDK4表达存在昼夜变化,这种变化与血浆游离脂肪酸(FFA)的利用有关。Newhardt等[10]通过构建心脏糖酵解的转基因小鼠模型,发现高脂饮食小鼠的 PDK4表达升高。潘鹏丞等[11]鉴定PDK4在陆川猪皮下脂肪中高表达,Zhang等[12]在猪和小鼠肌肉中特异性过表达PGC-1α后,PDK4和PPARγ蛋白表达增加,可能促进糖原沉积和脂肪酸氧化。Xu等[13]通过测序比较圩猪和约克夏猪背最长肌中的基因表达模式,指出PDK4可能对肌内脂肪积聚有影响。以上研究证明PDK4在脂代谢和脂肪沉积方面发挥作用,但其对山羊脂肪细胞脂代谢的影响尚不清楚,且作用机制尚未探明。
因此本研究在克隆山羊PDK4 基因序列的基础上,分析其分子特征;使用实时荧光定量PCR(quantitative real-time PCR,qPCR)绘制PDK4基因在山羊各组织中和肌内脂肪细胞分化时的表达图谱;采用干扰和过表达手段探究PDK4对脂肪细胞脂代谢的影响,为深入研究该基因调控山羊肌内脂肪细胞脂代谢提供基础数据。
1 材料与方法
1.1 材料
随机选取8头健康的一周岁简州大耳羊公羊(四川简阳大哥大牧业有限公司),空腹屠宰后采集样品:内脏(心脏、肝脏、脾脏、肺脏和肾脏)、皮下脂肪和肌肉(背最长肌、股二头肌和臂三头肌)等样本,用TRIzol法提取各组织中的总RNA,按TIANGEN FastQuant RT Kit(with gDNase)反转录为cDNA备用。
将本实验室前期冻存的山羊肌内前体脂肪细胞复苏,培养至F3代时接种于12孔板,待细胞融合度达到90%时加入终浓度为50 μmol/L的油酸的完全培养基诱导细胞分化,分别收集分化0-7 d的肌内脂肪细胞(n=3),TRIzol法提取细胞总RNA,反转录为cDNA备用。
1.2 方法
1.2.1 山羊PDK4克隆及分子特征分析 使用Primer 5.0 软件根据 NCBI中牛 PDK4的预测序列(NM_001101883.1)设计山羊PDK4 的克隆引物。以来自皮下脂肪组织的cDNA 为模板进行扩增。按cDNA 1.0 μL,sense/anti-sense primer(10 μmol/L)1.0 μL,2×GC-Rich PCR MasterMix 12.5 μL,ddH2O补齐体系至 25 μL。程序为:94℃ 3 min;94℃ 30 s,60℃ 30 s,72℃ 2 min,35 个循环 ;72℃延伸 10 min。从1%琼脂糖凝胶中回收目的片段,连接至pMD-19T载体后转化至DH5α,挑取阳性菌落送擎科生物科技有限公司测序。
利用生物信息学软件对山羊PDK4的理化性质,磷酸化位点,信号肽及亚细胞定位,蛋白质结构等进行分析,具体方法参照文献[14]。
1.2.2 山羊PDK4过表达和干扰细胞模式的构建 将本实验室前期构建保存山羊HBADE-PDK4-3*flag-GFP过表达载体和HBAD-GFP对照载体滴加入12孔板中感染12 h,然后更换培养基为诱导液,收集诱导分化48 h的脂肪细胞。接种于12孔板的细胞待融合度达到80%-90%每孔加入450 μL Opti-MEM培养液,然后在37℃,5% CO2培养箱内培养4 h,按每孔 3 μL Lipo3000,2 μL 20 μmol/L siRNA,50 μL Opti-MEM体系配置预混液,室温静置15 min后加入孔中,转染6 h后更换终浓度为50 μmol/L油酸的完全培养液,48 h后收集细胞。
1.2.3 油红O染色及OD值检测 用于染色的细胞接种于24孔板,细胞处理同1.2.2,对应病毒感染用量和干扰转染体系均减半处理,48 h后进行油红O染色及OD值检测,PBS洗涤3次后用10%中性甲醛固定30 min,PBS洗净甲醛后加入配制好的油红O工作液,染色30 min后PBS洗净浮色,置于显微镜下观察并拍照。然后每孔加入1 mL异丙醇,溶解染料后转移至96孔板并测定其吸光度值。
1.2.4 荧光定量PCR 及数据分析 利用qPCR检测PDK4在山羊各组织中和山羊肌内脂肪细胞分化过程中的表达水平。用Primer Premier 5.0 软件设计特异性引物(表1),以TBP(XM_018053502.1)作为内参基因,qPCR反应体系包括cDNA 1 μL,SYBR®Premix Ex TaqTM(2×)10 μL,10 μmol/L 上、下游引物各 1 μL,RNase Free H2O 7 μL。反应条件为 95℃预变性3 min;95℃变性10 s,59℃退火20 s,72℃延伸30 s,共40个循环。利用2-ΔΔCT法分析qPCR结果,数据以“平均值±标准误(Mean±SEM)”展示,使用SPSS 18.0 软件并选择One-way ANOVA方法分析数据差异显著性,mRNA相对表达量以Duncan 法进行多重比较。当 P<0.05 时,认为有统计学意义。“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。

表1 引物信息Table 1 Primer information
2 结果
2.1 山羊PDK4的生物学特性
克隆获得山羊PDK4基因长 1 808 bp(GenBank登录号:MF564045.1),其中CDS区长1 224 bp,可编码407个氨基酸,预测蛋白分子质量为46.2 ku(图1-A)。NCBI conserved Domains Batch Search分析发现PDK4蛋白含有HATPase_PDK-like和BCDHK_Adom3结构域(图1-B),主要定位在线粒体(47.8%)和细胞质(30.4%),理论等电点6.43,二级结构预测PDK4 蛋白包含52.09%无规则卷曲(212个氨基酸)、31.45% α螺旋(128个氨基酸)和16.46%延伸链(67个氨基酸)(图1-C)。STRING数据库显示DLAT、PDHA1、PDP2、PDK2、DLD、PDHB 和 PDHA1 等蛋白与PDK4存在相互作用(图1-D)。

图1 山羊PDK4序列分析Fig. 1 Sequence analysis of goat PDK4
2.2 同源性分析和系统进化树分析
山羊PDK4氨基酸序列与绵羊、牛、猪、人、小鼠的同源性均在90%以上(图2-A),利用MAGE5构建PDK4的系统进化树,结果(图2-B)显示山羊与绵羊和牛处于同一分支,亲缘关系最近。

图2 山羊PDK4同源性分析(A)和进化树(B)Fig. 2 Homology analysis(A)and phylogenetic tree(B)of goat PDK4
2.3 山羊PDK4组织和细胞表达模式
qPCR结果显示PDK4在山羊肺脏和臂三头肌的表达量极显著高于其他组织(P<0.01),其次为肝脏,极显著高于心脏、脾脏、肾脏、瘤胃和皮下脂肪组织(P<0.01)(图3-A)。PDK4在山羊肌内前体脂肪细胞分化过程中表达呈上升趋势,且在第5天时的表达量最高,极显著高于分化前的表达量(P<0.05)(图 3-B)。

图3 山羊PDK4组织表达谱(A)和时序表达谱(B)Fig. 3 Tissue expression profile(A)and temporal expression profile(B)of goat PDK4
2.4 PDK4对山羊肌内脂肪细胞脂代谢的影响
2.4.1 过表达和干扰效率检测 分别以不同浓度的山羊PDK4腺病毒过表达载体和空白对照的腺病毒感染山羊肌内前体脂肪细胞,诱导分化48 h后在利用显微镜观察细胞处于正常状态的基础上,收集细胞并提取总RNA反转录为cDNA,qPCR检测其过表达效率,结果(图4)显示过表达PDK4基因后,与对照相比,PDK4基因过表达效率大约为307.9倍(P<0.01)。
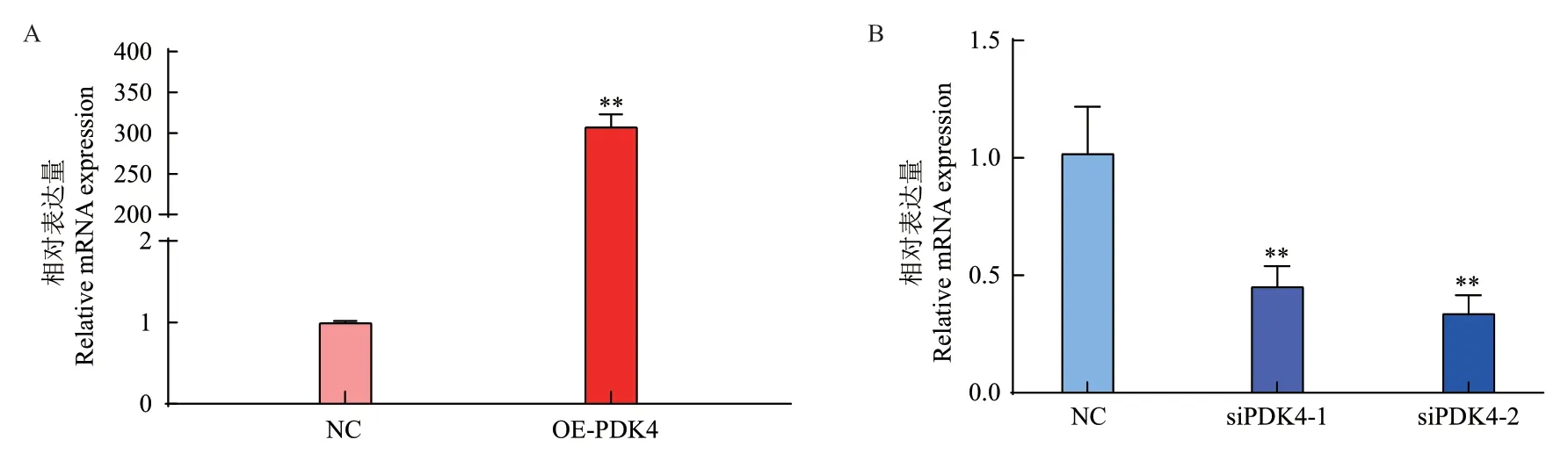
图4 PDK4过表达(A)和干扰(B)效率Fig. 4 Efficiency of PDK4 overexpression(A)and inter-ference(B)
两对siRNA(siPDK4-1和siPDK4-2)转染组与同对照组相比均极显著地降低目的基因的表达,干扰效率分别为56%和67%(P<0.01)。siPDK4-2的干扰效率高于siPDK4-1的干扰效率,因此本研究后期均以siPDK4-2作为有效干扰片段进行研究。
2.4.2 形态学观察 过表达PDK4后肌内脂肪细胞中的脂质积聚显著高于阴性对照组(图5-A),同时进行OD值检测,发现OE-PDK4组的OD值显著高于阴性对照组(P<0.05)(图5-B)。
转染siPDK4-2 48 h后细胞形态未发生改变,但脂滴聚积明显减少(图5-C),干扰后OD值显著低于对照组(图5-D)。
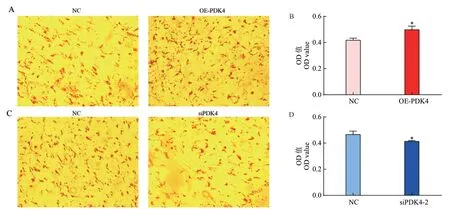
图5 油红O染色及OD值Fig. 5 Oil red O staining and OD value
2.4.3 脂代谢相关基因表达水平检测 过表达PDK4后,与对照相比,OE-PDK4组脂肪酸合成基因ACACA mRNA,脂质吸收及转运基因FABP3和CD36、甘油三酯合成基因AGPAT6和ADRP mRNA表达极显著上调(P<0.01)(图6-A)。而干扰PDK4后与NC相比,FABP3、AGPAT6 mRNA表达水平显著下调(P<0.05),CD36、ACACA、ADRP mRNA 表达极显著下调(P<0.01)(图6-B)。
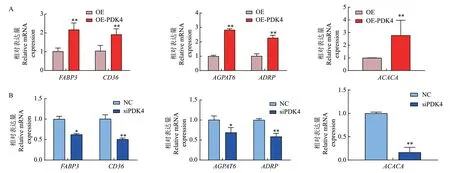
图6 脂代谢相关基因表达水平Fig. 6 Expression levels of lipid metabolism-related genes
3 讨论
本研究获得山羊PDK4 DNA序列1 808 bp,包含编码407个氨基酸的CDS区序列1 224 bp,序列分析显示,山羊PDK4蛋白共有36个潜在磷酸化位点和22个潜在糖基化位点,这可能与蛋白质翻译后修饰有关[15],从而激活PDK4的活性发挥其自身的调控作用。PDK4蛋白在不同物种间存在差异,而氨基酸序列的差异是否会导致其蛋白质结构的改变,引起其功能的变化以及在不同物种间的功能是否有变化仍需进一步证明。
PDK4组织表达谱显示PDK4在山羊肺脏和臂三头肌中的相对表达水平最高,显著高于检测的其它组织中的表达,而有研究显示PDK4在动物心脏、氧化型肌肉、肝脏和肾脏等组织中高表达[16-17];PDK4在荣昌猪仔猪的多种组织中表达,且在小肠中高表达,在肾脏、脾脏和脂肪组织中也存在较高水平的表达[18],这与本研究结果存在差异。杨洋等[19]报道 PDK4基因在大白猪和从江香猪两个品种中的脂肪组织中均存在较高水平的表达,但在从江香猪的肾脏中表达水平最高,与本研究结果类似,也表明PDK4在不同品种中存在差异;张榕婧等[16]研究发现,PDK4在鸡的肌肉组织中表达量最高,这与上述报道存在差异,但与本实验结果相似,推测PDK4在不同物种中具有不同的表达模式。此外,PDK4在巴马香猪和杜长大猪两个品种的腹部脂肪组织中表达量最高,其中杜长大猪的皮脂、腹脂、肝、脾以及肾中PDK4基因的表达水平较高[20];但奚子英等[21]对肉鸡的研究中发现,PDK4基因在鸡的皮脂和腹脂中的表达水平显著高于下丘脑和肝脏中的表达水平。基于PDK4在不同物种脂肪组织中的高表达,本研究构建了山羊肌内脂肪细胞时序表达谱,显示PDK4在山羊肌内脂肪细胞分化过程中表达呈现上升趋势,推测山羊PDK4可能具有促进肌内脂肪细胞脂质积聚的作用。这与张罕星等[22]报道相似,PDK4在猪肌内和皮下脂肪细胞分化过程中表达水平均呈逐渐上升的趋势,推测PDK4在脂肪细胞分化和脂质积聚过程中可能扮演重要角色。Schafer等[23]发现高脂饮食喂养的小鼠中CoA(CoASH)促进PDK4的降解,充当将PDK4降解速率与心脏中的脂肪酸利用率相关联的代谢传感器,间接指出PDK4在脂代谢中的调控作用。因此,为了明确PDK4是否调控山羊肌内脂肪细胞脂代谢,本研究后续采用干扰及过表达实验进行阐明。
研究发现过表达PDK4促进了肌内脂肪细胞脂质的积聚,而干扰山羊PDK4抑制了肌内脂肪细胞脂滴的积聚,但脂肪细胞分化标志基因没有发生改变(数据未展示),这与Sarsenbayeva等[24]的报道相类似,Sarsenbayeva等发现调节线粒体功能的PGC1α、PDK4和CPT1B基因受药物作用表达降低,可影响人皮下脂肪组织的脂代谢,却对脂肪因子Leptin和AdipoQ的表达无影响,对PPARγ也无影响。基于此,我们考虑PDK4是否通过调控脂代谢相关基因表达变化来完成促进脂滴积聚的作用,因此检测了脂代谢相关基因FABP3、CD36、AGPAT6、ADRP和ACACA表达水平的变化。FABP3是脂肪酸结合蛋白家族(FABPs)成员之一,主要通过促进甘油三酯沉积影响脂质代谢[25-26],抑制FABP3基因后明显抑制葡萄糖氧化从而促进细胞内甘油三酯合成[27],另外FABP3可协同ACSL2基因将长链脂肪酸酯化形成甘油三酯[28]。CD36可作为脂肪酸转运体介导组织细胞对脂肪酸的摄取,参与脂肪酸代谢[29]。磷酸甘油酰基转移酶6(1-acylglycerol-3-phosphate O-acyltransferase6,AGPAT6)来自 AGPAT家族,在多种哺乳动物中参与甘油三酯和三酰基甘油生物合成[30]。AGPAT6基因缺失小鼠的遗传性肥胖的几率降低[31-34]。ADRP基因可促进脂肪细胞脂肪的合成[35-36]。结果发现过表达山羊PDK4可使脂代谢相关基因FABP3、CD36、ACACA、AGPAT6和ADRP mRNA表达发生变化,其随着PDK4基因的上调而呈显著增高。干扰PDK4后FABP3、AGPAT6、ADRP和CD36基因的表达呈现相反的表化,推测PDK4可能通过调节FABP3、AGPAT6、ADRP、ACACA和CD36基因表达促进山羊肌内脂肪细胞脂代谢。但是PDK4调控山羊肌内脂肪细胞脂代谢的具体分子机理仍不清楚,需要进一步的研究来阐明。
4 结论
山羊PDK4基因在山羊各组织及肌内前体脂肪细胞分化各个阶段均有表达;过表达后促进了脂肪细胞脂滴积聚,甘油三酯合成和脂质沉积相关基因表达上调,而干扰后呈现相反的趋势和表达,表明PDK4切实影响山羊肌内脂肪细胞的脂质沉积。

