一株产γ-氨基丁酸乳酸菌的筛选及其生物特性研究
陈佩 闫娟 党辉





[摘 要]本研究从陕西汉中泡菜汁中分离筛选出一株可产γ -氨基丁酸(GABA)的乳酸菌P16,并对其生物特性进行了研究。结果表明:该菌株GABA的产量为0.796 mg/mL;该菌株生长较快,培养2 h进入对数生长期,12 h后进入稳定期;菌株具有良好的耐酸性和耐盐性,在pH值达到2或NaCl浓度达到9%(W/V)时仍然可以存活,最适生长pH为6-7;菌株耐受胆盐的延迟时间可达0.94 h。通过形态学观察和分子生物学鉴定,确定该菌株为短乳杆菌Lactobacillus brevis,将其命名为Lactobacillus brevis P16。本研究为高产GABA乳酸菌发酵剂的开发和应用提供了理论依据。
[关键词]乳酸菌;γ-氨基丁酸;生物特性
[中图分类号] TS201.3 [文献标识码] A [文章编号]1008-4649(2021)04-0089-06
Screening for a Lactic Acid Bacteria Producing γ-Aminobutyric Acid and Study on the Biological Properties
Chen Pei1,Yan Juan1,Dang Hui2
(1. The Open University of Shaanxi,Xi’an 710119;2.Shaanxi Normal University,Xi’an 710119)
Abstract:In this study,a lactic acid bacterium P16 that can produceγ-aminobutyric acid (GABA) was isolated and screened from pickle juice in Hanzhong,Shaanxi,and its biological characteristics were studied. The results showed that the output of its GABA is 0.796 mg/mL. The results showed that the growth cycle of the strain was relatively short,it entered the logarithmic growth phase at 2 hours,and reached stationary phase after 12 hours. The strain has good acid fastness and salt tolerance. It could grow under pH2 and 9% NaCl( W/V) conditions. The optimum pH and temperature for its growth was 6-7.The bile tolerance of this strain in the form of lag time was 0.94 h. Through morphological observation and molecular biological identification,the strain was determined to be Lactobacillus brevis,and it was named Lactobacillus brevis P16. This study provides a theoretical basis for the development and application of high-yield GABA lactic acid bacteria starter.
Key words:Lactic acid bacterium; GABA; Biological properties
γ-氨基丁酸,可简称为GABA,又称为氨酪酸,是一种广泛分布于自然界的非蛋白质氨基酸。在哺乳动物体内只存在于中枢神经系统,经谷氨酸脱羧酶催化由谷氨酸转化而成[1],具有抗疲劳、降血压[2]、改善睡眠以及提高人体记忆力[3]等生理功能,是一种兼具药理作用和保健功能的新型功能因子,现已被国家卫生部批准为“新资源食品”,可用于巧克力、可可制品、糖果、飲料、膨化和焙烤食品中,在食品领域具有良好的应用前景。GABA的制备方法主要包括植物富集法、化学合成法及微生物合成法三类,相比较而言,植物富集法产量低、成本高且难度大,化学合成法反应复杂且安全性差,而微生物发酵合成法成本低、安全性较好且条件温和,适用于大规模生产制备,是较为理想的合成方法[4]。
乳酸菌是可利用糖类发酵产生乳酸的一类细菌统称,作为世界公认的食品安全级益生菌被广泛应用于泡菜和酸奶等发酵食品的生产制作,通常情况下泡菜汁中存在着大量乳酸菌。近年来,乳酸菌的有益作用越来越受到人们的关注,大量试验结果表明,乳酸菌具有促进肠道消化、降血压血糖[5-6]、提高人体免疫能力[7]、降低人体胆固醇[8]和抗肿瘤[9]等功能,不同种属的乳酸菌往往具有不同的益生功能[10]。目前,已有不少研究表明在酸奶、土壤、腌制酸菜等材料中发现了产GABA的乳酸菌株。如李远宏[11]等人从鲜奶中筛选出一株高产GABA的乳酸乳球菌,产量达到4.68 g/L;曾小群[12]等从新疆酸马奶分离获得一株戊糖乳杆菌,产GABA量为1.6 g/L;缪存影[13-14]等从酸菜中筛选获得一株产酸菌,静置发酵可得13.45 g/L的GABA。
本研究拟从陕西汉中泡菜汁中筛选能够高产γ-氨基丁酸的乳酸菌,并对其进行生物特性的研究,以期为微生物发酵法生产制备GABA以及功能性乳酸菌的筛选分离等相关研究提供一定的参考价值。
1 材料与方法
1.1材料与仪器
泡菜汁 来源于陕西汉中地区32家农户;GABA标准品 西安晶博生物科技有限公司;L-谷氨酸、次氯酸钠、苯酚、四硼酸钠、茚三酮、正丁醇、冰醋酸等 西安晶博生物科技有限公司。
LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;SPX-2501-G 型微电脑光照培养箱 上海博讯实业有限公司医疗设备厂;SW-CJ-1CV超净台 苏州安泰空气技术有限公司; UV-2450紫外可见分光光度计 日本岛津;PHS-3C pH计 上海精密科学仪器有限公司;HC-3018型高速离心机 安徽中科中佳科学仪器有限公司。
1.2 实验方法
1.2.1 产GABA乳酸菌的筛选和分离
1) 样品菌株的活化:吸取1 mL泡菜汁样品于5 mL MRS液体培养基中,振荡混匀,在37℃条件下活化24 h。
2) 乳酸菌的分离纯化及初步鉴定:吸取200 μL活化后的样品溶液涂布于MRS固体培养基上,于37℃培养48 h。挑取生长状况较好的单菌落,在MRS平板上不断划线进而得到纯化菌株,放入37℃恒温箱中培养48 h,记录各菌落的形态特征,包括菌落的颜色、形状、大小、表面和边缘的性状等。通过革兰氏染色初步鉴定样品菌株是否为乳酸菌并记录菌株在显微镜下的形态,乳酸菌应为革兰氏阳性菌。
3) 产酸菌株的筛选[15]:由于产酸量大的菌株可以水解培养基中添加的碳酸钙,形成水解圈,因此可根据水解圈的大小来判断菌株的产酸能力。筛取产酸能力较强的菌作为进一步筛选的菌株。
4) 产GABA乳酸菌的筛选[16]:将产酸能力较强的纯化菌株接种于5mL MRS液体培养基,在37℃条件下活化培养24h。再按2%的接种量将其接种于20mL以L-谷氨酸为基质的液体发酵培养基中,37℃恒温条件下静置发酵3天,取发酵液经纸层析定性分析及比色法定量测定后确定产GABA的菌株。
1.2.2 GABA的定性分析
采用纸层析法定性分析菌株发酵液中是否存在GABA,由此判断菌株是否产GABA。按冰醋酸:水:正丁醇= 1:3:4的体积比配置展开剂,并添加0.4g/100mL的茚三酮作为显色剂。取适量GABA及L -谷氨酸制成浓度均为1mg/mL的2mL标准液,取2mL样品发酵液煮沸5 min,按照12000 r/min的转速离心5 min,取上清液以甲醇定容至2 mL。将定性滤纸裁剪成适当大小,用铅笔在离滤纸底边1.5 cm处画一条直线,线上每隔1.5 cm标记一个点作为点样位置。
用移液枪分别吸取2 μL标准液及样品液依次点样,将层析纸放入展开剂中层析2 h,之后放入57℃恒温干燥箱中干燥显色2-3 h。以GABA和谷氨酸标品及无菌MRS液体培养基发酵液作为对照,根据标准品的Rf值进行定性判断,从而确定产GABA的菌株。
1.2.3 GABA的定量检测
根据比色法定量测定产GABA菌株发酵液中的GABA含量。利用Berthelot反应,即苯酚、次氯酸钠与游离氨的反应呈蓝色来测定体系中的微量氨,通常GABA浓度越高,反应后溶液呈现的蓝色越深。
1)GABA标准曲线的绘制:准确配制浓度分别为0,0.2,0.4,0.6,0.8和1.0 mg/mL的GABA标准溶液,分别取1 mL标准液依次加入1 mL浓度为0.01 mol/L的四硼酸鈉缓冲液、1 mL浓度为6 g/100mL的苯酚溶液以及2.5 mL的7.5 g/100mL次氯酸钠溶液,充分混匀后沸水浴10 min,再冰浴5min,待溶液呈蓝绿色加入2 mL 60%乙醇溶液,630 nm处测OD值,以吸光度(y)为纵坐标,各标准液质量浓度为横坐标(x,mg/mL)作图得标准曲线,并建立回归方程。
2)样品中GABA含量的测定:取5 mL产GABA菌株的发酵液于5000 r/min离心20 min,取1 mL上清液,按照前面的方法进行处理,630 nm处测OD值,取等量无菌水为空白对照,根据标准曲线方程求得相应GABA含量。
1.2.4 菌株生物特性研究
1)菌落菌体形态观察
将产GABA的乳酸菌P16涂布于MRS培养基上,37℃培养48 h后,观察其菌落形态特征。挑取单个菌落于载玻片上进行涂片、革兰氏染色,然后在显微镜下观察菌体形态。
2)菌株生长曲线的测定
取对数生长期的菌株,按2%接种量接种于MRS液体培养基中,于37℃下培养24 h,每隔2 h取样一次,测定其菌液OD600nm值并绘制生长曲线。
3)菌株耐酸性的测定
以1 mol/L HCl溶液和1 mol/L NaOH溶液调节MRS液体培养基的pH值,分别为2.0、2.5、3.0、4.0、5.0、6.0、6.5和7.0,取对数生长期的P16菌株按2%的接种量接种,充分混匀,在37℃恒温烘箱中培养20 h,使用分光光度计于600 nm波长下测定其OD值并绘制曲线。
4)菌株耐盐性的测定
取对数生长期P16菌株以2%的接种量分别接种到NaCl (W/V)分别为0%、2%、4%、6%、7%、8%、9%的MRS液体培养基中,振荡混匀,于37℃下培养20 h后测定OD600nm值。
5)菌株对胆盐的耐受能力测定
取对数生长期的P16菌株,以2%的接种量分别接种于含有或不含0.3%胆盐的MRS-THIO( MRS含有0.2%的巯基乙酸钠) 培养中,充分混合均匀,在37℃下培养。记录培养基吸光值到达0.3个单位时各组所需的时间,不加胆盐与加了胆盐两组的时间差即为P16在胆盐中生长的延迟时间( LT) ,延迟时间的长短,反映了乳酸菌对胆盐的耐受能力。时间越短说明耐受胆盐的能力越强,反之则耐受胆盐的能力越弱。
1.2.5 菌株的分子生物学鉴定
提取产GABA的P16菌株的DNA进行16s rDNA基因的PCR扩增,用16S通用引物27f(AGAGTTTGATCMTGGCTCAG)和1492R(TACGGYTACCTT GTTACGACTT)对基因组进行PCR扩增,将扩增产物送至测序公司,测得的序列与数据库进行对比分析,由此鉴定菌株的种类。
2 结果与讨论
2.1 产GABA乳酸菌的筛选结果
2.1.1 产酸菌株筛选结果
通过MRS培养基从32份泡菜汁样品中共分离出约40株菌,80%的泡菜汁中只分离出一株菌株,由此可判断泡菜汁中存在大量产酸菌株使得生长环境pH 值较低,不利于其他菌株的生长。将40株菌放入添加CaCO3的MRS固体培养基培养后,依据培养基中碳酸钙水解圈的大小判断菌株产酸能力的强弱,由此得到14株产酸能力相对较强的菌株。
2.1.2 纸层析定性GABA结果
取GABA和L-谷氨酸标准溶液以及产酸样品菌株的发酵液点样,取无菌发酵液为空白对照,其中GABA标品编号为a,L-谷氨酸标品编号为b,无菌发酵液为c,14株样品溶液编号为d~q。经纸层析定性分析,结果如图1所示。通过样品发酵液及标准溶液的Rf值对比,可判断标号为e的菌株P16产GABA较为明显。
2.1.3 比色法定量测定GABA结果
1)GABA标准溶液曲线的绘制:由图2可得,GABA标品溶液曲线的线性回归方程为y=0.4521x-0.0229,相关系数R2 = 0.9912,精确度较高,因此可根据该方程计算样品发酵液中GABA的含量。
2)样品中GABA含量的测定:将菌株P16发酵液处理后于630 nm波长处
测得OD值为0.337,代入线性方程中,得出样品发酵液中GABA含量为0.796 mg/mL。
2.2 菌株P16的生物特性研究
2.2.1 菌落菌体形态
将产酸菌株P16于MRS平板上通过划线分离纯化,37℃厌氧培养48 h,菌株生长良好。其菌落形态如图3A所示,菌落呈乳白色,不透明,形状为较为规则的圆形,表面光滑,菌落直径约为2 mm,边缘齐整。菌体特征如图3B所示,菌体杆状,不产孢子,无运动性,革兰氏阳性菌,显微镜下为短杆状。
2.2.2 菌株P16的生长曲线
如图4所示,菌株P16在2h时开始进入对数生长期,培养10h后到达稳定期,活菌数可达到108CFU/mL。
2.2.3 菌株P16的耐酸能力
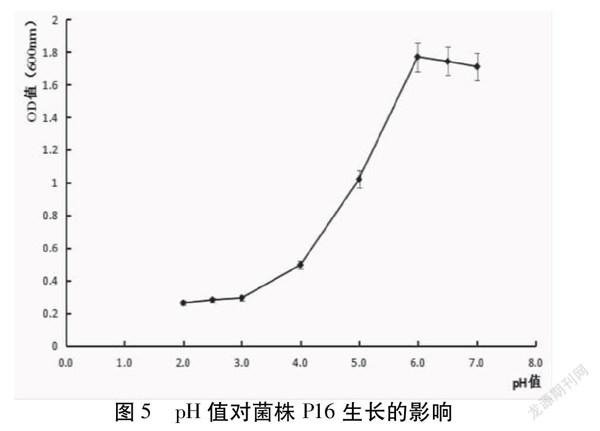
pH值对菌株P16的影响见图5。研究表明,该菌株生长最适pH范围6.0-7.0,在pH=2.0时的酸性环境下仍可生长,由此可判断该菌具有良好的耐酸性。
2.2.4 菌株P16对NaCl的耐受能力
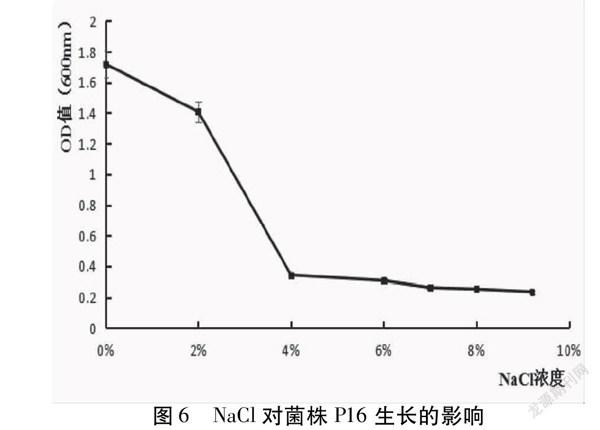
NaCl对菌株P16的影响如图6。研究表明,菌株P16对NaCl的耐受能力较好,在NaCl浓度达到9%时仍能生长,当氯化钠浓度大于2% 时,短乳杆菌的生长能力大幅度下降。
2.2.5菌株P16的耐胆盐能力分析
评价菌株是否能够在肠道中生存与定殖的一个重要指标就是菌株对于胆盐的耐受能力。表1中所示,本实验中的菌株P16对于胆盐的延迟时间为0.94 h,说明此菌株对胆盐具有很好的耐受性。
2.3 菌株P16的分子生物学鉴定
根据blast结果,菌株P16与短乳杆菌(Lactobacillus brevis)親源关系最近。依据形态特征及其遗传特性16s rDNA对菌株P16初鉴定为Lactobacillus brevis,并将其命名为Lactobacillus brevisP16。
3 结论
本试验从陕西汉中32份泡菜汁中分离筛选出一株可产GABA的乳酸菌P16,通过比色法测定其发酵液中GABA产量为0.796 mg/mL。研究表明该菌株的生长周期较短,具有良好的耐酸和耐盐性,耐受胆盐的延迟时间可达0.94 h。通过菌落形态特征和16S rDNA序列分析鉴定为Lactobacillus brevis,将其命名为Lactobacillus brevisP16。该菌株具有良好的耐受性,产GABA能力较强,本研究可为高产GABA乳酸菌发酵剂的开发和应用提供理论依据。同时,影响乳酸菌产GABA的因素很多,本研究下一步将确定此菌株高产GABA的最佳工艺条件。
[参考文献]
[1]梁恒宇,等.新资源食品——γ -氨基丁酸(GABA)的研究进展[J].食品研究与开发,2013,34(15):129-123.
[2]Carcia M C,Adler-Graschinsky E,Celush S M.Role of CGRP and GABA in the hypotensive effect of intrathecally administered anandamide to anesthetized rats[J]. European Journal of Pharmacology,2006,532: 88-98.
[3]杨胜远,等.γ -氨基丁酸的生理功能和研究开发进展[J].食品科学,2005,26(9):546-551.
[4]龚金炎,等.黄酒浸米液中产γ -氨基丁酸乳酸菌的筛选和鉴定[J].工业微生物,2015,45(6):26-31.
[5]GóMEZ-GUZMáN M,TORAL M,ROMERO M,et al. Antihypertensive effects of probiotics Lactobacillus strains in spontaneously hypertensive rats[J]. Molecular Nutrition & Food Research,2015,59,11: 2326-2336.
[6]SUN J,BUYS N J. Glucose- and glycaemic factor-lowering effects of probiotics on diabetes: a meta-analysis of randomised placebo-controlled trials[J]. British Journal of Nutrition,2016,115(7): 1167-1177.
[7]VLASOVA A N,KANDASAMY S,CHATTHA K S,et al. Comparison of probiotic lactobacilli and bifidobacteria effects,immune responses and rotavirus vaccines and infection in different host species[J]. Vet Immunol Immunopathol,2016,172: 72-84.
[8]国立东,等.一株乳酸乳球菌的降胆固醇特性及其作用机制[J].中国酿造,2015,34(7):53-55.
[9]LI J,SUNG CY,LEE N,et al. Probiotics modulated gut microbiota suppresses hepatocellular carcinoma growth in mice[J]. PNAS,2016,113(9): E1306-E1315.
[10]孟丹,等.一株乳酸乳球菌产γ -氨基丁酸能力及其安全性评价[J]. 2017,36(4):72-77.
[11]李远宏,等.鲜奶中产γ -氨基丁酸乳酸菌株的筛选与鉴定[J].食品科学,2010,31(15):198-202.
[12]曾小群,等.新疆酸马奶中产γ -氨基丁酸乳酸菌的筛选与鉴定[J].中国食品学报,2013,13(10):191-196.
[13]缪存影,等.酸菜中高产γ -氨基丁酸乳酸菌的筛选和鉴定[J].微生物学杂志,2010,30(2):28-32.
[14]杨宏芳,等.微生物发酵法制备γ -氨基丁酸的研究进展[J].安徽农业科学,2017,45(24):76-78.
[15]杨海英,等.腌菜中乳酸菌的分离及产酸菌筛选研究[J].安徽农业科学,2012,40(13):7909-7910,7915.
[16]王冰聪. 产γ-氨基丁酸乳酸菌的筛选及发酵条件的优化[D].长春大学,2019.
[责任编辑 李帆]
[收稿日期]2021-07-10
[作者简介]陈佩( 1983— ) ,女,陕西省泾阳县人,博士,陕西开放大学中瑞旅游与酒店管理学院副教授。闫娟( 1983— ) ,女,陕西省汉中市人,陕西开放大学中瑞旅游与酒店管理学院副教授。党辉(1977— ),陕西省汉中市人,博士,陕西师范大学食品工程与营养科学学院讲师。
[基金项目]本文系陕西省第三批“青年杰出人才支持计划”;陕西省科学技术研究发展计划项目(2017NY-182);陜西师范大学中央高校基本科研项目(GK201703069);陕西开放大学2020年度科研一般课题(20DB06)研究成果之一。

