几种抗癌化疗药物致大鼠口腔溃疡模型的比较研究
谢欣序,刘 鹏,贾 静,赵 文,严 丽,李 俊,冯育林,杜力军,2,罗颖颖
(1.江西中医药大学创新药物与高效节能降耗制药设备国家重点实验室,江西 南昌 330006;2.清华大学生命科学学院,北京 100084)
口腔粘膜炎是指口腔的炎性和溃疡性反应,为肿瘤患者放化疗常见的几种并发症(如呕吐、食欲降低、过敏反应等)之一,临床常表现为口腔异常疼痛,尤其在说话、进食等刺激后更明显,极大影响了患者的语言交流、正常进食和睡眠,造成生活质量明显下降,甚者阻碍其进一步治疗。目前对于此类并发症的治疗多以含漱液、生理盐水、锡类散等为主,但疗效不佳。因此,寻找新的治疗药物具有重要意义[1]。
动物模型作为新药临床前药效评价重要组成部分,在整个新药研发中起到不可或缺的作用。目前口腔溃疡动物模型的制备方法主要有化学烧灼法、创伤法、氧自由基法、细菌感染诱导法等[2-4],这些模型各有特点,如化学法造模方法简单,成功率高,重复性好,但不能模拟口腔溃疡的复发情况;免疫法所致溃疡发生的病理过程和人类复发性口腔溃疡最为接近,但此法较复杂、耗时长,溃疡发生部位及数量不固定,成功率不高;机械损伤法与临床单纯创伤引起口腔溃疡接近。这些模型在药物治疗口腔溃疡的药效评价中得到了广泛的应用[5-7]。化疗药诱导的口腔溃疡模型鲜有报道和运用[8-9]。为进行进一步探索,本实验拟选用临床常用且会引起口腔黏膜炎或口腔溃疡并发症的几种化疗药物,通过局部黏膜内注射进行大鼠口腔溃疡模型的探索,以期寻找到一种稳定可靠的化疗药导致的口腔溃疡模型,为口腔溃疡的新药研究奠定基础。
1 材料
SD大鼠,SPF级,42只,♂,(200-220) g,购于湖南斯莱克景达实验动物有限公司,合格证号:43004700064531,许可证号:SCXK(湘)2016-0002,购进动物在恒温(22-26) ℃恒湿(40%-60%),12 h明暗交替条件下饲养。所有操作都符合江西中医药大学实验动物伦理学要求。
顺铂注射液(cisplatin injection,DDP),江苏豪森药业集团有限公司,批号190201;紫杉醇注射液(paclitaxel injection,PTX),北京双鹭药业股份有限公司,批号20190101;注射用硫酸长春新碱(vincristine sulfate for injection,VLB),深圳万乐药业有限公司,批号1403V2;注射用盐酸多柔比星(doxorubicin for injection,ADM),瀚晖制药有限公司,批号19006111;甲氨蝶呤(methotrexate,MTX),武汉东康源科技有限公司,批号20190730;TRIzol,ambion,批号204212;逆转录试剂盒,Thermo scientific,批号00621709;Syber Green 染料,applied biosystems,批号0075497;红细胞裂解液,康为世纪;APC anti-rat CD3,FITC anti-rat CD4,PE anti-rat CD8,BioLegend。
普通PCR仪(Eppendorf,mastercycler);荧光定量PCR仪(Applied Biosystems,ABI-7500),流式细胞仪(Beckman,Gallios),脱水机(浙江金华科迪,KD-TS3A),包埋机(孝感亚光医用,YB-6LF),切片机(LECIA,RM2016),显微镜(LECIA,DM4B),RNA纯度测定仪(Thermo,NanoDrop One)。
2 方法
2.1 动物分组将适应性喂养后的SD大鼠随机分为甲氨蝶呤组、顺铂组、紫杉醇组、长春新碱组和阿霉素组,每组7只。各组均以各药物最高可注射浓度为造模剂量(分别为甲氨蝶呤100 mg·L-1,顺铂5 mg·L-1,紫杉醇6 mg·L-1,长春新碱组1 mg·L-1,阿霉素8 mg·L-1,其中阿霉素组为最大耐受剂量),按每只50 μL注射体积计算,各组造模剂量分别为甲氨蝶呤组25 mg·kg-1,顺铂组1.25 mg·kg-1,紫杉醇组1.5 mg·kg-1,长春新碱组0.25 mg·kg-1,阿霉素组2 mg·kg-1,另设生理盐水对照组7只。
2.2 化疗药诱导大鼠口腔溃疡模型建立各模型组分别大鼠右侧口腔颊膜黏膜内注射相应浓度的化疗药物,注射体积为50 μL/只。对照组注射生理盐水,各组动物造模当天注射1次,造模后连续观察7 d。
2.3 体质量观察造模开始后,每2 d记录一次动物体质量,观察动物的一般情况及体质量变化。
2.4 摄食量观察造模后禁食24 h,造模次日每组定量给予食物,记录每笼动物的摄食量,并计算平均每只动物每日摄食量。
2.5 溃疡肉眼观察造模后24 h,观察记录溃疡形成情况,包括溃疡的出现率,溃疡外形及大小,观察记录溃疡愈合情况及愈合时间,愈合标准为黏膜上皮完全愈合,用镊子轻碰不会出现出血情况。
2.6 动物脏器指数观察造模后d 7,处死动物,剪取大鼠的胸腺和脾脏称重,并计算各组动物的脏器指数,脏器指数/%=脏器质量/体质量×100%。
2.7 溃疡组织病理学观察造模后d 7,各组动物随机选取3只,剪取大鼠右侧口腔颊膜黏膜造模部位组织放入10%中性缓冲福尔马林溶液中固定,脱水、石蜡包埋、切片、HE染色,显微镜下观察口腔黏膜组织病理学变化并拍照。
2.8 溃疡局部炎症因子表达造模后d 7,各组选取3只动物,剪取大鼠右侧口腔颊膜黏膜造模部位组织,剔除黏膜下多余肌肉等组织,留取黏膜,放置液氮速冻后,剪碎,加入TRIzol匀浆,提取RNA,经逆转录成cDNA后,采用Q-PCR技术检测组织中IL-1β、IL-6、TNF-α、EGFR等mRNA表达情况。根据NCBI设计各引物序列,由深圳华大基因股份有限公司合成。各引物序列见Tab 1。

Tab 1 Sequence list of each primer
2.9 流式细胞术检测外周血中淋巴细胞CD3、CD4、CD8表达造模后d 3和d 7,大鼠眼眶后静脉丛取血,肝素抗凝,加入红细胞裂解液裂解红细胞(按试剂盒操作步骤)后,1 000 r·min-1离心5 min,弃上清,100 μL含2%血清的PBS重悬细胞,冰上孵育APC anti-rat CD3、FITC anti-rat CD4、PE anti-rat CD8抗体20 min,2%血清的PBS洗2遍,200目尼龙网滤过,流式细胞仪检测外周血中淋巴细胞CD3、CD4、CD8的表达。
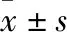
3 结果
3.1 造模后各组动物体质量的变化由Fig 1可以看出,各造模组动物在造模后,体质量增长不明显,在造模d 3-d 6,增长明显比正常组缓慢,与对照组相比,体质量明显减轻(P<0.05),造模d 7开始体质量有所增长,除顺铂组外,其余各组体质量与正常组没有明显差异。
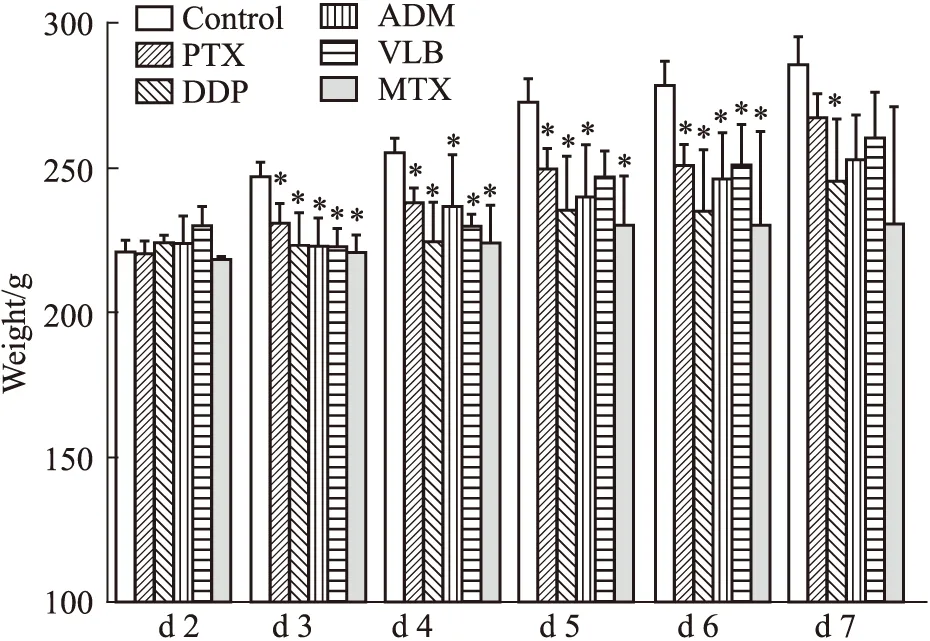
Fig 1 Body weight of rats in each group after modeling (,n=7)PTX:Paclitaxel group;DDP:Cisplatin group;ADM:Doxorubicin group;VLB:Vincristine group;MTX:Methotrexate group.*P<0.05
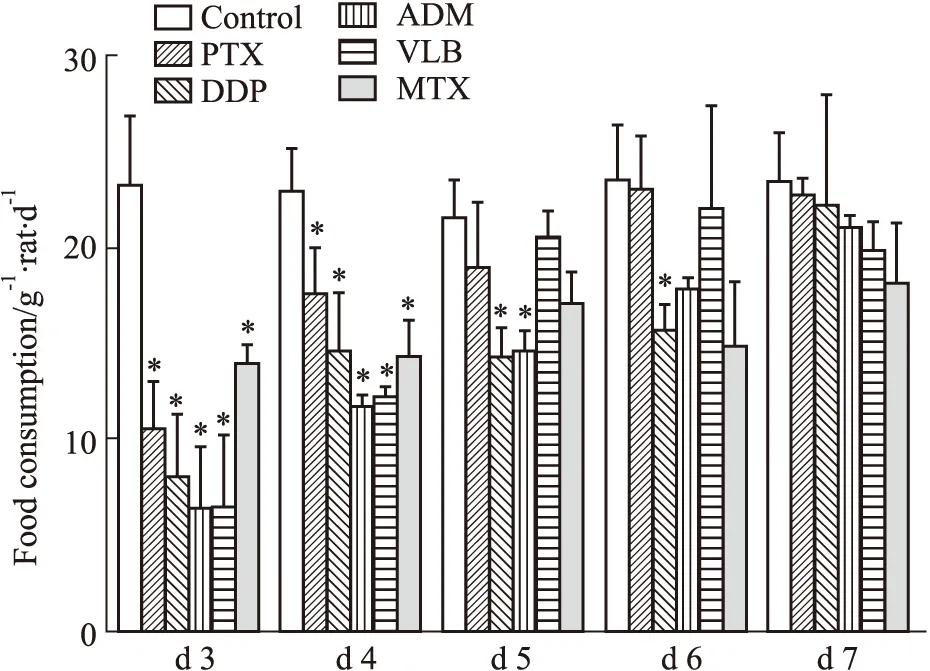
Fig 2 Food consumption changes of each group rats after modeling (,n=3)*P<0.05 vs control.
3.2 造模后各组动物摄食量的变化由Tab 2可以看出,与对照组比,各组动物在造模后摄食量减少,以造模d 3摄食量最低,然后逐渐恢复,其中在造模d 3和d 4,各造模组和正常组相比,摄食量明显减少(P<0.01),造模d 5,顺铂组和阿霉素组及造模d 6,顺铂组动物摄食量与正常组相比明显减少,差异有统计学意义(P<0.05)。造模d 7,各造模组动物摄食量基本恢复,和正常组动物摄食量相当。
3.3 造模后各组动物口腔溃疡形成情况与对照组比,模型组各组动物口腔造模侧均出现肿胀,刺激疼痛反应强烈,其中以阿霉素最为明显。顺铂组与紫杉醇组动物造模侧黏膜出现明显的溃疡面,表现为溃疡中央凹陷,边缘红肿,表面有化脓迹象,形状基本为规则圆形。而长春新碱组、阿霉素组和甲氨蝶呤组动物造模侧除了明显肿胀,并未见黏膜溃疡形成。见Fig 3。
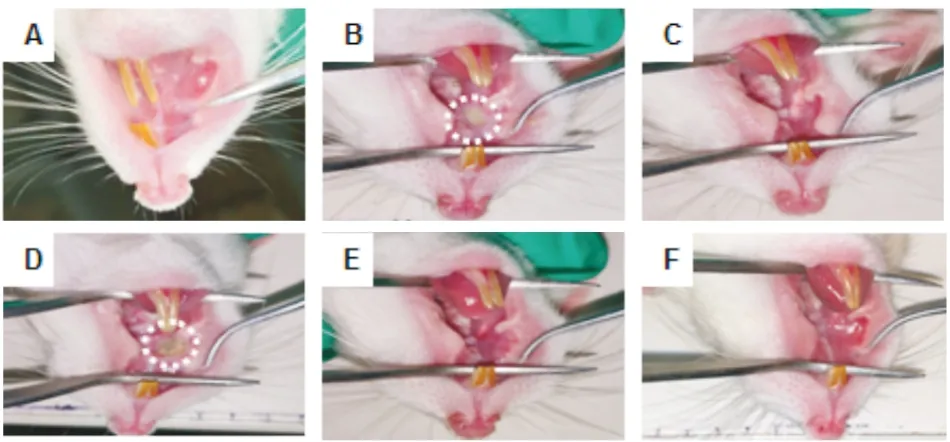
Fig 3 Formation of ulcers after modeling in various groups of ratsA.Control group;B.Cisplatin group;C.Vincristine group;D.Paclitaxel group;E.Doxorubicin group;F.Methotrexate group
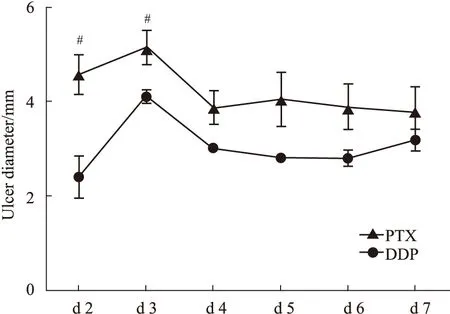
Fig 4 Changes in diameter of ulcers after modeling in PTX and DDP groups of rats (,n=7)#P<0.05 vs DDP groups.
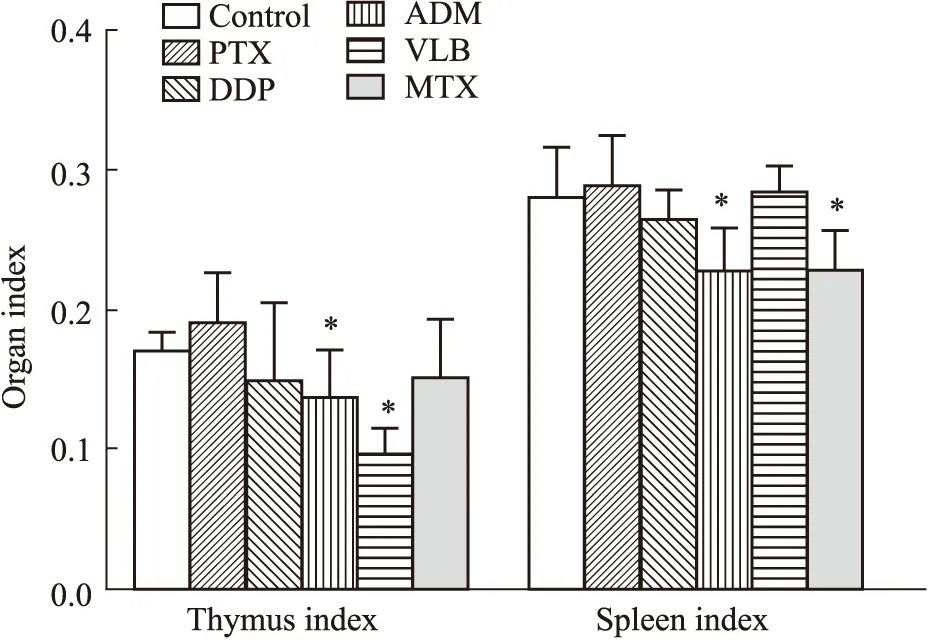
Fig 5 Organ index of rats in each group on the 7th day of modeling (,n=7)*P<0.05 vs control.
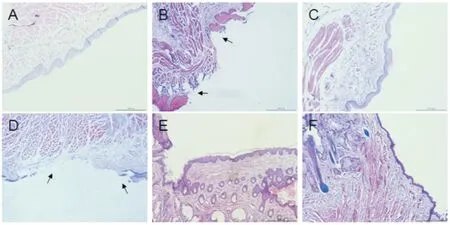
Fig 6 HE staining of mucosal tissues of rats in each group after modeling(×40)A:Control group;B:Cisplatin group;C:Vincristine group;D:Paclitaxel group;E:Doxorubicin group;F:Methotrexate group.Arrows indicate:epithelial shedding and defect.
造模d 2开始观察大鼠口腔黏膜溃疡形成情况,对有溃疡形成的大鼠进行口腔黏膜溃疡直径测量,本次实验在顺铂组和紫杉醇组中观察到溃疡的形成,两者溃疡直径变化趋势一致,呈先升高后降低的趋势,在d 3溃疡直径最长。在d 2和d 3紫杉醇组溃疡直径和顺铂组比较明显升高,且差异有显著性,整个观察周期,可以看出紫杉醇组所致的溃疡直径更大,更明显一些。
3.4 造模后d 7各组动物脏器指数造模d 7,取各组动物胸腺及脾脏,并计算其脏器指数,阿霉素组在造模d 7,其胸腺指数及脾脏指数与对照组比较明显下降,且差异有显著性;长春新碱组胸腺指数与对照组比较明显下降,且差异有显著性;甲氨蝶呤组脾脏指数与对照组比较明显下降,且差异有显著性。
3.5 造模后各组动物口腔黏膜组织病理学变化情况从黏膜组织HE染色看,对照组黏膜层上皮细胞排列整齐,黏膜完整;顺铂组和紫杉醇组黏膜上皮细胞层(如箭头所示)明显的脱落,缺损,但无明显炎性细胞浸润。甲氨蝶呤组、阿霉素组和长春新碱组黏膜上皮层结构完整,仅可见黏膜下导管腔扩张等。
3.6 局部炎症及相关细胞因子表达比较从炎性因子表达来看,造模7 d后,与对照组比较,紫杉醇组、顺铂组、阿霉素组的IL-1βmRNA表达明显升高;与对照组比较,紫杉醇组IL-6mRNA表达明显升高,甲氨蝶呤组的IL-6mRNA表达明显降低,差异有显著性;甲氨蝶呤组、长春新碱组在TNF-α mRNA与对照组比较,明显下降。顺铂组、长春新碱组、紫杉醇组在EGFR mRNA表达有明显降低。见Fig 7。
3.7 造模动物外周血中T淋巴细胞CD3、CD4、CD8的表达情况从外周血淋巴细胞中CD3、CD4、CD8分类来看,d 3、d 7,各造模组中CD3+CD4+CD8-细胞、CD3+CD8+CD4-细胞与对照组差异无显著性,且CD4+/CD8+比值与对照组无差异。见Fig 8。
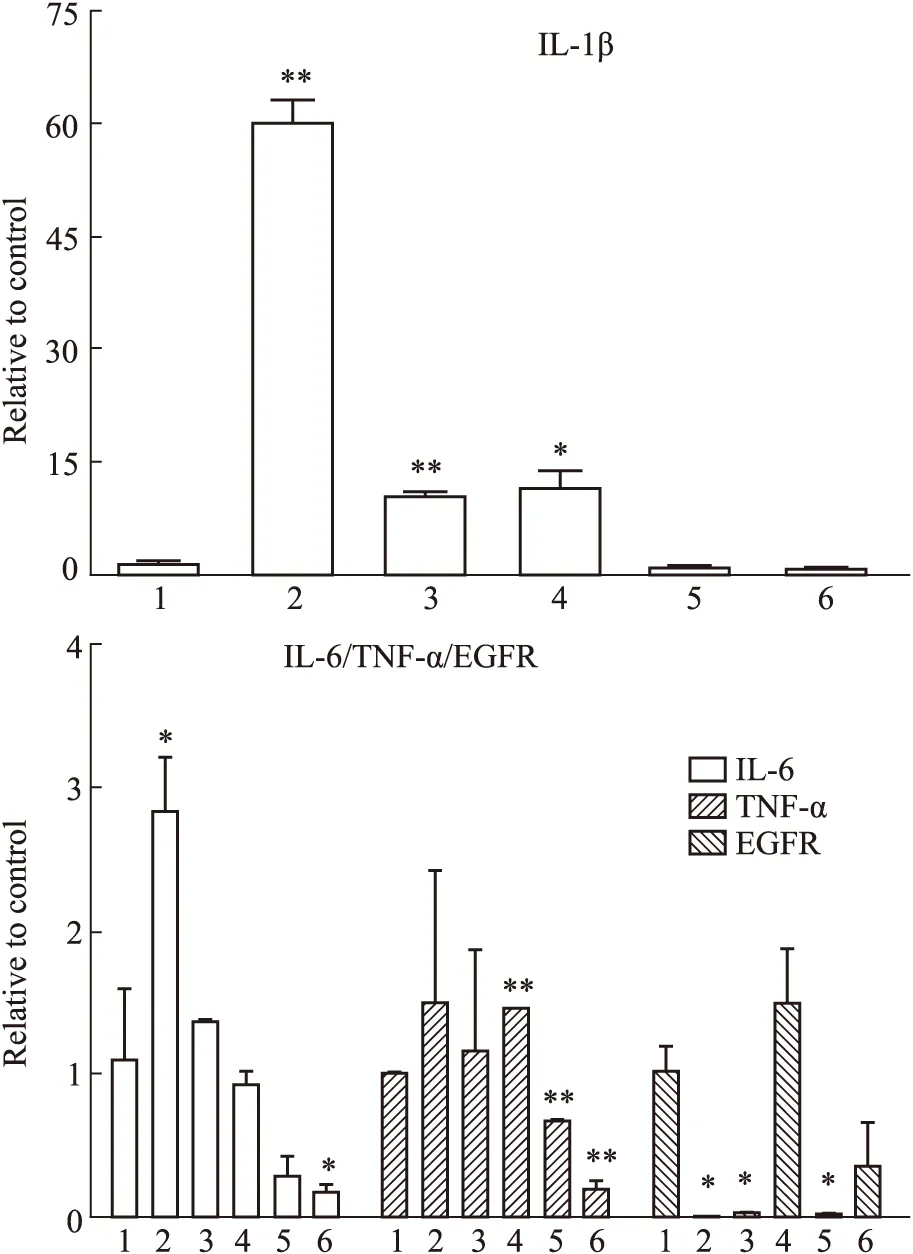
Fig 7 Local mucosal inflammatory and related cytokine mRNA expression (,n=3)1:Control;2:PTX;3:DDP;4:ADM;5:VLB;6:MTX.*P<0.05,**P<0.01 vs control.
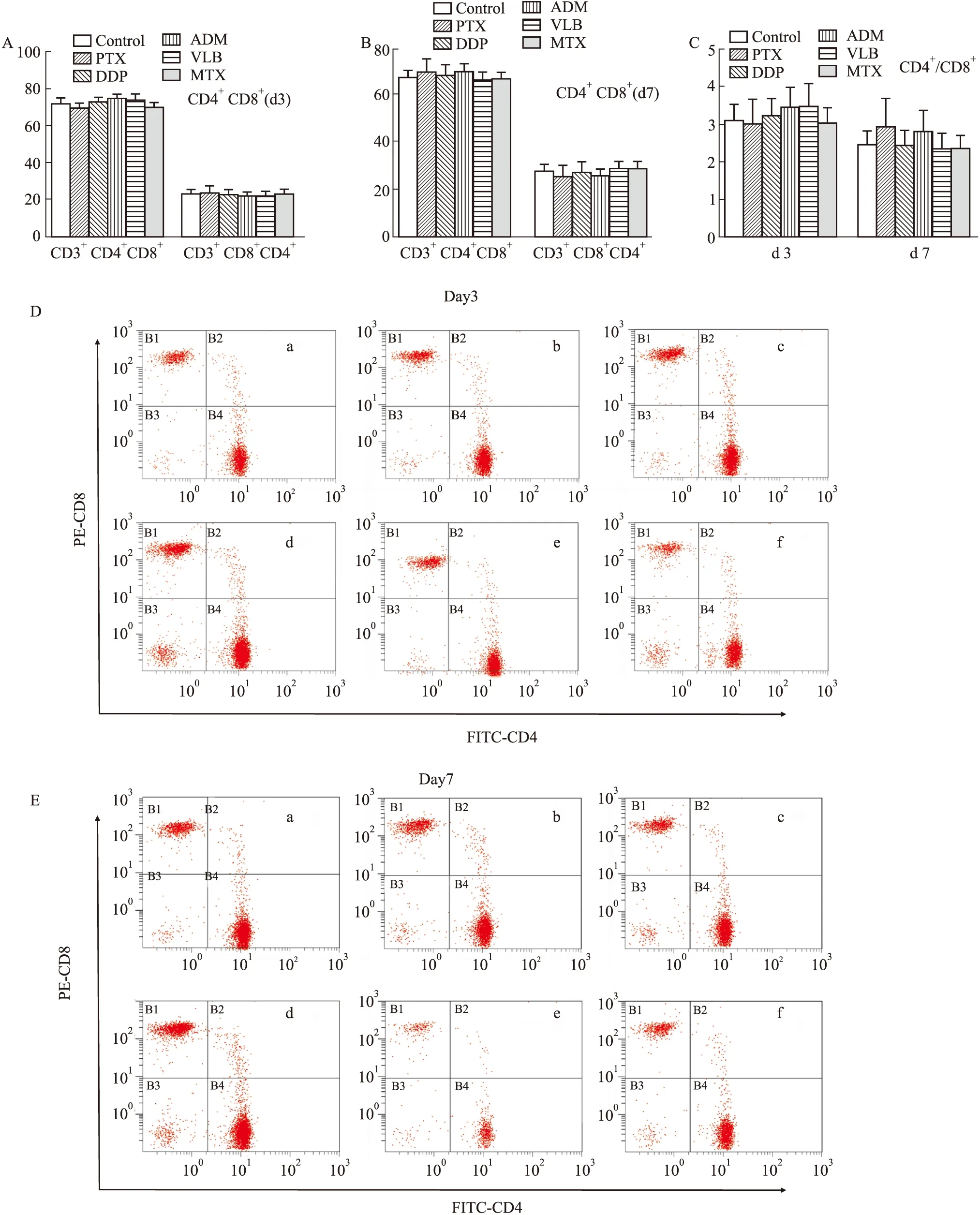
Fig 8 Expression of peripheral blood T lymphocytes (,n=7)A and B:The ratio of CD4+ and CD8+ cells in the peripheral blood of each group on the 3rd and 7th day of;C:The change of the ratio of CD4+/CD8+ in the peripheral blood of each group on the 3rd and 7th day;D and E:The changes in the peripheral blood of each group on the 3rd and 7th day of flow cytometric diagram of T cell classification.a.Control group;b.Cisplatin group;c.Vincristine group;d.Paclitaxel group;e.Doxorubicin group;f.Methotrexate group
4 讨论
化疗药物在杀死肿瘤细胞的同时,对口腔黏膜细胞也有直接损伤作用,它可以阻断口腔上皮细胞周期,而使口腔黏膜上皮细胞不能分裂和增殖,引起口腔黏膜发生溃疡,且溃疡多发生在口唇黏膜、双颊黏膜、口底黏膜和上腭黏膜等部位。临床报道易引起口腔溃疡的化疗药物有甲氨蝶呤、阿霉素、5-氟尿嘧啶、顺铂、长春新碱、紫杉醇等,尤其以甲氨蝶呤为最常见[10]。
本研究在前期研究基础上,选用甲氨蝶呤、顺铂、紫杉醇、阿霉素几种常用的化疗药物通过局部黏膜内注射进行口腔溃疡模型摸索,结果表明,顺铂和紫杉醇注射液组动物出现了明显溃疡,相比免疫法诱导的口腔溃疡模型出现的溃疡出现部位,大小不均一和固定,该模型更便于观察;后期实验还发现,溃疡形成的动物造模1周后还能见到明显溃疡,后续实验显示溃疡愈合时间为10-14 d,与化学损伤法诱导的溃疡愈合期6-9 d相比,时间窗更长,更有利于观察药物的治疗效果。从组织病理学来看,与化学损伤法诱导的溃疡不同,顺铂组和紫杉醇组的黏膜上皮细胞层虽明显的脱落、缺损,但无明显炎性细胞浸润。
口腔溃疡会导致口腔异常疼痛,疼痛会影响口腔功能,包括营养的摄入等[11]。对动物口腔内疼痛的研究,有使用麻醉大鼠和肌电图来测量机械和/或热刺激后的头部退缩反射来反应动物疼痛程度,也有使用清醒动物来评价的,前者会因为全身麻醉而影响到中枢和外周的疼痛知觉,使结果不易判断;后者需要一些特殊设备来检测。基于此,日本学者Suzuro用局部给予口腔溃疡大鼠辣椒素刺激,观察大鼠用前肢搓嘴或擦脸的次数来评价大鼠的疼痛程度,或者用磁化针穿刺大鼠下唇外周皮肤,通过一个4 g重物的牵拉稳定暴露口腔黏膜溃疡处,再用Von-Frey丝刺激,测量刺激引起的头部退缩阈值,以评估机械疼痛阈值[12-13]。考虑这些方法的可行性受诸多因素影响,且口腔黏膜损伤属于局部的病变,其疼痛是由于破损黏膜下神经末梢暴露相关。摄食可以刺激神经末梢而产生疼痛。因此摄食量的变化与黏膜损伤存在相关性。因此本实验观察了动物的摄食量,发现造模后紫杉醇组和顺铂组动物摄食量比正常组动物明显减少,这与针对放疗引起的口腔黏膜炎患者口腔功能变化的临床前瞻性多中心研究结果一致,该研究结果表明放疗引起的口腔黏膜炎患者吞咽固体食物量明显下降(P<0.000 1),口腔健康相关生活质量明显降低[14],因此,本实验认为摄食量的变化可以间接反映造模后大鼠的状态及疼痛程度。
放化疗所导致的口腔黏膜炎病理过程主要由开始、初始的损伤反应,信号放大,溃疡和愈合5个阶段组成。放化疗对黏膜的上皮细胞产生直接损害,氧化损伤开始,随之大量转录因子激活,引起一系列的炎症反应,炎症效应放大,加重黏膜组织的损伤,导致溃疡的形成。在这一过程中,炎症细胞因子如IL-1β、IL-6、TNF-α等起了非常重要的作用[15]。IL-6由T、B淋巴细胞,巨噬细胞等细胞分泌,生理状态下,上皮组织中含有少量IL-6,而在口腔黏膜炎组织中高表达,其表达水平与口腔黏膜炎的严重程度成正相关,文献研究表明,在大鼠放射性口腔黏膜炎中,IL-6在舌黏膜组织中的表达随黏膜炎的加重而增多[16]。和IL-6一样,IL-1β和TNF-α也是这一阶段重要的炎症因子,除了直接损伤黏膜,还可以引起炎症级联反应,经过放疗后的患者,口腔黏膜组织中IL-1β和TNF-α表达水平明显升高,与口腔黏膜炎症严重程度成正相关[17]。本次实验也观察到,黏膜出现明显溃疡的紫杉醇组和顺铂组,局部黏膜组织IL-1β mRNA表达水平明显升高,并且,紫杉醇组IL-6m RNA表达水平也明显升高,顺铂组IL-6m RNA表达水平较正常组有升高趋势;两组动物TNF-αm RNA的表达表现出升高趋势;而甲氨蝶呤组和长春新碱组的IL-6,IL-1β和TNF-αm RNA水平表达明显降低或有降低趋势,这与脏器指数的结果一致,考虑由于免疫抑制造成。
在溃疡愈合的阶段,与口腔黏膜上皮细胞增殖和分化、再生密切相关的EGFR起到了关键作用。EGFR普遍表达于表皮细胞和基质细胞,在正常口腔黏膜组织中可以检测到EGFR的表达,而在口腔溃疡的黏膜组织中表达明显下降,本实验也观察到,溃疡明显形成的紫杉醇组和顺铂组,局部黏膜组织的EGFR mRNA表达水平明显下降,与文献报道一致[18]。
另外本实验通过脾脏、胸腺指数,外周血CD4/CD8比例变化,观察了动物的免疫状态,结果发现,溃疡明显形成的紫杉醇组和顺铂组,脏器指数和CD4/CD8比值均没有明显变化,而阿霉素、甲氨蝶呤和长春新碱组对动物脾脏、胸腺等免疫器官有明显的抑制作用,但CD4/CD8比值无明显变化,由此可见,在本模型中,动物的免疫状态和溃疡形成不成比例关系。
综上,通过本实验的研究发现,阿霉素、甲氨蝶呤和长春新碱虽然免疫抑制明显,但未能直接观察到局部口腔溃疡的形成,而化疗药顺铂、紫杉醇经大鼠口腔黏膜内局部注射,可以形成稳定的口腔溃疡模型,从溃疡直径/面积、摄食量、局部细胞因子和炎症介质表达变化等方面可以评价药物对化疗药诱导的大鼠口腔溃疡的治疗作用,操作简单,溃疡形成稳定,可重复性强。因受样品限制,本实验中IL-6等细胞因子的表达仅在mRNA水平进行观察,还需要在蛋白水平进行进一步验证,此外,该模型局部黏膜细胞因子和炎症介质是一个动态变化过程,需进一步研究以更全面了解该模型的特点。

