苯磺酸芍药苷通过调控颌下腺GRK2-JAK1-STAT1/2信号通路治疗抗原诱导型小鼠干燥综合征
吴华勋,陈晓芸,刘 琪,张巧琳,黄 磊,周彤彤,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,抗炎免疫药物安徽省协同创新中心,安徽 合肥 230032)
原发性干燥综合征(primary Sjögren Syndrome,pSS)发病累及唾液腺、泪腺等外分泌腺,临床表现为口干、眼干[1],并伴随大量自身抗体产生,如抗SSA和SSB抗体等,以及高丙球蛋白血症[2]。pSS患者男女比例约为1 ∶9。
pSS的发病机制较为复杂,可能与基因、感染等因素有关。感染因素中EB病毒、Coxsackie病毒等与pSS的发病紧密相连[3]。病毒的感染激活树突细胞等免疫细胞分泌IFNα,发生适应性免疫反应[4]。唾液腺上皮细胞(salivary gland epithelial cells,SGECs)在IFNα或病毒的直接刺激下,分泌趋化因子如CXCL13,募集和活化淋巴细胞,使外分泌腺体发生淋巴细胞浸润。JAK1-STAT1/2信号通路的激活可能与IFNα或病毒的直接刺激下趋化因子CXCL13的产生有关。
目前临床上尚无疗效明确的医治pSS的药物。研究显示,白芍总苷(TGP)具备抗炎免疫调节效果,已广泛用于治疗类风湿关节炎、pSS等多种自身免疫病[5],但起效慢,作用较弱。课题组通过对TGP主要成分芍药苷(Pae)进行结构改造,获得了酯化产物苯磺酸芍药苷(代号CP-25),其生物利用度及抗炎免疫药理作用明显上升[6]。在关节炎的研究中发现,CP-25通过调节成纤维样滑膜细胞、B淋巴细胞、T淋巴细胞等细胞的功能发挥其治疗作用[7-8]。G蛋白偶联受体激酶(G protein-coupled receptor kinase,GRK)经磷酸化配体激活的G蛋白偶联受体,使β-arrestin与之聚合,进而阻止G蛋白与受体偶联,产生受体“脱敏”[9]。课题组研究发现,CP-25对小鼠实验性关节炎的治疗作用与其调节GRKs的活性相关[10]。实验性干燥综合征(experimental Sjögren's Syndrome,ESS)小鼠经CP-25治疗后病症有所改善[11-12],CP-25作用的发挥是否与其调节GRK2与JAK1的结合,进而抑制JAK1-STAT1/2-CXCL13信号通路减少淋巴细胞浸润有关?目前尚无文献报道。
本实验使用C57BL/6小鼠,采用颌下腺蛋白建立了抗原诱导ESS模型,确立CP-25对ESS小鼠模型的作用,探讨其作用机制是否通过调节GRK2与JAK1的结合,抑制JAK1-STAT1/2-CXCL13信号通路而发挥作用,为以后探索CP-25的药物机制具有现实意义。
1 材料
1.1 实验动物动物:购自安徽省实验动物中心,生产许可证号码:SCXK(皖)2011-002。为SPF级、体质量约为18 g,♀ C57 BL/6小鼠。
1.2 实验细胞人类颌下腺上皮细胞(human salivary gland epithelial cells,HSGECs),购于European Collection of Authenticated Cell Cultures(ECACC)。
1.3 药品与试剂CP-25由安徽医科大学临床药理研究所提供,硫酸羟氯喹(150902)自上海中西制药有限公司购买;戊巴比妥钠(69020100)、毛果芸香碱(PHR1494)购自美国Sigma公司;重组人IFN-α(NBP2-26651)、CXCL13抗体(NBP2-16041)购自Novus Biologicals公司;JAK1抗体(3344)、Phospho-JAK1抗体(3331)、Phospho-STAT1抗体(9167)、Phospho-STAT2抗体(4441)购自CST公司;STAT1抗体(sc-464)、STAT2抗体(sc-514193)、GRK2抗体(sc-13143)购自美国Santa Cruz公司。
1.4 主要实验仪器Leica TCS SP8激光共聚焦显微镜,德国Leica公司;一体式化学发光成像系统,美国GE公司。
2 方法
2.1 ESS小鼠模型的建立、分组及给药无菌取出C57BL/6小鼠双侧颌下腺,称重,冰上匀浆器中研磨,匀浆放入管中,4 ℃离心(3 000 r,15 min),BCA定量至5 g·L-1,等量弗氏完全佐剂乳化至2.5 g·L-1。d 0将上述乳化后的抗原皮内多点注射至小鼠背部和尾根部,d 7再次注射。d 14将颌下腺抗原在等量弗氏不完全佐剂中乳化至2.5 g·L-1,注射加强免疫。
根据唾液流量,第6周剔除未成模小鼠,将小鼠分为:正常组、模型组、浓度为35、70 mg·kg-1的CP-25组和浓度为80 mg·kg-1的羟氯喹(hydroxychloroquine,HCQ)组。给药组于第7周开始连续2周的灌胃给药,同体积的0.5% CMC-Na给予正常组和ESS组。第9周处死小鼠。
2.2 小鼠唾液流率的检测小鼠的唾液量在造模后第6、7、8、9周进行测定。小鼠经2.4%戊巴比妥钠麻醉后,将浓度为0.125 g·L-1的毛果芸香碱腹腔注射,5 min后将已称重的无菌棉球置于小鼠舌下,收集10 min,称量后计算差值。
2.3 小鼠颌下腺HE检测取颌下腺制作病理切片,经苏木精-伊红染色,脱水、烘干后,镜下观察结果,拍照。
2.4 免疫组化法测定小鼠颌下腺CXCL-13水平小鼠颌下腺切片,经脱蜡冲洗后,将一抗CXCL-13(1 ∶100)滴至切片组织上,4 ℃ 孵育过夜,冲洗后滴加反应增强液孵育30 min,冲洗后加入适量DAB显色液,脱水晾干后封片。镜下观察结果,拍照。
2.5 免疫印迹法测定小鼠颌下腺中JAK1-STAT1/2通路的表达取出小鼠颌下腺,称重,加细胞裂解液,4 ℃冰上匀浆,BCA定量后,加入Loading Buffer煮样;配胶、灌胶、上样、电泳、转膜、封闭,孵育一抗(JAK1、p-JAK1、STAT1、p-STAT1、STAT2、p-STAT2,约以1 ∶1 000比例配置);孵育二抗,于37 ℃恒温摇床中孵育2 h;显影液涂在PVDF膜上,使用化学发光成像仪显影。ImageJ软件条带解析。
2.6 免疫荧光法测定HSGECs中CP-25对GRK2与JAK1共表达的作用培养HSGECs细胞,传代时培养皿内放入无菌盖玻片,待HSGECs爬片后,IFN-α(10 μg·L-1)刺激48 h后;取出盖玻片,固定、清洗,细胞通透使用0.5% Triton-100,BSA进行封闭,加一抗(JAK1,GRK2)孵育;清洗后滴加两种对应的荧光二抗,避光孵育;DAPI染色后加入防荧光淬灭剂进行封片;镜下拍照并对共表达进行分析。
2.7 CO-IP检测HSGECs中CP-25对GRK2与JAK1相互作用的影响将HSGECs接种于细胞培养皿中,分为对照组、浓度为10 μg·L-1的IFNα组、浓度为10-5mol·L-1的IFNα+CP-25组,培养48 h,洗涤细胞,加入裂解液(RIPA ∶PMSF=1 ∶99)置于冰上裂解,4 ℃离心取上清;部分作为input后,准备Protein A agarose(1个样品+20 μL珠子),清洗珠子后留取液体,加入12 μL抗体(1个样品+4 μL抗体),4 ℃旋转混匀;离心,将样品与beads 结合置于4 ℃旋转混匀器中过夜;离心,弃上清,将32 μL裂解液和8 μL电泳上样缓冲液加入样品中,煮沸,后续操作同WB。
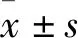
3 结果
3.1 CP-25对ESS小鼠唾液量的影响造模后第7周,ESS模型组小鼠的唾液流率较正常组明显降低。给药1周,CP-25(70 mg·kg-1)组小鼠唾液流率较ESS小鼠明显增加;给药2周,剂量为35,70 mg·kg-1的CP-25组和剂量为80 mg·kg-1的HCQ组小鼠唾液流率明显增多。
3.2 CP-25对ESS小鼠颌下腺病理的影响ESS小鼠颌下腺中淋巴细胞浸润较正常组严重,聚集成灶,唾液腺的小叶结构消失,局部小血管因炎症扩张充血。与ESS模型组相比,浓度为70 mg·kg-1的CP-25和浓度为80 mg·kg-1的HCQ组中的颌下腺淋巴细胞浸润明显改善。
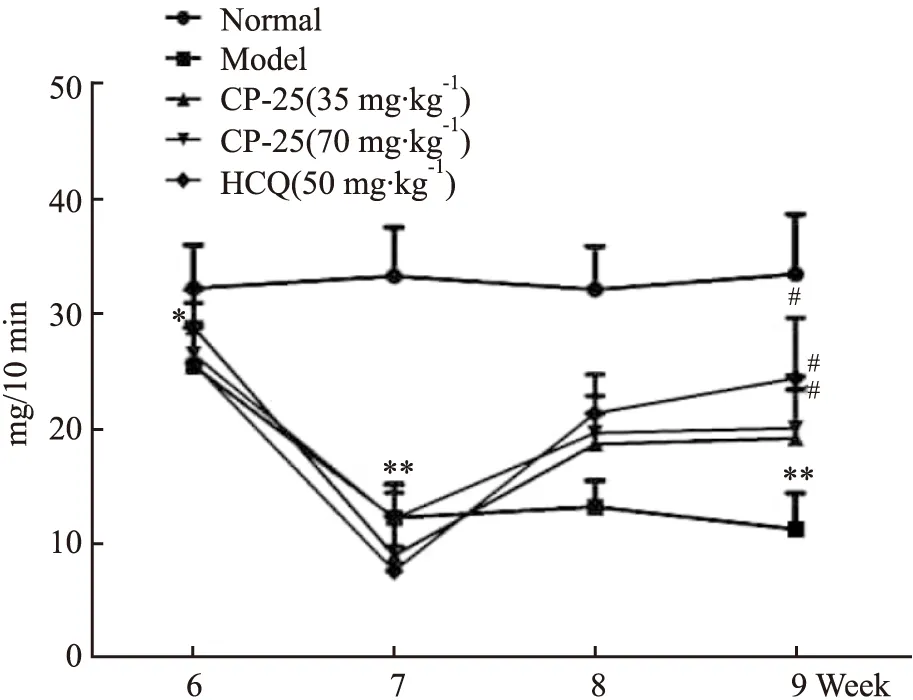
Fig 1 Effects of CP-25 on saliva flow in ESS n=8)**P<0.01 vs normal;#P<0.05 vs model
3.3 CP-25对ESS小鼠颌下腺CXCL-13表达的影响通过IHC测定小鼠颌下腺CXCL-13的水平,ESS小鼠颌下腺中CXCL13的水平较正常组明显升高,可能与颌下腺上皮细胞表达相关。浓度为35,70 mg·kg-1的CP-25组较ESS组可明显降低小鼠颌下腺中CXCL13的表达。
3.4 CP-25对ESS小鼠颌下腺JAK1-STAT1/2信号通路的影响CP-25对小鼠颌下腺中JAK1-STAT1/2的变化用WB检测。ESS小鼠颌下腺中p-JAK1、p-STAT1、p-STAT2水平较正常组比明显升高,提示ESS小鼠颌下腺JAK1-STAT1/2信号通路被激活。CP-25(70 mg·kg-1)和HCQ(80 mg·kg-1)组可明显降低p-JAK1、p-STAT1、p-STAT2蛋白的表达,提示CP-25可抑制ESS模型小鼠颌下腺JAK1-STAT1/2通路的激活。
3.5 CP-25促进GRK2与JAK1的结合采用激光共聚焦检测GRK2与JAK1共表达情况,结果显示,GRK2与JAK1在HSGECs中均有表达,多存在于胞质,其次是胞膜。与正常对照组相比,IFN-α刺激后,GRK2与JAK1共表达下降,CP-25(10-5mol·L-1)能提高GRK2与JAK1的共表达。CO-IP结果与免疫荧光相似,IFN-α刺激后,GRK2与JAK1相互结合作用减弱,CP-25(10-5mol·L-1)能提高GRK2与JAK1的结合。
4 讨论
pSS是一种慢性系统性自身免疫病,外分泌腺易产生灶性淋巴细胞浸润。唾液流率及唇腺活检是确诊pSS的重要方法。在本实验中,ESS小鼠采用颌下腺抗原诱导SS模型,唾液流率明显减少,颌下腺病理中出现大量淋巴细胞浸润,聚集成灶,证明模型诱导成功。ESS小鼠的唾液流率经CP-25治疗后明显增加,颌下腺病理也得到改善。
对pSS患者唇检时,多数患者产生异位生发中心(EGC),这类患者淋巴细胞浸润严重,与B淋巴细胞异常表达有关。B淋巴细胞参与pSS的发病表现在:迁移、聚集在炎性组织中造成EGC、B淋巴细胞亚群分布异常、分泌多种自身抗体等[13]。淋巴浸润灶的形成有多种趋化因子和炎症因子的参与,其中使B淋巴细胞发生迁移和聚集的趋化因子主要有CXCL13[14],由树突细胞及巨噬细胞分泌,是目前所知独有的可与CXCR5受体结合的配体。在淋巴浸润灶及EGC中,CXCL-13表达的异常加快了疾病的发生[15]。在NOD/LtJ小鼠SS模型中,采用抗CXCL-13抗体治疗,可通过抑制B淋巴细胞在唾液腺组织的浸润,使唾液腺炎症反应降低[16]。CXCL-13在pSS中明显升高,可反映疾病的严重程度。本实验中ESS小鼠颌下腺中CXCL-13的蛋白水平明显升高,CP-25可明显降低其表达。CXCL-13的表达还可能与SGECs分泌有关。
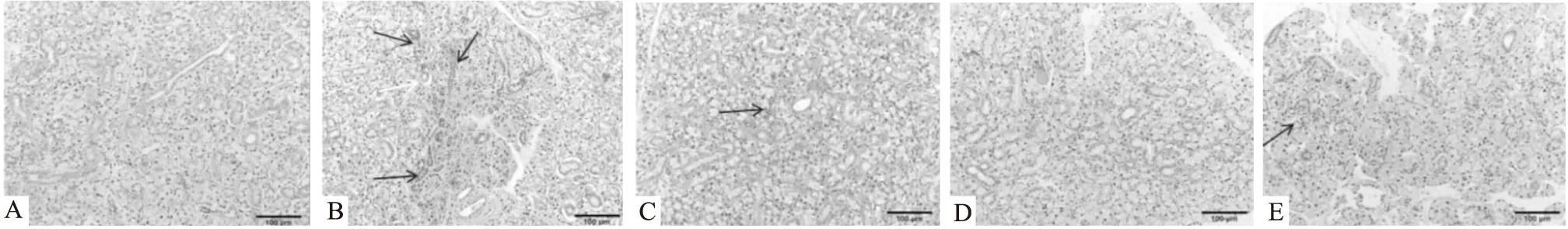
Fig 2 Effects of CP-25 on pathological of salivary gland in ESS miceA:Normal;B:Model;C:CP-25(35 mg·kg-1);D:CP-25(70 mg·kg-1);E:HCQ(80 mg·kg-1)
Fig 3 Effects of CP-25 on CXCL13 expression in salivary gland in ESS miceA:Normal;B:Model;C:CP-25(35 mg·kg-1);D:CP-25(70 mg·kg-1);E:HCQ(80 mg·kg-1)
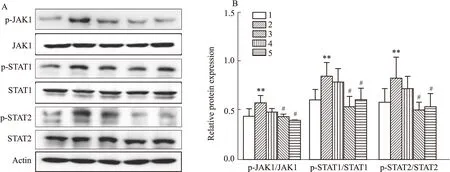
Fig 4 Effects of CP-25 on JAK-STAT1/2 expression in salivary gland in ESS mice n=3)1:Normal;2:Model;3:CP-25(35 mg·kg-1);4:CP-25(70 mg·kg-1);5:HCQ(80 mg·kg-1);**P<0.01 vs normal;#P<0.05 vs model
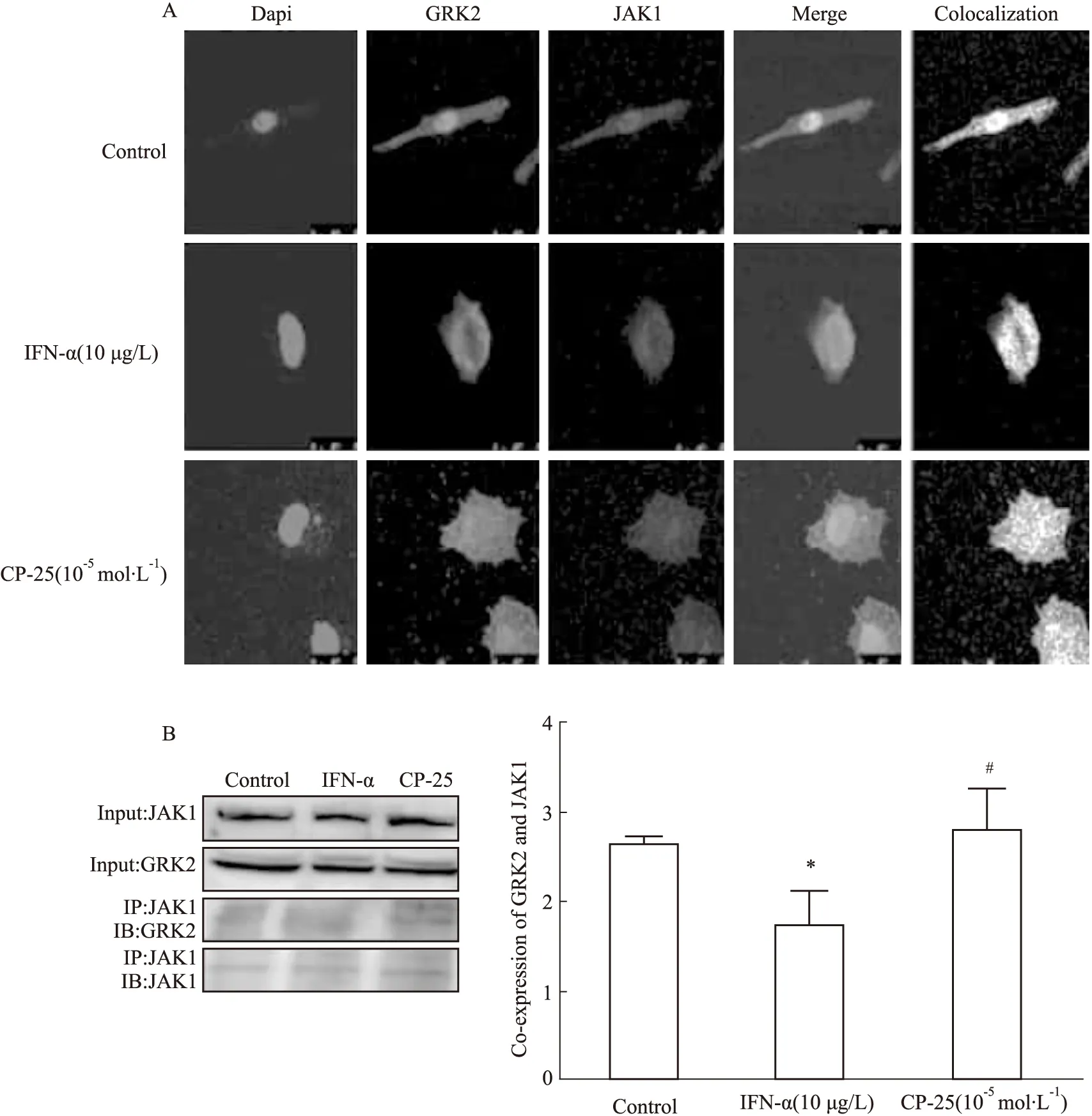
Fig 5 Effects of CP-25 on co-expression of GRK2 and JAK1*P<0.01 vs normal;#P<0.05 vs model.A.The effects of CP-25 on the co-expression of GRK2 and JAK1 by immunofluorescence;B.The effects of CP-25 on the combination of GRK2 and JAK1 by CO-IP n=3)
SGECs可表达多种共刺激分子、粘附分子及B 细胞活化分子具有抗原提呈作用。SGECs不仅是异常免疫反应的靶细胞,在IFNα和病毒的刺激下可分泌BAFF、IL-6、CXCL12和CXCL13等,促进B 细胞、T 细胞、DC 细胞的聚集[17]。因此,SGECs作为效应细胞启动和维持了免疫反应。在pSS的发病机制中,由细菌、病毒、RNA等引发IFN的大量产生,进而引起免疫细胞及细胞因子的异常改变越来越受到关注。细胞内信号级联反应可能由IFNs经过JAK-STAT激活,产生多种炎性细胞因子及趋化因子如CXCL-13,JAK/STAT信号级联可能是IFN发挥作用的关键途径[18]。本实验研究发现,ESS模型小鼠颌下腺中p-JAK1、p-STAT1和p-STAT2表达明显升高,JAK1-STAT1/2激活;CP-25可明显抑制JAK1-STAT1/2信号的活化,可能进而降低了CXCL-13的表达。
目前临床上治疗pSS尚无理想药物。大量临床研究发现,TGP治疗pSS有明确疗效,但起效较慢。CP-25对NOD/LtJ小鼠自发型、C57BL/6小鼠抗原诱导型干燥综合征模型均具有明显的治疗作用[11-12]。本实验中,CP-25可能通过抑制JAK1-STAT1/2-CXCL13信号活化而降低B淋巴细胞的迁移,发挥对抗原诱导型ESS模型小鼠的治疗作用,CP-25作用的靶蛋白GRK2是否对JAK1有直接作用呢?本实验通过免疫荧光共定位及CO-IP检测发现,GRK2与JAK1在HSGECs中均有表达,IFNα刺激后,GRK2与JAK1共表达下降,CP-25(10-5mol·L-1)能提高GRK2与JAK1的共表达。CO-IP结果与免疫荧光相似,IFN-α刺激后,GRK2与JAK1相互结合作用减弱,CP-25(10-5mol·L-1)能提高GRK2与JAK1的结合。
根据以上结果推测,CP-25可能通过抑制GRK2的转膜,而恢复胞质内GRK2与JAK1的结合,进而抑制JAK1-STAT1/2-CXCL13信号的活化,降低B淋巴细胞的迁移、浸润,改善颌下腺淋巴浸润灶,提高唾液流率,发挥对ESS小鼠的治疗作用。本课题为研究CP-25治疗ESS的作用机制奠定了实验基础,并为今后CP-25的临床使用提供了理论依据。

